鼠脑神经网络的同步辐射3D成像研究
亢舜彤 吴 桐 陈焯辉 张萌琦
(中南大学湘雅医院神经内科 长沙410008)
人体有数以百亿计的神经元维持生理活动,脑功能主要依赖于神经元的聚集及其形成的神经网络。脑复杂生理功能的维持依赖于微神经网络结构的完整,因此对脑神经血管网络结构及连接的研究有助于深入理解和认知脑的复杂功能[1]。脑血管疾病的病理生理过程涉及血管和神经结构复杂的损伤修复,当出现异常时,神经血管单元将发生结构与功能重塑,使机体微神经网络稳态失调,进而影响患者机体生理活动,严重时可能导致患者神经功能缺损甚至死亡[2]。精准的脑部结构解析提供神经网络的精细结构,是深入神经科学研究的关键。因此,获得三维超高分辨率数字化成像和立体网络形态结构参数是评估中枢神经系统疾病病理改变的重要前提。
同步辐射显微成像技术已被公认为探索生物三维结构的有力工具,其分辨率最高可至亚微米级。中国上海同步辐射装置具备强大的中等能量光源,当高能电子接近光速在储存环中运动时,其运动方向在磁场的作用下发生变化,产生的电磁辐射因而具有高能量、高相干、高方向性、高效率、准平行等特性,比实验室或医用X射线源所获得的光束高出十个量级以上,可为本研究提供高精度数据[3]。目前,利用同步辐射光源对生物脑组织结构进行的相关科学研究往往集中在血管网络,而涉及单个及多个神经元网络连接成像方面的研究较少。
早期的高尔基染色法能完整地标记包括胞体、树突、树突棘甚至轴突在内的整个神经元形态,使人类对神经元的微观结构、其在脑内的宏观分布及脑内局部网络的连接有了新的认识。高尔基染色法经不断改良,衍生了多种染色方法,本实验应用的高尔基-考克斯(Golgi-Cox)染色法是一种经典的形态学染色方法,通常用于神经生物学的树突形态及树突棘研究。研究表明,采用高尔基-考克斯染色法可获得单个神经元的树突形态结构,但由于缺乏合适的细胞显微结构成像方法,难以获得准确的3D神经元结构信息等因素,这限制了其在神经元形态精准分析中的应用[3]。组织切片常用于表征小至微米级的血管神经形态,但切片制备过程通常耗时,仅能提供二维切面信息,而无法提供神经元3D信息,切片处理还会破坏脑标本结构的完整性,对于神经元形态的研究具有一定的局限性。因此,开发新型微成像方法对于在生理和病理条件下非损伤性检测复杂显微神经网络变化并提供高分辨率成像具有极为重要的意义[4]。新兴的同步辐射技术突破了传统光学成像方法的衍射极限,利用亚微米至微米量级的极高分辨率,可以实现对物质显微结构的无损、三维成像。本文旨在将高尔基-考克斯染色法与同步辐射成像相结合,发展出一种快速高通量的成像方法,以期能够获取全脑高尔基-考克斯染色神经元的形态及其3D解剖结构学信息。
1 材料与方法
1.1 小鼠脑样本制备
实验选用正常成年雄性C57小鼠12只,均饲养于动物实验室内的独立换气笼中,并分笼饲养,12 h昼夜变换光照,给予水和标准饲料,供其自由摄取。人工控制室内环境温度22~24℃,相对湿度60%~80%。有动物死亡时需及时依次补入。所有小鼠随机等分为A、B两组,每组6只,其中B组再随机等分为两组,每组3只。B组内小鼠均进行高尔基-考克斯染色处理,但一组取全脑样本,一组取局部海马区组织方块。本实验所有操作和动物手术均已取得中南大学动物伦理委员会的批准。
用10%水合氯醛溶液(4 mL·kg-1,腹腔注射)过量麻醉两组小鼠后,于仰卧位在胸部做一个长皮肤纵切口,再于左肋和胸骨交界处打开胸腔,剥离心包膜,以暴露心脏和升主动脉根部,并将针头插入左心室至主动脉口,调整灌注流速后固定针头。剪开右心耳,予以37℃预热后生理盐水持续灌注,控制流速以保证液柱在莫菲氏管中直线流动,直至肝脏由棕色转为淡白色,且右心房流出液体由红转白后,停止灌注。灌注过程中适当改变小鼠的体位,以使小鼠毛细血管中的血液得到充分置换。术后予以新鲜预热的4%多聚甲醛溶液进行血管内灌注固定,可见小鼠的四肢和尾巴出现抽搐。小鼠肢体僵硬后灌注完毕,即刻手术剥离A、B组小鼠全脑组织,放入4%多聚甲醛溶液固定约24 h。
A组的脑组织样品再分别用50%、75%、85%、95%、100%乙醇各处理24 h进行梯度酒精脱水,后保存在4℃100%酒精中,扫描前自然风干,于冻存管常温密封保存,用于同步辐射光源扫描。
B组的脑组织样品后续操作步骤如下:
1)配置Cox液:将1 g升汞(HgCl2)和1 g重铬酸钾(K2Cr2O7)溶于64 mL蒸馏水,将0.8 g铬酸钾(K2CrO4)溶于16 mL蒸馏水,再将两者混合均匀,过滤后取上清液。
2)固定、染色:将小鼠脑组织取出,用细线系住脑组织将其悬挂于盛有新鲜配置的Cox液的棕色试剂瓶中,用铝箔纸包瓶,置于温度为20~25℃的避光环境中进行固定。固定1~2 d后,更换新配置的Cox液,每30~60 d更换一次新鲜Cox液。鼠脑需要在Cox液中固定、染色至少180 d。
3)黑化、冲洗:将固定、染色后的脑浸入1%氢氧化锂(LiOH)中,用量约40 g/脑,使标本黑化,在摇床上摇动24 h,摇床回转直径20 mm,转速1 r·s-1,后续的脱水步骤中浸有标本的棕色瓶也需要放在摇床上,摇床转速相同。之后用流水冲洗标本24 h。
4)脱水:把冲洗后的鼠脑依次浸入50%、75%、85%、95%、100%酒精、100%酒精-丙酮(1:1)、100%丙酮24 h,然后浸入另一瓶100%丙酮中10 h,使标本彻底脱水。不同浓度脱水剂的用量至少为8 g/脑。
5)扫描前自然风干,于冻存管常温密封保存,用于同步辐射光源扫描。
1.2 同步辐射成像
1.2.1 实验装置
本实验在中国科学院上海应用物理研究所上海同步辐射光源(Shanghai Synchrotron Radiation Facility,SSRF)X射线成像与生物医学应用光束线站(BL13W1)完成。上海光源全能量注入器包括150 MeV电子直线加速器、3.5 GeV增强器及高能和低能输运线。电子束由加速器加速至150 MeV,经低能输运线注入增强器后能量提高至3.5 GeV,再经高能输运线注入3.5 GeV高性能电子储存环,电子束沿着束流轨道循环运动,在磁场作用下改变运动方向时释放同步辐射。BL13W1线站配备电离室、高空间分辨X射线探测器、大视场X射线探测器、X射线荧光探测器、六轴样品台、大承重电动台及图形工作站等。该线站利用插入件扭摆器作为光源,经液氮冷却双晶单色器将白光单色化,为医用成像提供光子能量范围为8~72.5 keV非聚焦单色光,光子通量密度可达3×1010s-1·mm-2@20 keV,最大光斑尺寸可达45 mm(水平)×5 mm(垂直)。实验站使用VC架构设计自动化控制程序采集数据,将样品放置于指定位置后即可触发探测器进行X射线投影及图像数据采集。样品到光源点的距离为34 m,探测器到样品的最大距离为8.0 m,优化能量和距离等参数可以获得高质量成像[5-6]。
1.2.2 扫描操作
分别将晾干的A、B组脑组织样本牢固地固定在样品台中心,并保证其垂直于光路。为了获得最佳的脑血管相位对比图像,X射线光束的尺寸约为45 mm(水平)×5 mm(垂直),使用带有Si(111)和Si(311)晶体的双晶单色仪对X射线进行单色,其最佳能量为20.0 keV。A组进行CT扫描时,旋转台以0.25(°)·s-1的速度旋转180°,原始的Tomo图像由16位水冷X射线单个像素大小为3.25 μm的成像探测器拍摄,曝光时间为0.8 s,样品到检测器(硅漂移探测器(Silicon Drift Detector,SDD))的距离为50 cm。B组进行CT扫描时,旋转台以0.25(°)·s-1的速度旋转180°。全脑组织原始的Tomo图像由16位水冷X射线单个像素大小为3.25 μm的成像探测器,曝光时间为0.8 s,样品到检测器的距离为5 cm。海马区组织方块原始的Tomo图像由16位水冷X射线单个像素大小为0.65 μm的成像探测器拍摄,曝光时间为0.8 s,样品到探测器的距离为5 cm。
1.2.3 数据处理
通过参数计算,单个脑样本的二维原始投射总数为900幅。同时,每180幅投影图像采集一次白场图像(记录光路中无样品时的图像),最后收集暗场图像(记录无光照射时的图像)。所有二维原始投射图像使用Image-Pro Plus 6.0图形处理软件进行处理,采用背景减法技术消除白场平场和暗场暗图像的干扰,同时通过调整对比度、设置低通滤波和锐化增强等处理,获得最佳的投影图像。
所得到的二维slice可根据血管及其他组织的不同结构特征和灰度分布,设置适当的过滤器,以增强神经元的结构图像并抑制其他组织或图像的噪声。选取可视化软件Amira 6.0对数据块中的神经元进行追踪重建。Amira 6.0可实现从多平面和多角度观察重建后处理的连续切片图像,同时通过分块加载和体素转换,不仅可以重建脑表面血管形态的三维构象,还能提取神经网络的三维结构,进而对局部神经网络进行精细化重建。图1为神经元多色成像流程图。
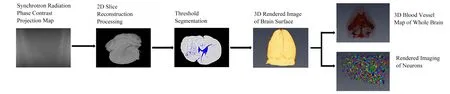
图1 神经元多色成像流程图Fig.1 Procedures of neuron multicolor imaging
2 结果
2.1 神经元二维显影
小脑是机体的平衡调节中枢,海马区是具有记忆功能的重要脑区,二者在研究脑部神经功能中有重要意义。分别选取包含小脑的脑组织及从海马部位获取的局部组织块进行扫描后得到断层显微成像数据,在图2中显示了鼠脑冠状面切面图像。X射线吸收衬度成像利用物质的电子密度不同而对射线的吸收不同而形成图像衬度,未经处理的生物软组织密度相近,对射线吸收程度相似,形成图像衬度有限,无法特异性显示神经元细胞。高尔基-考克斯染色属于重金属染色法,是神经元显影的特异性染色方法,可以仅对神经元染色而背景无干扰。对样品进行高尔基-考克斯染色,被染色的神经元注入高密度元素,其和未被染色的低密度组织区域对射线的吸收程度即存在显著差异。采用同步辐射成像,获得的图像具有较高的对比度和空间分辨率,可使神经元能够与周围组织清晰地区分开来,因此图像中为亮色结构即为神经元。
图2(a)为使用单个像素大小为3.25 μm的成像探测器拍摄的未经高尔基-考克斯染色处理脑组织,此时仅能观察到切面的大体轮廓,所摄区域无明显差异,无法显示神经元分布。图2(b)为使用单个像素大小为3.25 μm的成像探测器拍摄的经高尔基-考克斯染色脑组织,观察到脑实质中包括皮质和髓质在内不同层次的二维构筑,同时可显示分散在整个脑区的亮色神经元,为后续获取神经元定位与组织解剖3D关系提供基础。图2(c)为使用单个像素大小为0.65 μm的成像探测器拍摄的经高尔基-考克斯染色处理的海马区组织方块,与图2(b)相比分辨率更高。可观察到该区域神经元的形态以及部分神经元的相互连接,展示脑内的精密的微神经网络。该部分研究通过选取不同分辨率的探测器扫描样品内部结构,得到的结果证明单个像素大小为0.65 μm的成像探测器更适合观测局部神经网络的精细结构,但观测视场明显减小,要求样本足够小以适合视场观测范围。单个像素大小为3.25 μm的成像探测器可以获得整体结构,但在观测显微结构方面略有不足。本实验为多尺度解析靶区的3D神经网络形态结构提供实验依据。

图2 二维slice脑切片图(a)单个像素大小为3.25 μm的成像探测器扫描的未经高尔基-考克斯染色的鼠脑,(b)单个像素大小为3.25 μm的成像探测器扫描的高尔基-考克斯染色的鼠脑,(c)单个像素大小为0.65 μm的成像探测器扫描的高尔基-考克斯染色海马区组织块Fig.2 Two-dimensional slice of brain slice(a)Mouse brain without Golgi-Cox staining scanned by an imaging detector with a single pixel size of 3.25 μm,(b)Mouse brain with Golgi-Cox staining scanned by an imaging detector with a single pixel size of 3.25 μm,(c)Hippocampal tissue cubes with Golgi-Cox staining scanned by an imaging detector with a single pixel size of 0.65 μm
2.2 神经网络成像
小脑所含神经元丰富,约占整个脑部神经元的50%,小脑中大部分神经元分布于小脑皮层。高尔基-考克斯染色可特异性标记神经元,尤其能对树突棘等精细结构进行染色,结合Amira软件将CT扫描所得鼠脑图像渲染,即可显示小脑神经元网络分布。图3(a)与图3(b)为小脑冠状面不同层面神经网络渲染图,在图像中可区分小脑皮质及髓质区域。皮质区域显示出明显层次,由表及里可分为多个小脑小叶,即构成小脑皮质的叶片板层,其表面小叶多为横向,相互平行。皮质所包含的神经元如星状细胞、篮状细胞、浦肯野细胞、高尔基细胞和颗粒细胞等在渲染图像中均可清晰显示。图3(c)为小脑矢状面3D神经网络渲染图,该断面上神经元的分布、皮质的分层结构及其与髓质的毗邻关系亦可清晰分辨。图3D为小脑水平面3D神经网络渲染图,除显示小脑层次结构外,还捕捉到在皮质神经元分布密集处像亮度更高。这一结果表明,高尔基-考克斯染色结合同步辐射3D成像技术有潜力成为未来探索神经元的区域分布的新手段。小脑内神经元分布众多且连接紧密,选择感兴趣的区域进行追踪神经元的相互联系,可以实现对神经元结构与形态数据的获取,对深入解析小脑结构有重要意义。我们从不同角度及不同层次解析小脑3D神经网络构筑及组织结构关系,为建立小鼠局部功能脑区神经网络的3D数字化解剖图谱提供了新思路,将此方法应用于不同功能脑区神经元的定位追踪并构建全脑神经连接网络,对于了解全脑结构有重要意义。
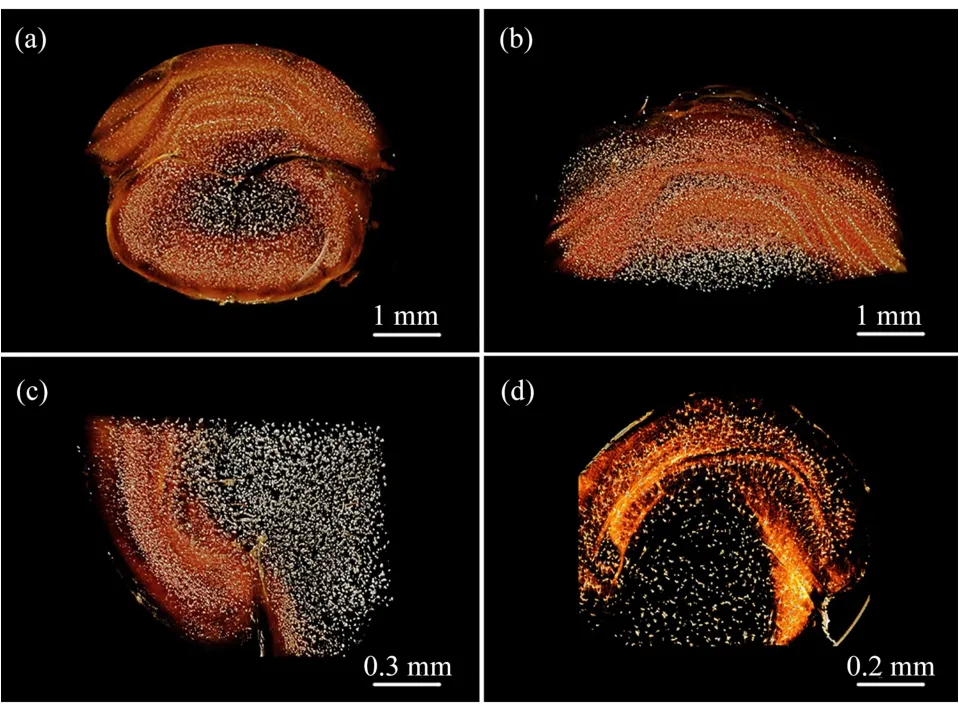
图3 小脑3D神经网络成像(a,b)不同层面冠状位小脑3D神经网络渲染图,(c)矢状位小脑3D神经网络渲染图,(d)水平位小脑3D神经网络渲染图Fig.3 Cerebellar 3D neural network imaging(a,b)3D neural network rendering of coronary cerebellum at different levels,(c)3D neural network rendering of sagittal cerebellum,(d)3D neural network rendering of horizontal cerebellum
2.3 局部神经元连接
使用3D重构软件Amira对获取全脑组织的扫描数据进行成像优化处理,可获得小鼠脑神经网络3D可视化图像。通过手动选择获得多选定的局部单个神经元、多个神经元形态与连接信息(图4),由此可观测单个神经元的结构与形状,同时其与周边神经元的连接方式等信息。对单个神经元进行放大处理可区分胞体连接及轴突连接,为研究神经元之间的相互作用途径、探索神经元通过轴突连接形成的局部神经网络环路提供了可能的途径,有助于深入理解神经元的细胞行为及细胞间通信。此外,重构结果显示出了在单细胞水平上分析细胞间异质性的潜力,对阐明细胞相关功能及生物学机制有关键作用。获得局部神经连接网络的重建图像后,还可以利用伪彩将不同形态、大小的神经元进行标记,获得局部范围的神经元定位与互联信息,如图5所示。选定感兴趣区域即可获得该区域所有神经元信息,为研究重要区域的神经元的结构与功能提供了三维网络数据。

图4 神经元成像 (a)单个,(b)三个,(c)多个Fig.4 Neuron imaging(a)Single neuron,(b)Three neuron,(c)Multiple neuron

图5 神经元多色成像Fig.5 Multicolor imaging of neurons
3 讨论
神经元尺寸微小、形态复杂,普通染色方法难以对其三维结构进行解析,而高分辨率显微扫描仪器的发展使研究中枢神经系统中微神经网络成为可能。同步辐射X射线成像作为一种具有高空间分辨率的先进成像技术,为微神经网络的亚微米级无损成像提供了平台。同步辐射光源具有高光通量、高亮度、高准直性、高相干度和宽光谱等特点,与高分辨率CCD探测器相结合,不仅获得神经元三维形态结构,还可提高检测的有效空间分辨率,满足微神经网络成像研究的要求[7-8]。本研究采用3D神经网络分析法,利用X射线吸收衬度成像技术对小鼠脑神经网络的形态进行3D表征,为深入研究精细神经血管网络构筑、各类病理条件下显微神经血管网络3D重塑及相关干预治疗提供有力评估手段[9]。
人体生理功能的维持依赖于神经网络结构完整,神经元病变可导致人脑功能障碍,因此亟需建立一种可行有效的方法捕捉脑部神经元,为今后研究提供策略[10-14]。本次实验利用同步辐射吸收衬度成像技术,通过对比高尔基-考克斯染色前后的鼠脑图谱,显示出高尔基-考克斯染色结合同步辐射吸收衬度成像技术在实现全脑神经网络三维可视化方面的优越性;通过对比不同直径探测器的优缺点,为选择合适的探测手段提供了依据;通过聚焦于小脑渲染图像,清晰可辨小脑的层次结构显示了本技术的可行性及实用性。应用本实验建立的技术流程,鼠脑样本经进一步处理后可原位显示直径20 μm左右的神经元的立体结构形态,并成功重构神经网络,所得信息用于研究局部神经元网络连接之间的相互作用,为研究神经元之间相互作用提供新的视角。传统的组织学染色方法仅提供标本的二维形态信息,且这类破坏性的样本处理方法会导致血管和轴突再生研究中的数据失真;而同步辐射扫描不仅可以短时间内实现全脑成像,还能同时保证标本的完整性,提高样本的利用率。同时,该技术还可用于研究各类中枢神经系统疾病下(如脑血管病、癫痫、神经退行性疾病等)脑3D神经网络的改变,实现无损、精准地追踪疾病早期的神经血管3D构筑变化,为进一步制定有效的治疗干预手段提供了有力的技术支撑。
4 结语
本研究阐明了利用高尔基-考克斯染色结合同步辐射技术构筑脑神经高分辨3D可视化网络的可行性和有效性,将血管神经网络共成像及对其进行精准的定量分析应用于临床研究,为检测和评估神经血管再生修复策略的效能提供有力的工具。本研究力求以新方法为脑神经网络研究提供丰富的3D影像学信息,为探究脑神经网络结构及其在病理状态下的显微变化提供新思路。
致谢 感谢中国科学院上海应用物理研究所X射线成像及生物医学应用线站(BL13W1)全体科研人员对本项目的支持和帮助。

