金粳818抗咪唑啉酮类除草剂基因的功能标记开发与应用
王广达 高鹏, 杨文艳 崔傲 赵剑华 冯志明, 曹文磊, 陈宗祥, 左示敏, ,*
(1扬州大学 农学院 江苏省作物遗传生理重点实验室/植物功能基因组学教育部重点实验室/江苏省作物基因组学和分子育种重点实验室,江苏 扬州225009;2扬州大学 江苏省粮食作物现代产业技术协同创新中心,江苏 扬州 225009; *通信联系人, E-mail: smzuo@yzu.edu.cn)
随着劳动力成本及土地规模化程度的上升,直播稻在我国水稻生产上呈明显扩大态势。相对于移栽稻,直播稻田更容易滋生杂草和杂草稻。清除杂草有多种方法,施用除草剂无疑是最经济有效的策略,尤其是利用杀草谱广、低毒高效的除草剂。然而,很多广谱性除草剂在消灭杂草的同时也给水稻造成伤害,影响其生长发育和产量。因此,培育抗广谱性除草剂的水稻显得尤为重要。
乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂是现在被广泛应用的一类除草剂,其除草谱广、低毒高效、选择性强、对人和动物十分安全[1],具体包括咪唑啉酮类(imidazolinones,IMs)、磺酸脲类(sulfonylureas,SUs)、三唑并嘧啶类(triazolopyrimidines,TPs)、嘧啶硫代苯甲酸酯类(pyrimidinyhhiobenzoate,PTBs)和磺酰胺羰基三唑啉酮类(sulfonylaminocarbonyltriazolinone,SCTs)等多种类型[2]。该类除草剂被根系等器官吸收后,通过植物体内的维管系统传导到植物全株,在分生组织中积累,抑制植物中的ALS活性,破坏植物体内缬氨酸、亮氨酸和异亮氨酸的合成,最终导致植物死亡[3]。通过大规模诱变筛选,国外学者率先获得了抗ALS抑制剂水稻创新种质,并培育推广了相应的抗除草剂水稻品种[4]。然而,随着同类型除草剂大量地施用,不少种植田块均发现了抗性杂草[5-6]。研究显示,对ALS抑制剂的抗性可分为靶标抗性和非靶标抗性;靶标抗性主要为ALS蛋白的氨基酸突变造成,非靶标抗性则与ALS抑制剂敏感性减弱有关,但其具体分子机制还很不清楚[7-9]。通过对抗性杂草中的靶标ALS基因序列分析,研究人员先后发现至少有 20个氨基酸位点的突变可导致植物对 ALS抑制剂类除草剂产生抗性[10-14]。
近年来,我国学者也先后通过诱变筛选策略,获得了 ALS抑制剂类除草剂抗性水稻种质(品种)[15]。为了加速这些种质在抗ALS抑制剂类除草剂水稻新品种选育中的应用,先后有学者开发了针对这些ALS突变型的功能标记。陈涛等[16]基于四引物扩增受阻突变体系PCR原理,开发了黄华占M-1背景下的ALS突变型基因(第548位氨基酸突变)的功能标记。王芳权等[17]采用等位基因特异 PCR原理开发了金粳818背景中的ALS突变型基因的功能标记 AS-ALS,该标记中的抗、感等位基因的特异引物间只在末端一个碱基上存在差异,因此,在实际操作中容易产生假阳性结果,而且对杂合基因型的鉴定需要扩增两次方可获悉。针对单碱基变异,目前有多种基于PCR的分子标记检测方法,其中在分子标记辅助育种中应用最普遍的是CAPS(cleaved amplified polymorphic sequences)标记[18]。该标记的主要原理是利用单碱基引起某个限制性内切酶识别基序的变化,PCR对产物进行酶切以区分不同等位变异[18]。然而,有些单碱基变异所在区域并不是某个限制性内切酶的识别位点,无法直接开发CAPS标记。但是,在这些单碱基变异中,有些可以通过额外突变1~2个碱基并使其与该单碱基变异位点中的一种等位变异间组成某个限制性内切酶的识别基序,而与另一种等位变异间不能组成相应的酶切基序。利用该原理,我们可以在PCR引物设计过程中引入个别碱基突变,实现特异单碱基变异的区分,即dCAPS(derived CAPS)标记[18]。近年来,由英国 LGC公司研发的竞争性等位基因特异性 PCR(kompetitive allele specific PCR,KASP)标记正在被遗传育种学者所认可[19],该标记可广泛用于各种单碱基变异的特异性鉴别。其具体设计原理是利用等位基因间的单碱基变异,分别设计出针对不同等位基因特异扩增的PCR引物,实现相应等位基因的特异扩增。以上两种标记均为共显性标记,可同时区分特定位点上的三种基因型,且检测精准性高,因而更具育种应用价值。
为了进一步丰富金粳818中ALS突变型基因的功能标记类型,本研究分别采用 dCAPS和 KASP标记原理开发了两种新的功能标记dC-ALS-627和K-ALS-627,并发现其在抗除草剂水稻新品种选育中具有广泛的应用前景。
1 材料与方法
1.1 试验材料
1)金粳818是由津稻9618和津稻1007杂交育成的粳型常规水稻品种(天津市水稻研究所),前人研究显示其对 ALS抑制剂类除草剂咪草烟具有较强的抗性[20]。
2)禾粳 1819、沭粳 1901、华粳 1803、南粳46、南粳52、武运粳23、镇稻11、镇稻14、镇稻18、淮稻5号、扬粳103、扬育粳2号、扬育粳3号、华粳8号、淮119、武运粳27、武运粳32、武运粳80、扬农稻1号、盐粳11、盐粳13、盐粳15、盐粳16、盐粳6号、镇稻99、大粮202、泗稻12、泗稻15、新科稻21、徐稻5号、原旱稻3号、金粳18、金粳787、连粳10、连粳4号、苏垦118、苏秀867、扬粳818、武粳66、宁5718共40份水稻品种(系)用于验证本研究开发的功能标记在水稻育种中的应用潜力。
3)以金粳818为父本,常规粳稻品种南粳505为母本配置的杂交种及其衍生的BC2F2群体,以及以金粳818和华粳0029为亲本配置的杂交种,主要用于研究标记检测的效果及目标抗性基因的显隐性特性。
1.2 试验方法
1.2.1 DNA提取与ALS基因克隆
用CTAB法提取待测水稻叶片的基因组DNA。根据 NCBI数据库注册的日本晴 ALS基因(LOC4329450)编码区序列设计一对引物ALS-F和ALS-R(表1),引物设计采用Primer Premier 5.0软件进行。用KOD FX(TOYOBO)高保真酶对金粳818基因组DNA进行扩增,参照天根生化科技(北京)有限公司普通琼脂糖凝胶DNA回收试剂盒的使用方法对目的DNA片段进行回收,胶回收产物连入pEASY-Blunt克隆载体中,采用大肠杆菌转化法进行转化,然后挑取单克隆菌落扩大培养,取20 μL菌液送尚亚生物公司测序。
1.2.2 序列比对与标记开发
分别从NCBI和Gramene网站的GeneBank中下载粳稻品种日本晴和籼稻品种9311的ALS基因编码区序列(CDS),用BioEdit软件对测序获得的金粳818ALS基因编码区序列进行比对分析。
在此,我们采用衍生酶切扩增多态性序列(derived cleaved amplified polymorphic sequences,dCAPS)分析技术开发dCAPS标记,利用dCAPS Finder 2.0网站,对野生型和突变体基因突变区段进行序列分析,结合Primer Premier 5.0软件,在碱基变异处双侧设计相应的引物(表 1)。另外,基于KASP原理设计两条 3'末端不同的正向引物K-ALS627N-HEX和K-ALS627S-FAM,以及一条反向通用引物K-ALS627S-N(表1)。
1.2.3 dCAPS标记的PCR扩增、酶切和电泳检测
以提取的基因组DNA为模板,进行PCR扩增。PCR体系为DNA模板1 μL,10×PCR缓冲液(含MgCl2)2 μL,dNTP(2.5 mmol/L)0.4 μL,上游引物 dC-ALS-627-F(0.5 μmol/L)0.4 μL,下游引物dC-ALS-627-R(0.5 μmol/L)0.4 μL,TaqDNA 聚合酶(5 U/μL)0.4 μL,ddH2O 15.4 μL。反应总体积20 μL。扩增条件为 95℃下 5 min;95℃下 30 s,58℃下 30 s,72℃下 30 s,32 个循环;72℃下延伸 10 min,结束反应。扩增产物采用 NEB生物技术有限公司的DdeⅠ限制性核酸内切酶进行酶切,酶切体系包括PCR 产物 8.8 μL,CutSmart缓冲液 1 μL,DdeⅠ酶(1 U/μL)0.2 μL,37℃下水浴 2 h。酶切产物经 4%琼脂糖凝胶电泳分离,用凝胶成像仪拍照并记录结果。
1.2.4 KASP标记PCR检测方法
反应体系包括 DNA(10~20 ng/μL)5.0 μL,荧光引物混合液(8 μmol/L)0.14 μL,2×KASP 预混液5.0 μL(1×)。反应条件:94℃下激活15 min;94℃下变性20 s,61℃~55℃下退火60 s(每一个循环降低0.6℃),10个循环;94℃下变性20 s,55℃下退火60 s,26个循环;30℃下延伸1 min;用ddH2O设置 3个空白对照。利用Bio-Rad CFX荧光定量PCR 仪(CFX Connect)和 Bio-Rad CFX Manager 3.1软件对KASP基因进行分型扩增和结果分析。
1.2.5 抗性鉴定
抗性鉴定所用除草剂咪唑乙烟酸,为咪唑啉酮类除草剂(山东先达农化股份有限公司,有效成分含量5%)。在长方体塑料盆(长59 cm、宽18 cm、高14 cm,土壤厚度12 cm)中点播金粳818、常规粳稻南粳505,以及南粳505/金粳818回交的BC2F2种子,其中金粳818和南粳505各播12粒,回交种播40粒。3叶1心时,将咪唑乙烟酸(水剂)溶液稀释1000倍按300 L/hm²喷雾,30 d后调查抗性,叶片全部枯萎或死亡为感,植株存活为抗。于喷施药剂前一天取样(叶尖2~3 cm)用于基因型检测。
2 结果与分析
2.1 金粳818中抗除草剂基因ALS的序列分析
前人研究显示[20],ALS基因的突变是导致金粳818对咪唑啉酮类除草剂产生抗性的原因。为了开发功能位点特异的分子标记,本研究再次对金粳818的ALS基因进行了测序。通过序列比对,我们发现金粳818与感除草剂品种日本晴、9311之间分别存在32和9个碱基变异(图1)。其中在第1880 bp和1927 bp处日本晴和9311的碱基相同,且均与金粳818不同。这两个变异分别引起金粳818中的ALS基因第627位和第643位氨基酸发生改变。结合前人在红米稻抗除草剂上的研究结果[21],可认为627位氨基酸改变是导致金粳818对咪唑啉酮类除草剂产生抗性的原因,这与费云燕等[20]的结果一致。本研究将金粳 818中的 ALS基因命名为ALS627N,野生型的ALS基因命名为ALS627S。
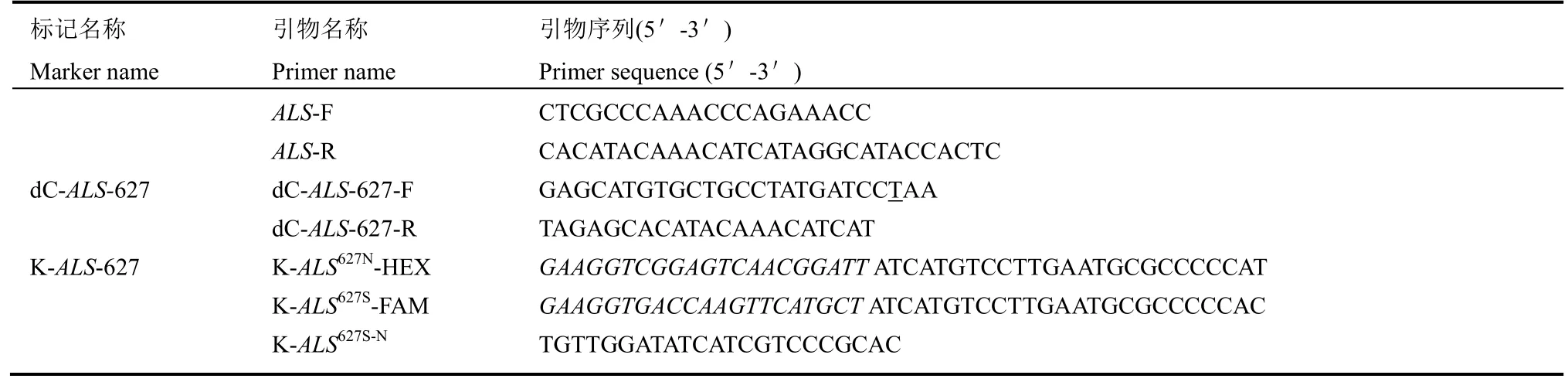
表1 本研究涉及的引物序列Table 1. Primer sequences involved in this study.

图1 ALS基因序列比对结果Fig. 1. ALS gene sequence alignment results.
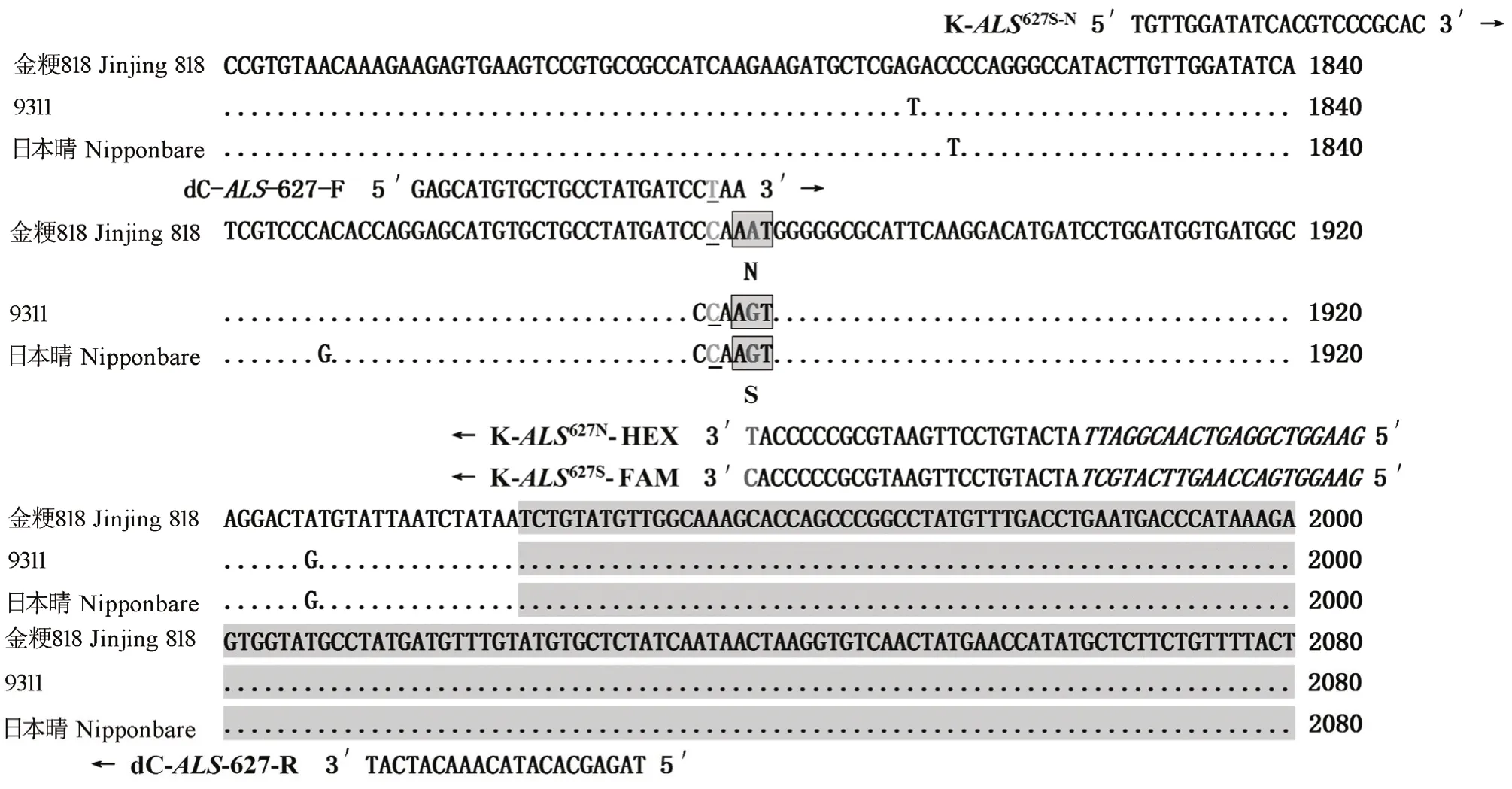
图2 两种标记的相关信息Fig. 2. Information of the two molecular markers.
2.2 金粳818中抗除草剂基因ALS627N的功能标记开发
针对ALS627N基因中的第1880处的单碱基变异,首先开发了dCAPS标记dC-ALS-627(图2)。当目标碱基位点为A的时候,该标记的扩增不能被DdeⅠ酶进行切割,扩增产物为178 bp;相反,如果是碱基G,那么其PCR扩增产物可以被DdeⅠ酶切割为156 bp和25 bp。用引物dC-ALS-627对3份亲本材料金粳818、南粳505、华粳0029以及两份杂交种南粳 505/金粳 818、华粳 0029/金粳 818的基因组DNA进行扩增,并采用限制性核酸内切酶DdeⅠ做酶切。结果显示(图 3-A),金粳 818的扩增产物经酶切后的电泳条带为 178 bp,而南粳 505和华粳0029的扩增产物经酶切后片段大小均为156 bp,说明金粳818中的ALS627N基因在1880位点携带的是A碱基,而另两个品种携带的均不是该碱基;两个杂交 F1材料的扩增产物经酶切后均产生了这两种条带,分别代表两个亲本,证明该标记可以区分杂合基因型。
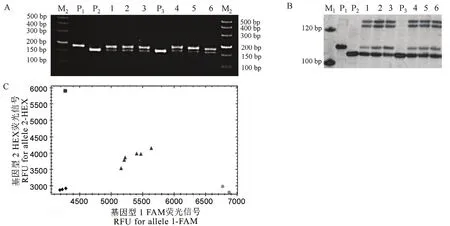
图3 三种分子标记检测结果Fig. 3. Detection results of three molecular markers.
我们同时基于该功能性单碱基变异开发了KASP标记K-ALS-627(图2),在金粳818等位基因ALS627N的特异引物前加上5-六氯荧光素氨基磷酸酯(HEX)的荧光信号标签,在野生型等位基因ALS627S特异引物前加上羧基荧光素(FAM)的荧光信号标签。通过荧光PCR扩增,结果显示金粳818和两份野生型材料分别呈现出蓝光和黄光,而杂种F1则呈现出绿光,表明K-ALS-627标记同时可以区分ALS位点上的3种基因型(图3-B)。
费云燕等[18]的研究显示,SSR分子标记RM7413与金粳818中的抗除草剂基因ALS627N紧密连锁。我们进一步用RM7413对相关样品进行检测(图3-C),结果与用dC-ALS-627和K-ALS-627检测的一致。
2.3 BC2F2代水稻植株的标记检测及表型分析
我们构建了南粳505与金粳818间的BC2F2代回交群体,分别利用标记dC-ALS-627和K-ALS-627检测群体中的部分个体基因型,发现两种标记均可有效区分ALS位点中的3种基因型(图4)。我们进一步采用咪唑乙烟酸对群体中的各个体进行喷施处理,发现 ALS627N基因型和杂合基因型的所有植株(37株)均能正常生长,而基因型为ALS627S的野生型植株(11株)在处理后均表现生长受限,绝大多数在30 d后枯萎或死亡,图5为部分单株的表型。结果进一步证实,ALS627N是抗咪唑啉酮类除草剂显性基因,采用本研究开发的两种功能标记均可在杂交早期世代筛选到纯合基因型抗除草剂个体。
2.4 两种功能标记在水稻新品种选育中的应用
为进一步验证两种标记在水稻抗咪唑啉酮类除草剂新品种育种中的应用价值,我们分别利用各标记分析了 40份不抗该除草剂的水稻品种在 ALS位点上的基因型。经dCAPS标记dC-ALS-627分析后,能清楚地发现金粳818与其他40份材料的基因型带型存在明显差异(图6-A);同样,K-ALS-627标记也可以明显区分40份水稻品种与金粳818(图6-B)。结果表明,本研究开发的两种标记均可有效区分金粳818中的ALS627N基因与其他不同来源的水稻种质中的ALS基因,表明其可广泛用于现有水稻品种抗咪唑啉酮类除草剂改良或新品种选育。
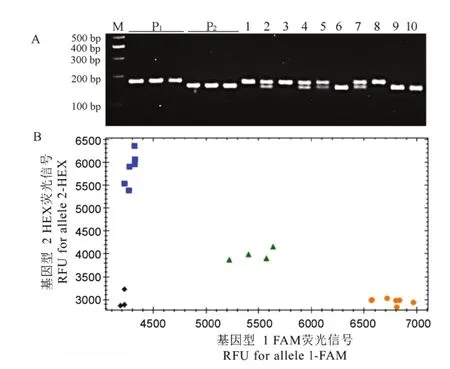
the heterozygouus type of ALS genne (with a G/A mmutation site base)).图4 dC-ALSS-627和K-ALLS-627标记对BC2F2水稻植株株的基因型检检测结果Fig. 4. Genottyping of BC22F2 generationn rice plants uusing dC-ALS--627 and K-ALLS-627 markerrs.

图5 咪唑乙乙烟酸处理后的的BC2F2水稻植植株表型Fig. 5. Phenottypes of BC2F22 populations aafter treatmentt with imazethaapyr.
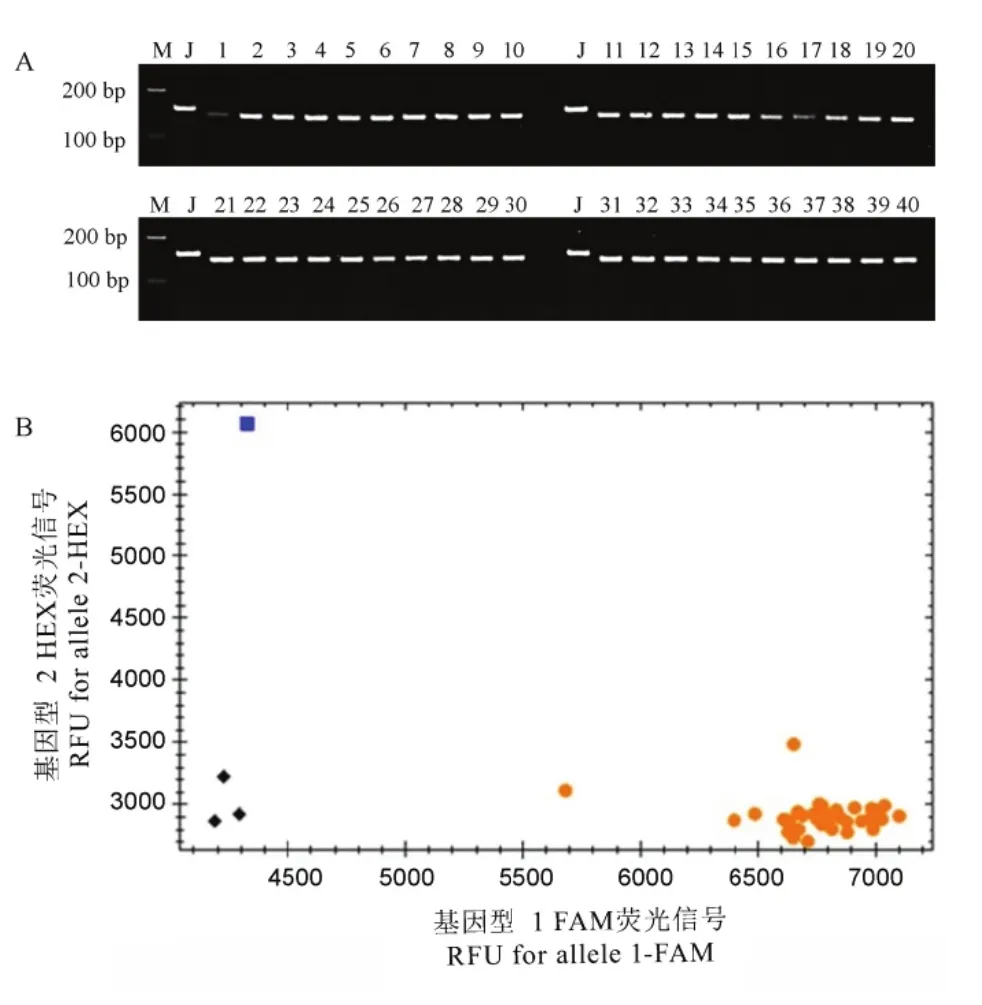
图6 利用dC-AALS-627和K--ALS-627标记记筛选抗除草剂剂水稻资源Figg. 6. Screeningg herbicide reesistant rice reesources usingg dC-ALS-6277 and K-ALS-6627 markers.
3 讨论
从 20世纪纪 80年代开开始,科学家家们就已经致致力于抗除草剂剂作物的研研究,以抗磺磺酰脲类和咪唑啉酮类除草剂为主,经过多年的研究,成功培育出许多抗性作物[22,23]。天津农业科学院选育的粳稻品种金粳 818,因为其对咪唑啉酮类除草剂具有较强抗性,近年在生产上颇受老百姓喜爱。前人研究显示[20],金粳818中的除草剂抗性与其ALS基因发生突变有关。本研究对金粳818中的ALS基因进行了测序比较,进一步证实金粳818的除草剂抗性与其ALS基因第1880处的单碱基变异有关,这与之前的研究报道一致[20]。对金粳818与南粳505的回交群体中的杂合基因型个体进行除草剂处理,证实金粳818中ALS627N为显性抗除草剂基因,这为通过除草剂处理筛选出携带 ALS627N基因型个体提供了依据。然而,相比于标记辅助选择,表型筛选还是易受外界因素干扰,也不能区分杂合基因型与纯合基因型。王芳权等[17]率先开发了金粳818背景中的ALS等位基因特异PCR标记AS-ALS,包括两个引物组合F1N和F1M,其中感除草剂等位基因只能被F1N引物组合扩增,抗除草剂等位基因型只能被F1M引物组合扩增,而杂合基因型能同时被两对引物F1N和F1M扩增,因此,可以通过两轮PCR有效区分ALS位点的3种基因型。然而,由于扩增抗、感等位基因的特异引物间只在末端1个碱基上存在差异,因此,在实际操作中容易产生假阳性结果,而且不能对杂合基因型进行一次性检测。
为了开发特异性和准确性更高的功能标记,我们采用dCAPS标记设计原理,在金粳818的功能变异位点处开发了一个dCAPS标记dC-ALS-627,尽管在检测过程中需要增加一步酶切消化环节,但耗时并不长(1~2 h),结果却十分准确,基本不存在假阳性,且可一次性区分杂合基因型与纯合基因型,因此,dC-ALS-627具有较好的实际应用价值。当然,在检测过程中,有时会出现酶切不彻底的情况,此时,携带感除草剂的野生型位点会呈现出类似杂合基因型的带型,即出现双带;但是对于筛选抗性纯合型(ALS627N)个体而言,结果则不受影响。另外,由 LGC公司研发的竞争性等位基因特异性PCR方法(Kompetitive Allele Specific PCR,KASP)是检测单碱基变异的一个非常有效的标记方法。近年来,由于这一标记方法的检测成本下降,尤其是可以通过普通荧光PCR仪进行检测分型,不需要添置 LGC公司研制的高通量仪器设备,使得这一标记技术正在被很多中小型研究室广泛接受。本研究针对金粳818的功能变异位点也开发一个KASP标记 K-ALS-627。利用 LGC公司的反应混合液,在Bio-Rad CFX荧光定量PCR仪(如CFX Connect)上扩增,不需要凝胶电泳即可获得抗、感及杂合基因型分型结果,具有效率高且容易实现通量化的优势。采用以上两种功能标记均可有效区分ALS位点中的3种基因型,因此,可在杂交分离的早期世代获得纯合基因型个体,提高选择效率。为了评估两个功能标记在粳稻品种育种中的应用前景,我们分析了 40个随机选自江苏粳稻不同生态区的粳稻品种在相应位点上的基因型,结果显示,这些品种均不带有金粳818中的ALS627N功能变异,结合这些品种在推广过程中未听说有抗咪唑啉酮类除草剂的宣传信息,因而可认为这些品种在ALS位点上均携带有咪唑啉酮类除草剂敏感基因。除了 ALS627N的功能变异外,粳稻上还有研究者创制了ALS基因第 136位氨基酸变异后产生除草剂抗性的 ALS136G功能变异[14],但是目前还未见到该功能变异在推广粳稻品种上的应用报道,可认为本研究开发的两个功能标记在利用金粳818的ALS627N基因培育抗除草剂新品种中具有广泛的应用前景。
编码氨基酸的碱基发生突变是植物对 ALS抑制剂产生靶标抗性的主要原因。据报道,目前在ALS蛋白中至少发现20个对ALS抑制剂产生抗性的氨基酸位点[10-14]。有意思的是,不同位点的氨基酸变异对不同类型的 ALS抑制剂类除草剂会产生差异性的抗药性[24],如第122位的氨基酸突变一般只对咪唑啉酮类产生抗性,对磺酸脲类、三唑并嘧啶类、嘧啶羧酸类除草剂则不太敏感;同样,不同物种间的同一位点突变也会产生差异化的除草剂抗性表现[25-26]。因此,为了避免突变单一位点而导致长期使用同一类除草剂容易产生抗药性的情况,后续有待更全面的了解水稻中的 ALS蛋白不同氨基酸位点的突变对不同 ALS抑制剂类除草剂的抗性效果和抗谱范围。一旦获得可靠的研究数据,即可针对不同突变位点开发 ALS抑制剂类型除草剂不同专化性抗性新品种,实现年度间施用不同类型ALS抑制剂类除草剂,降低抗性杂草的产生。

