水稻黄叶早衰突变体osyes1的生理特性和基因定位
黄福灯 赵超越 吴鑫 贺焕焕 程方民 李春寿 潘刚
(1浙江省农业科学院 作物与核技术利用研究所, 杭州 310021; 2浙江大学 农业与生物技术学院, 杭州 310058; #共同第一作者; *通信联系人, E-mail:lichunshou@126.com)
叶片是水稻最重要的源器官,其功能与衰老对产量与品质具有重要影响[1-2]。研究表明,水稻灌浆后期功能叶每推迟1 d衰老,理论上增产约2%,实际增产约1%,同时还能改善稻米品质[3-4]。水稻叶色变异是一类易于鉴定的突变性状,该性状不仅常作为形态标记应用于水稻分子育种,同时该类突变体也是研究水稻功能基因组,尤其是光系统、叶绿素合成代谢以及叶绿体的遗传分化及发育的重要材料[5-6]。水稻常见的叶色变异主要包括转绿型、条纹、黄化、白化、斑马纹以及黄色斑等 6种类型。关于叶色变异的成因,科研工作者基于各类突变体材料的研究结果,证实其根本原因在于叶绿体合成
与发育的受阻,因此任何涉及叶绿素生物合成代谢、血红素-光敏色素合成代谢、叶绿体发育、光合系统及其他生物合成代谢途径中的关键基因突变均会导致叶色突变[7]。基于正向或反向遗传学手段,国内外对水稻黄叶突变进行了大量研究并克隆了YE1[8]、IspE[9]、YL-1[10]和 LYL1[11]等黄叶基因。
本课题组前期利用60Co辐射诱变中籼恢复系自选 1号,从中获得黄叶早衰突变体,暂命名为osyes1(Oryza sativa yellow-leaf and early senescence 1)。该突变体黄叶表型始于水稻幼苗期(约3~4片叶龄时),之后随着叶龄的增加,除植株最上面一片完整展开叶外,其他叶片均不同程度黄化早衰,至抽穗后所有叶片均黄化早衰。我们对突变体osyes1的基本表型、生理特性进行分析,并对相应基因进行定位,为进一步克隆该基因并揭示其黄叶早衰分子生理机理奠定基础。
1 材料与方法
1.1 试验材料
黄叶早衰突变体osyes1来源于持久高抗稻瘟病中籼恢复系自选 1号(来源于恩施农业科学院水稻研究所)的60Co辐射诱变后代,经杭州和海南连续多代回交和自交,突变性状已稳定遗传。之后配制osyes1/自选 1号、osyes1/浙恢 7954和 osyes1/常规粳稻02428等3个杂交组合,利用F1及其自交F2群体进行遗传分析和基因定位。所有材料均种植于浙江省农业科学院杨渡科研创新基地,常规肥水管理。水稻成熟后,分别取osyes1及自选1号各20株,对其株高、穗长、有效穗数、每穗粒数、结实率和千粒重等主要农艺性状进行考种分析。
1.2 幼苗外源H2O2处理
选取突变体osyes1及自选1号的成熟种子并脱壳,经70%酒精消毒1 min后,再用10%次氯酸钠消毒15 min,之后无菌水充分洗涤5次。将消毒好的糙米接种在含 0、40和 60 mmol/L H2O2的 1/2 MS[12]固体培养基上,置于光强控制在 7000 Lx、光周期为16 h光照/8 h黑暗、28℃的培养室内培养,7 d后统计根长及株高。
1.3 透射电镜分析
选取抽穗当天突变体osyes1及自选1号的剑叶中部边缘叶片,剪成1 mm×2 mm样本,迅速放入用0.1 mmol/L (pH 7.2)的磷酸缓冲液配制的2.5%戊二醛溶液中,抽真空至样品完全浸没,4℃下固定24 h。依据Yang等[13]方法制备样品并于JEM-1230透射电镜下观察并拍照。
1.4 生理指标测定
选取突变体osyes1及自选1号处于孕穗期(剑叶叶枕与倒2叶叶枕重合的分蘖)的剑叶、倒2叶和倒 3叶的中部叶片,根据龚盼等[14]和 Gong等[15]的方法分别测定叶绿素含量、过氧化氢(H2O2)、超氧阴离子(O2-)、丙二醛(MDA)和可溶性蛋白含量、以及过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性。同时,根据Pan等[16]的方法,用Li-6400XT光合仪测定剑叶、倒2叶和倒3叶的光合速率。每个生理指标5个重复。
1.5 遗传分析与基因定位
大田栽培条件下,考查osyes1/自选1号、osyes1/浙恢7954和osyes1/常规粳稻02428的F1杂种叶色,确定控制突变体黄叶早衰症状的显隐性;同时,根据osyes1/自选1号及osyes1/浙恢7954的F2群体中具有正常叶色的水稻单株数与具有突变体性状的单株数的比例,确定控制黄叶早衰性状的基因数量。而后,分单株剪取osyes1/02428的F2群体中具有突变体性状的单株、osyes1、02428以及F2群体中10株具有野生型表型的植株叶片,采用CTAB法提取基因组总DNA。选取SSR(http: //www.gramene.org/)及InDel[17]分子标记,利用BSA法进行基因连锁分析及基因定位。

图1 突变体osyes1及其野生型的表型Fig. 1. Phenotype of osyes1 and its WT plants at different growth stages.
2 结果与分析
2.1 突变体osyes1的表型及主要农艺性状
突变体 osyes1的叶片在苗期(3~4叶期)就表现为黄叶早衰症状(图 1-A),且除上部一片完整展开叶外,其他叶片在完整展开5~7 d后,叶尖开始变黄并逐步扩展至叶中部,甚至整个叶片。之后随着叶龄增长,至抽穗开花早期(图1-B),突变体仅有剑叶维持正常绿色(图1-C),而后,包括剑叶在内,所有叶片逐渐黄化衰老,到水稻成熟期,所有叶片全部表现严重黄化衰老症状(图 1-D)。抽穗当天突变体叶片的部分叶绿体的类囊体已开始降解(图1-H),而且其叶绿体中的淀粉颗粒(图 1-G)明显少于对照(图 1-E)。由于叶片黄化早衰,导致突变体 osyes1的主要农艺性状,如株高、穗长、每穗粒数和结实率极显著低于野生型对照,分别下降 11.13%、20.42%、32.18%和41.94%(表1)。
2.2 突变体osyes1对H2O2的响应特性
突变体osyes1及自选1号在不同H2O2浓度(0、40和60 mmol/L)的1/2 MS固体培养基上生长7 d后,测量其株高及根长。结果显示,正常条件下突变体osyes1及自选1号之间的株高和根长均无明显差异;而在 H2O2处理条件下,尽管两者的根长均完全受到抑制,且株高也明显受到抑制,但与野生型相比,osyes1的株高受抑更明显。与对照相比,经40和60 mmol/L H2O2处理后的突变体株高分别降低 25.85%和 27.97%(图 2)。
2.3 突变体osyes1的生理性状
2.3.1 叶绿素含量及其光合效率分析
孕穗期突变体osyes1的剑叶、倒2叶和倒3叶的叶绿素a(图3-A)、叶绿素b(图3-B)、叶绿素总含量(图 3-C)及叶绿素 a/b比值(图 3-D)均极显著低于野生型自选1号。与野生型自选1号相比,突变体osyes1的剑叶、倒2叶和倒3叶的总叶绿素含量分别下降35.66%、55.17%和53.85%(图3-C)。叶片中的光合色素是吸收、传递光能的载体,其含量对光合作用效率具有十分重要的作用[18]。因此,进一步测定突变体osyes1及其野生型的净光合速率。结果显示,突变体剑叶、倒2叶和倒3叶的净光合速率极显著低于野生型对照,分别下降16.24%、35.65%和 43.93%(图 3-E)。

表1 突变体及其野生型的主要农艺性状Table 1. Main agronomic traits of osyes1 and its wild type (WT) plants.
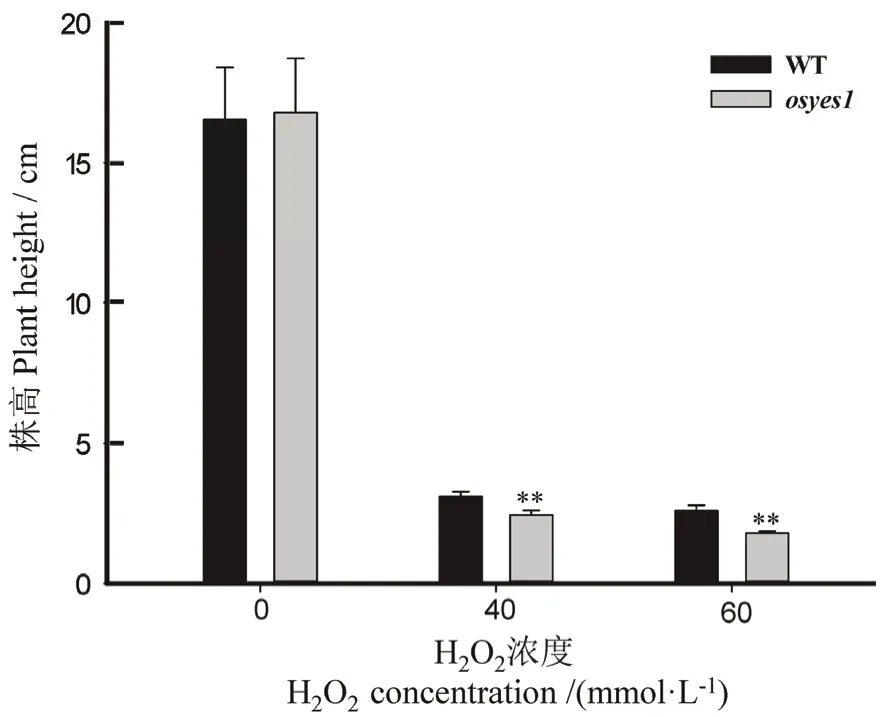
图2 H2O2胁迫下osyes1突变体及其野生型(WT)的表型Fig. 2. Phenotype of osyes1 mutant and its wild type (WT)plants under H2O2 exposure.
2.3.2 活性氧含量及抗氧化酶活性分析
图4-A和B显示,野生型及突变体的剑叶、倒2叶和倒3叶间的H2O2和O2-含量依次增加,且突变体极显著高于野生型。与野生型相比,突变体的剑叶、倒2叶和倒3叶的H2O2分别增加13.52%、12.64%和 69.29%(图 4-A),而其 O2-含量则依次增加 38.24%、311.61%和 80.68%(图 4-B)。为了清除植物体内过多活性氧,如H2O2和O2-,防止其对细胞造成损伤,植物会及时启动多种保护酶系统,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等抗氧化酶[19]。故此,分别测定突变体osyes1及其野生型叶片中的3种酶活。图4-C显示,突变体的 SOD酶活与野生型无显著性差异。而图4-D和图4-E结果显示,突变体和野生型的剑叶、倒2叶与倒3叶的CAT和POD酶活依次下降,但前者低于后者。与野生型相比,除剑叶外,突变体倒2叶与倒3叶的CAT酶活极显著下降,降幅分别为39.79%和44.24%(图4-D)。而突变体剑叶、倒2叶和倒3叶的POD则极显著低于野生型对照,分别减少65.47%、77.55%和55.27%(图4-E)。
2.3.3 丙二醛(MDA)和可溶性蛋白含量
图5-A显示,野生型及突变体osyes1的剑叶、倒2叶和倒3叶间的MDA含量依次极显著增加。与野生型相比,osyes1剑叶、倒 2叶和倒 3叶的MDA含量分别增加30.85%、549.00%和562.66%。图5-B显示,野生型剑叶、倒2叶和倒3叶间的可溶性蛋白含量无显著性差异,但突变体osyes1则极显著低于野生型且依次极显著降低。与野生型相比,突变体osyes1剑叶、倒2叶和倒3叶的可溶性蛋白含量分别下降11.15%、29.78%和42.35%。
2.4 遗传分析及基因定位
osyes1/自选1号和osyes1/浙恢7954的F1单株表现为正常叶色,说明osyes1的黄叶早衰症状是隐性性状。进一步统计F2群体所有单株的田间叶色结果表明,具野生型叶色的单株与具突变体性状的单株之比均符合3∶1的分离比(表2),从而证实osyes1的黄叶早衰性状受单位点隐性核基因控制。
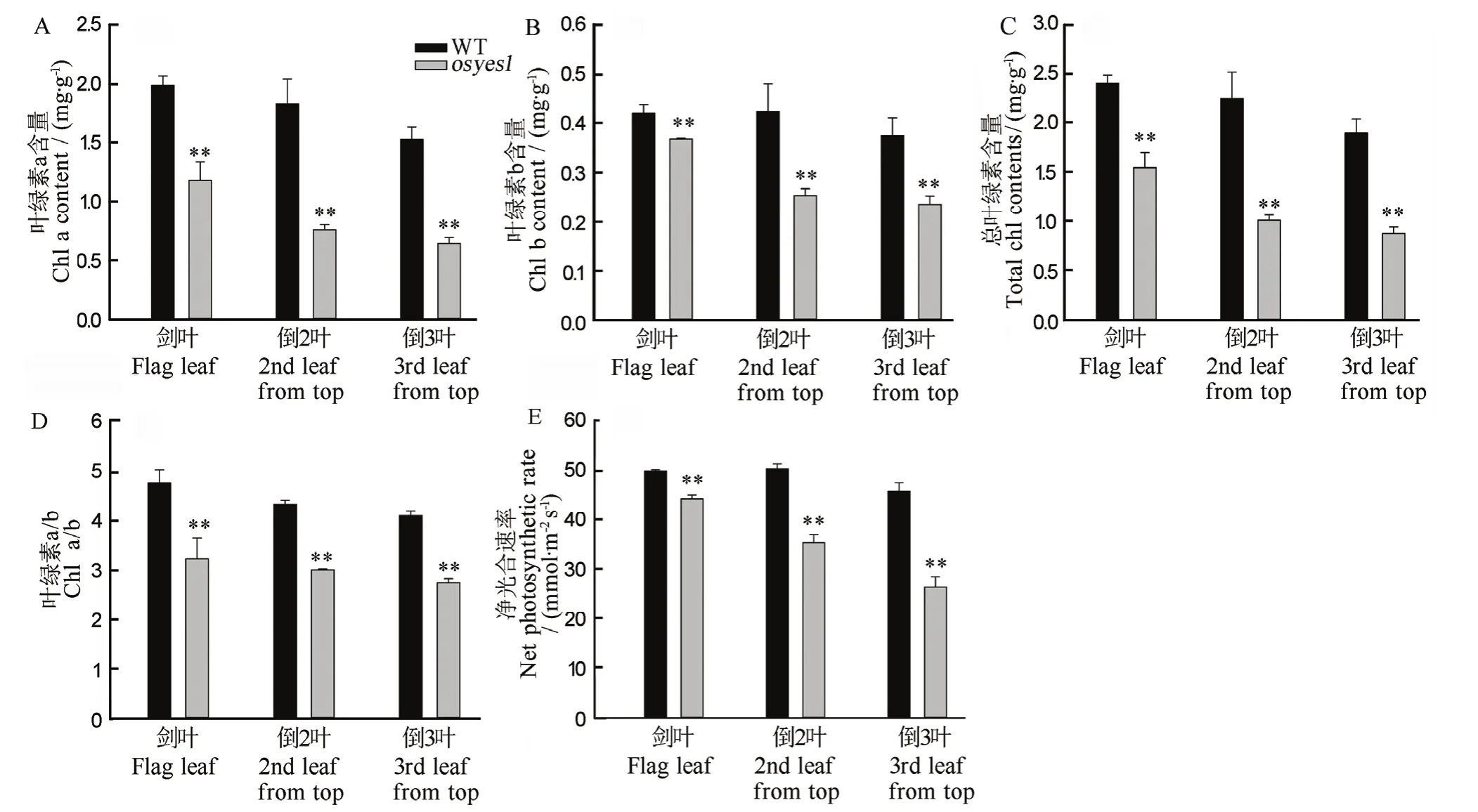
图3 孕穗期突变体osyes1及其野生型叶片的叶绿素含量及其净光合速率Fig. 3. Chlorophyll (chl) levels and net photosynthetic rate of leaves in osyes1 and its WT plants at the booting stage.
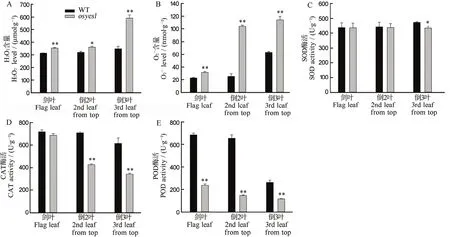
图4 孕穗期突变体osyes1及其野生型叶片中的H2O2和O2-含量及抗氧化酶活性Fig. 4. H2O2 and O2- levels, and the activities of antioxidases in osyes1 and its WT plants at booting stage.
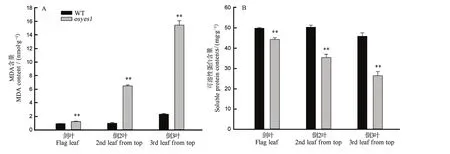
图5 孕穗期突变体osyes1及其野生型叶片的MDA和可溶性蛋白含量Fig. 5. MDA and soluble protein contents of leaves in osyes1 and its WT plants at booting stage.

表2 突变体osyes1的遗传分析Table 2. Genetic analysis of the mutant osyes1.

图6 水稻黄叶早衰基因OsYES1在第7染色体上的分子定位Fig. 6. Molecular mapping of OsYES1 gene on the short arm of chromosome 7.
利用osyes1/02428的F2群体中具有突变体性状的414个单株作为基因定位群体。合成分布于水稻12条染色体上的600对SSR标记及50对InDel标记,逐条分析其在02428和突变体osyes1间的多态性。选用亲本间具有多态性且均匀分布在 12条染色体上的分子标记,利用 BSA法分析分子标记与突变性状间的连锁关系。结果发现水稻第7染色体上的SSR标记RM1186、RM21339、RM7338以及InDel标记R7M20在突变体基因池和正常基因池之间存在明显偏分离,说明OsYES1位于第7染色体。进一步利用414个突变体单株验证以上标记,初步把OsYES1定位在RM21339和R7M20之间(图6)。为进一步精细定位OsYES1,利用 RM21339和R7M20之间的2对多态性SSR标记(RM21353和RM21384),将OsYES1定位在RM21353与RM21384之间,物理距离约为708 kb,区间横跨AP005172、AP005880、AP005673、AP005475、AP005104、AP005189和AP005260等7个BAC(图6),其间有表达序列标签支持且在叶中表达的开放阅读框为15 个(表 3)。

表3 定位区间内在叶中表达的基因功能注释Table 3. Functional annotations of genes expressed in leaves within the target interval.
3 讨论
叶片是水稻进行光合作用的最重要场所,叶色变异将导致其光合作用受阻,进而影响有机物如淀粉的累积,最终影响产量与品质。因此,叶绿素含量、叶绿素a/b以及叶片净光合速率是衡量叶色突变的重要生理指标[18]。本研究所用黄叶早衰突变体osyes1,其黄叶早衰症状始于幼苗期(图1-A),抽穗早期除剑叶外所有叶片均不同程度黄化(图1-B、C),而且此时期的突变体剑叶的部分叶绿体的类囊体已开始降解(图1-H),进而导致其光合速率下降(图3-E)并减少淀粉粒在突变体叶绿体中的累积。同时,叶绿素含量及其a/b结果表明,突变体osyes1剑叶、倒2叶和倒3叶的总叶绿素含量极显著低于其野生型自选1号(图3-C、D)。
伴随叶片黄化早衰,叶绿体中的电子传递链将受到抑制,致使活性氧簇大量产生并成为植物细胞响应非生物胁迫以及衰老的最早反应之一[19-21]。同时,过量 ROS将作用于细胞膜脂质,使其过氧化而产生大量MDA,所以MDA也是衡量细胞死亡、叶片衰老的重要生理指标[22]。本研究中野生型对照自选1号的剑叶、倒2叶和倒3叶间的H2O2含量无显著性差异,而突变体osyes1的含量则依次增加且极显著高于野生型自选1号(图 4-A),而且与野生型相比,突变体对H2O2更敏感(图2)。野生型倒3叶的MDA和O2-含量极显著高于剑叶和倒2叶,而突变体osyes1的剑叶、倒2叶和倒3叶间的含量均依次极显著增加(图4-B)。此外,蛋白质含量特别是可溶性蛋白质含量的下降也是衡量叶片衰老的重要指标之一[18]。本研究中野生型的剑叶、倒2叶和倒3叶之间的可溶性蛋白含量无显著性差异,而突变体osyes1的含量依次极显著降低(图 5-B)。为了清除细胞内的过多 ROS并保护细胞膜系统,正常植物细胞会及时启动属于可溶性蛋白的抗氧化系统,如SOD、POD和CAT的表达[19]。其中,POD和 SOD是作用于 O2-的抗氧化酶系统,突变体osyes1的剑叶、倒2叶和倒3叶的POD酶活极显著低于野生型自选1号(图4-E),从而导致突变体叶片中的O2-含量极显著增加(图4-B)。而CAT是作用于H2O2的保护酶,野生型自选1号和突变体osyes1的剑叶、倒2叶和倒3叶之间的CAT酶活(图4-D)均依次降低,但野生型仅倒3叶极显著低于剑叶和倒2叶,造成野生型剑叶中的H2O2含量显著增加(图4-A);而突变体所有叶片的CAT酶活(图4-D)均极显著低于野生型且依次极显著降低,最终造成上 3叶中的H2O2极显著增加。
叶片衰老既受环境以及病原微生物等外因的影响,也受植物内源激素、ROS以及基因网络的精细调控[18,23-25]。大量研究证实,WRKY和锌脂蛋白转录因子是植物体内重要的转录因子,在叶片衰老中起重要作用[26]。研究表明,抑制水稻锌指蛋白基因OsDOS[27]或OsTZF1[28]的表达会引起水稻叶片早衰,而OsDOF24的功能获得型突变体osdof24-D则表现为延缓衰老[29]。水稻 WRKY转录因子OsWRKY42[30]则可以与 OsMT1d的启动子区域结合,进而抑制其表达并诱导 ROS反应,促进叶片衰老。此外,在拟南芥中过量表达RNA结合蛋白,如 StUBA2a/b、StUBA2c[31]以及 LARP1c[32]均导致转基因后代叶片衰老。在本研究的OsYES1基因的定位区间内,尚没有衰老相关的基因被定位或克隆,而与报道相关的导致水稻叶片衰老的基因分别为锌指蛋白基因(LOC_Os07g17130和LOC_Os07g17400)和 RNA 结合蛋白基因(LOC_Os07g18050)。当然,候选基因的最终确定要依赖于这些基因的测序分析及遗传互补验证。
谢辞:感谢浙江大学农业试验站提供的部分试验场所。
——早衰

