pH示差法测定红花羊蹄甲花瓣花色苷的含量
张鹏 ,骆琴,唐森 ,谢济运 *
1. 广西科技师范学院食品与生化工程学院(来宾 546119);
2. 广西科技师范学院特色瑶药资源研究与开发重点实验室(来宾 546119)
花色苷(Anthocyanin)是具有2-苯基苯并吡喃阳离子基本母核结构的一系列衍生物的总称,其作为存在植物体细胞液泡中的次生代谢产物,是花朵和果实的呈色物质[1]。花色苷是水溶性色素,具有广泛的生物活性,其清除自由基能力显著,具有较强的抗氧化性,可用于食品、药品、保健品、化妆品等领域[2]。
红花羊蹄甲(Bauhinia blakeana Dunn)是广泛种植于我国华南地区的园林绿化观赏植物,花期全年,花量茂盛,花瓣红色或红紫色,花色苷含量较高,具有较大的研究和开发价值[3-4]。
目前已有文献报道红花羊蹄甲花瓣花色苷的提取方法[5-7]、成分鉴定和抗氧化活性[8],花瓣乙醇提取物抑菌活性[9]、水提取物毒理学研究[10],但鲜见有采用pH示差法对红花羊蹄甲花瓣中花色苷含量进行测定的相关研究报道。
pH示差法被广泛应用于测定植物中花色苷的含量,其原理为花色苷的结构转换成pH的函数,而干扰
物质的特征吸收光谱不受pH的影响,该方法具有准确度较高、重现性好、操作方法简便、对仪器设备要求低、便于推广等优点[11]。因为不同植物材料来源花色苷的组成不同,所以需要建立适合于测定红花羊蹄甲花瓣中花色苷含量的pH示差法,对测定过程中反应平衡条件进行优化[12-15]。研究拟进行pH示差法测定红花羊蹄甲花瓣中花色苷含量的方法学研究,以期为红花羊蹄甲花瓣乃至其它植物中花色苷的定量分析提供技术依据。
1 材料与方法
1.1 材料、仪器与设备
原料:红花羊蹄甲花瓣采自广西壮族自治区来宾市广西科技师范学院校园内道路两旁,将花瓣阴干,粉碎后过80目筛,存储于干燥避光处,备用。
试剂:柠檬酸、柠檬酸三钠,浓盐酸、氯化钾、冰醋酸、乙酸钠、无水乙醇均为分析纯试剂,北京化工;矢车菊素-3-O-葡萄糖苷标准品(纯度≥98%,批号:yz180516,南京源植生物科技有限公司);试验过程中使用的水均为去离子水。
仪器与主要设备:中草药粉碎机(FW-135,天津市泰斯特仪器有限公司);紫外-可见分光光度计[UV-2600,岛津企业管理(中国)有限公司];电子分析天平(FA-2004B,上海越平科学仪器有限公司);旋转蒸发仪(R-1001VN,郑州长城科工贸有限公司);实验室微波合成仪(XH-MC-1,北京翔鹄科技发展有限公司);循环水式多用真空泵(SHB-IIIG,郑州长城科工贸有限公司);数显恒温水浴锅(HH-S4,金坛市医疗仪器厂)。
1.2 技术路线
准备花瓣材料→花色苷的提取→确定最大吸收波长→确定缓冲液pH→确定反应平衡温度和平衡时间→精密度试验→回收试验
1.3 试验方法
1.3.1 溶液的配制
根据试验条件所需配制不同pH的缓冲液,其中pH为3.0~6.0的柠檬酸-柠檬酸三钠缓冲溶液配制方法见表1。

表1 柠檬酸-柠檬酸三钠缓冲溶液的配制(pH 3.0~6.0)
pH为0.6~2.0的缓冲溶液:向0.1 mol·L-1柠檬酸溶液中逐滴加入盐酸,辅以pH计校正配制。pH为1.0的缓冲溶液:V(0.2 mol·L-1HCl)∶V(0.2 mol·L-1KCl)=25∶67;pH为4.5的缓冲溶液:V(0.2 mol·L-1HAc)∶V(0.2 mol·L-1NaAc·3H2O)=1∶1。酸性乙醇溶液:V(75%乙醇)∶V(1.5 mol·L-1盐酸溶液)=97∶3。
1.3.2 花瓣花色苷的提取
参照文献[4]的方法并稍作改动。准确称取2.0 g花瓣粉末置于250 mL磨口三角烧瓶中。按料液比1∶30(g/mL)加入60 mL酸性乙醇提取液,置于微波合成仪中,连接冷凝管。600 W功率微波下处理90 s,抽滤,减压浓缩至20 mL,用pH为3.0的柠檬酸-柠檬酸三钠缓冲溶液定容至100 mL,即得花瓣花色苷提取液。
1.3.3 花瓣花色苷含量测定
分别准确移取1.0 mL提取液于2支10 mL具塞试管中,分别用pH为1.0、4.5的缓冲溶液定容至10 mL,在40 ℃水浴中反应平衡50 min。以去离子水作为空白对照,用紫外-可见光分光光度计分别测定待测液在535 nm和700 nm处的吸光度,以矢车菊素-3-O-葡萄糖苷计,利用 Fuleki公式(1)和(2)对待测液中花色苷含量进行计算[16]。
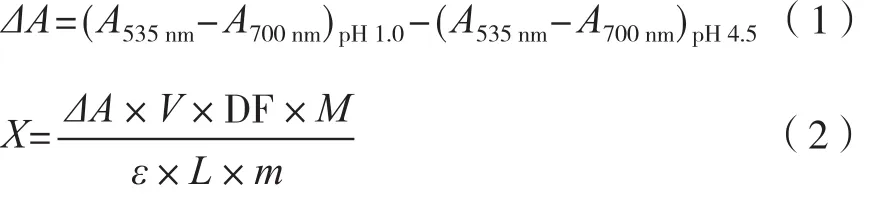
式中:ΔA为花色苷总吸光度;A535nm为花色苷在535 nm处的吸光度;A700nm为花色苷在700 nm处的吸光度;X为花瓣中花色苷的含量,mg·g-1;V为提取液总体积,mL;DF为稀释倍数;M为Cy-3-O-Glu的摩尔质量(449.2 g·mol-1);ε为Cy-3-O-Glu的消光系数(29 600 L·mol-1·cm-1);L为光程,数值1 cm;m为样品质量,g。
1.3.4 确定最大吸收波长
取一定量的花瓣花色苷提取液,用pH为3.0的柠檬酸-柠檬酸三钠缓冲溶液稀释至适当浓度,用紫外-可见分光光度计在可见光波长400~720 nm范围内进行吸收光谱扫描,根据获得的吸收光谱图来确定最大吸收波长。
1.3.5 确定缓冲液pH
准确吸取2.0 mL提取液于11支10 mL具塞试管中(注:提取液加入体积不得超过待测液总体积的20%,否则将超过缓冲液的缓冲范围),依次分别加入pH为0.6,0.7,0.8,0.9,1.0,2.0,3.0,4.0,4.5,5.0和6.0的缓冲液定容至10 mL,以去离子水为空白对照。将待测液在已确定的最大吸收波长处测定吸光度,绘制以pH为横坐标、吸光度为纵坐标的pH-吸光度曲线图,以待测液在2个pH处吸光度的差值最大且在所选定的2个pH附近吸光度变化不大为原则确定缓冲液pH。
1.3.6 确定反应平衡温度和平衡时间
准确吸取8.0 mL提取液于6支50 mL具塞试管中,以3支为一组分别用已选定的2个pH缓冲液定容至50 mL。以2支装有不同pH缓冲液的具塞试管为一组,共分为3组,分别置于20,30和40 ℃水浴中进行反应平衡,每隔10 min在最大吸收波长处测定吸光度,观测溶液吸光度在各反应温度内随反应平衡时间的变化情况,确定反应平衡温度和平衡时间。
1.3.7 精密度试验
取花瓣花色苷提取液,按1.3.3中的测定方法进行6次平行测定。
1.3.8 回收试验
取两份花瓣花色苷提取液,其中一份花色苷提取液按1.3.3中的测定方法直接测其含量,另一份花色苷提取液中加入已知量的矢车菊素-3-O-葡萄糖苷标准品,按1.3.3中的测定方法测定其含量,将两份样品所得的花色苷含量进行比较,按公式(3)计算加样回收率。

式中:p为加样回收率,%;m1为未加标试样花色苷含量,mg·g-1;m2为加标试样花色苷含量,mg·g-1;m3为加标量,mg·g-1。
1.4 数据处理
用Microsoft Office Excel 2007软件对数据进行处理;用Origin 2018软件绘图。
2 结果与分析
2.1 最大吸收波长的确定
由图1可知,在400~720 nm可见光谱范围内,提取液的吸光度变化呈现出先增大后减小的趋势,即吸收光谱图中只存在唯一的峰值,可以看出最大吸收波长为535 nm。由于花色苷的最大吸收区在500~540 nm波长范围内,说明提取液中存在花色苷类物质[17]。

图1 样品的吸收光谱
2.2 缓冲液pH的确定
花色苷的四种结构在溶液中的存在形式取决于溶液的pH,这四种结构在一定的pH溶液中存在着平衡。(1)当溶液pH较小时以红色的花烊正离子形式存在,此时溶液为深红色;(2)随着溶液pH的升高,溶液逐渐变浅,此时花色苷以无色甲醇假碱或查尔酮形式存在;(3)当pH最高时以蓝色的醌式碱形式存在,溶液为深蓝色[18]。综上所述,pH的选定能影响花色苷定量分析的准确性与灵敏度,在选定溶液pH时应考虑的因素为:两个pH下花色苷的吸光度的差异显著且结构稳定;单一pH的轻微变动对花色苷吸光度的影响是极小的。
因为花色苷只在酸性介质中可以保持稳定,因而试验中只测定酸性介质中不同pH条件下花色苷提取液在最大吸收波长处的吸光度变化。如图2所示,花瓣花色苷在pH 1.0和4.5处的吸光度之间的差值最大,且在pH 1.0和4.5 附近其吸光度变化不大,满足试验要求,因此确定缓冲液pH为1.0和4.5。
2.3 反应平衡温度和平衡时间的确定
花色苷结构之间的转换平衡受溶液pH的影响,因此提取液用缓冲溶液进行稀释时,原有的平衡发生转移,必须静置一段时间达到新的平衡状态后才能测定吸光度。溶液的温度影响反应平衡所需要的时间,溶液温度越高所需要的时间就越少,但花色苷在高温环境中稳定性变差,所以反应平衡温度应控制在40 ℃以下[12]。
如图3和图4所示,在不同缓冲溶液中,吸光度随反应时间的延长所体现出的变化趋势是不同的。在pH为1.0的缓冲溶液中,吸光度随着时间的延长先呈增大的趋势、稳定后又缓慢减小。在pH为4.5的缓冲溶液中,吸光度呈减小的趋势,稳定后又下降。在相同pH的缓冲溶液中,不同的平衡温度下达到新平衡所需要的时间有差异,总体来说,平衡温度越高所需要的时间就越短。综上所述,确定反应平衡温度为40 ℃,时间为50 min。

图2 样品在不同pH下的吸光度

图3 不同平衡温度下吸光度随时间的变化(pH为1.0)

图4 不同平衡温度下吸光度随平衡时间的变化(pH为4.5)
2.4 精密度试验
从表2可知,采用pH示差法测得红花羊蹄甲花瓣中花色苷的含量为10.401 mg·g-1,相对标准偏差为1.17%,表明该方法具有良好的精密度。
2.5 回收试验
测定结果如表3所示,应用pH示差法测定花瓣中花色苷含量,测定的平均加标回收率为100.77%,RSD为1.76%,表明该方法准确可靠,可用于花瓣花色苷含量的实际测定。
3 结论
利用pH示差法测定红花羊蹄甲花瓣花色苷的含量,并对测定条件进行了分析。结果表明:红花羊蹄甲花瓣中花色苷的最大吸收波长为535 nm,符合花色苷的特征吸收峰所在的波长范围,故确定测定波长为535 nm。测定吸光度所用缓冲液pH为1.0和4.5,反应平衡温度为40 ℃,反应平衡时间为50 min。精密度试验结果得到样品中花色苷含量为10.401 mg·g-1,相对标准偏差为1.17%。加标回收法测得平均回收率为99.36%,相对标准偏差为1.69%。总之,采用pH示差法进行定量分析,具有操作简便、准确度高、灵敏性好等优点,能有效消除花瓣在干燥过程中产生的褐色降解物对测定结果的干扰,适合于红花羊蹄甲花瓣花色苷含量的定量分析。

