不同培养条件对vero细胞的增殖及其检测病毒含量的影响
吉哈利,王玉恒,于子淇
(西藏自治区兽医生物药品制造厂,西藏 拉萨 850000)
非洲绿猴肾细胞(vero细胞),是一种从非洲绿猴肾上皮细胞分离出来的异倍体细胞[1]。1962年,日本学者Y.Yasumura和Y.Kawakita分离培养出此细胞系[2,3],具有生长速度快、连续传代、遗传稳定、对病毒广泛适应谱等优点,也是经世界卫生组织(World health Organization,WHO)和《中国药典》认可的应用于人用疫苗和动物疫苗的细胞系,故迅速推动了该细胞系应用于病毒性疫苗、基因工程疫苗等生物制品。现已广泛作用于乙型脑炎、轮状病毒、小反刍兽疫病毒等疫苗的细胞基质[4,6]。因此vero细胞在生物制品研发过程中具有非常重要的作用。
迄今为止,对vero细胞的培养条件以及在动物疫苗研发等方面的研究越来越多。例如,S.F.Chun等[7]开发适用于悬浮液的vero细胞培养工艺技术,从而有利于病毒疫苗研发;R.Samia等[8]研究发现狂犬病毒接种于悬浮培养vero细胞中可获得高滴度病毒;Y.Wu等[9]研究发现了猪流行性腹泻病毒在vero细胞多次传代后可获得弱毒株;薛俊欣等[10]研究发现DMSO体积分数低于1%时对vero细胞无明现毒性;韩伟等[11]研究发现猪乙型脑炎病毒接种于vero细胞培养96 h后,可获得较高滴度的病毒。本试验研究了在不同培养条件下对vero细胞增殖及其检测病毒含量的影响,初步验证了培养vero细胞的最佳培养时间和最佳血清浓度,为生物制品的研发提供一定理论依据。
1 材料
1.1 细胞及疫苗来源
Vero细胞来源于中国兽药监察所,并经过连续传代培养至5代后进行试验。小反刍兽疫活疫苗(clone 9株)来源于西藏自治区兽医生物药品制造厂且已获得国家批号,其病毒效价为103.5 TCID50/头份。
1.2 主要试剂及仪器
DMEM (C11960500BT)、PBS缓冲液(C14190500BT)、胰酶(25200-072)、胎牛血清FBS(16000-044)均购于美国Gibco公司,Cell Counting Kit-8(C0037)购于北京碧云天生物科技公司,其他分析纯均为国产。二氧化碳培养箱(MCO-15AC,日本三洋电机株式会社产品)、体视显微镜(CX21FS1C,奥林巴斯工业有限公司产品)、倒置显微镜(DSZ5000X,重庆奥浦光电技术有限公司产品)、酶标分析仪(DNX-9620,北京普朗新技术有限公司)、台式高速冷冻离心机(TGL16LMB,湖南星科科学仪器有限公司)、电热恒温水浴锅(HH-2A,北京科伟永兴仪器有限公司),其他实验耗材均为美国Corning公司产品。
2 方法
2.1 vero细胞复苏及传代
从液氮罐中取出冻存vero细胞,放置于37 ℃恒温水浴锅中迅速解冻,吸至已加37 ℃培养液的无菌离心管中,离心后弃掉上清液。重新加入37 ℃培养液,轻轻吹打混匀,血细胞计数板进行计数,调整细胞密度为4~5×105个/ml,接种于已加37℃培养液的75cm2培养瓶中,于37℃、5 %CO2培养箱中培养。当细胞生长至75cm2培养瓶壁80%~90 %时,弃掉上清培养液,用PBS清洗vero细胞2~3次,除去死细胞及异物。加入4 ml胰酶放置37℃培养箱消化2~3 min,再加入37℃培养液终止消化,用于接种96孔板。
2.2 CCK-8法检测细胞增殖
Vero细胞消化后,离心后弃掉上清液,重新加入37℃培养液,轻轻吹打混匀,血细胞计数板进行计数,调整细胞密度为1×104个/ml,接种于96孔板。本试验设立3个试验组,分别为DMEM、DMEM+5 %FBS、DMEM+10 %FBS,每组设5个重复孔,其余孔加入100 ul PBS,于37 ℃、5 %CO2培养箱中培养24 h、48 h、72 h、96 h。培养到规定时间后,细胞培养液更换为含10 %CCK-8试剂的细胞培养液,在37℃、5%CO2培养箱继续孵育2.5 h,然后用酶标分析仪检测波长450 nm时其吸光度OD值,并计算重复孔平均值。
2.3 TCID50测定
Vero细胞消化、离心后,调整细胞密度为1×104个/ml,接种96孔板,于37℃、5 %CO2培养箱中培养1~2 h后进行同步接毒。本试验设立两个试验组,分别为DMEM+5 %FBS和DMEM+10 %FBS,每组设3个重复。取出待测活疫苗,按疫苗说明书稀释疫苗为1头份,再进行10倍梯度稀释至1×10-4,并设立阴性对照,滴加入96孔板,于37℃、5%CO2培养箱中培养72 h、96 h、120 h、144 h。培养到规定时间后,观察细胞病变情况,然后采用Reed-Muench法计算TCID50。
2.4 数据分析
采用SPSS 19.0软件包中One-way ANOVA对数据进行差异显著性分析。试验统计数据均为平均值±标准误(Mean±SD)表示。
3 结果
3.1 不同培养时间对vero细胞增殖的影响
为探究培养时间对vero细胞增殖的影响,因此本试验利用CCK-8方法分别检测了vero细胞培养24 h、48 h、72 h和96 h后细胞增殖的情况。结果表明:培养时间的差异对vero细胞增殖有显著作用。由图1可知,在DMEM培养条件下,vero细胞培养72 h的细胞增殖显著高于培养24 h、48 h,但与培养96 h的细胞增殖差异不显著。由图2可知,在DMEM+5 %FBS培养条件下,vero细胞的增殖趋势呈逐渐递增,与DMEM培养条件下细胞增殖趋势相同。由图3可知,在DMEM+10 %FBS培养条件下,vero细胞培养96 h的细胞增殖显著高于培养24 h、48 h、72 h。

图1 在DMEM培养条件下,不同培养时间对vero细胞增殖的影响

图2 在DMEM+5%FBS培养条件下,不同培养时间对vero细胞增殖的影响
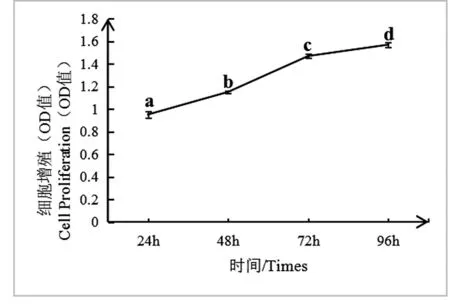
图3 在DMEM+10%FBS培养条件下,不同培养时间对vero细胞增殖的影响
3.2 不同血清浓度对vero细胞增殖的影响
为探究培养液中血清浓度对vero细胞增殖的影响,因此本试验利用CCK-8方法分别检测了vero细胞在DMEM、DMEM+5 %FBS、DMEM+10 %FBS培养条件下细胞增殖的情况。结果表明:在培养液中添加不同浓度的血清对vero细胞增殖有显著作用,其中在vero细胞培养24 h时,不同血清浓度对细胞增殖的影响不显著(见图4);在vero细胞培养48 h时,DMEM+5 %FBS组的细胞增殖显著高于DMEM组,但与DMEM+10 %FBS组差异不显著(见图5);在vero细胞分别培养72 h和96 h时,DMEM+10 %FBS组的细胞增殖均显著高于DMEM组、DMEM+ 5 %FBS组(见图6、图7)。

图4 在培养24 h时,不同血清浓度对vero细胞增殖的影响

图5 在培养48 h时,不同血清浓度对vero细胞增殖的影响

图6 在培养72 h时,不同血清浓度对vero细胞增殖的影响

表1 不同血清浓度对vero细胞检测病毒含量的影响

图7 在培养96 h时,不同血清浓度对vero细胞增殖的影响
3.3 不同血清浓度对vero细胞检测病毒含量的影响
为研究培养液中血清浓度对vero细胞检测病毒含量的影响,因此本试验利用TCID50法计算vero细胞在5 %FBS和10 %FBS培养条件下检测病毒含量的情况。结果表明在5 %FBS和10 %FBS培养条件下,vero细胞检测活疫苗TCID50值的差异不显著(见表1)。
4 讨论
Vero细胞是日本学者Y.Yasumura和Y.Kawakita于1962年从非洲绿猴肾脏分离的异倍体贴附依赖性细胞,并培养出细胞系和不同代次的细胞库[2,3]。1987年,WHO正式批准vero细胞系可作为生物制品生产的基质,迅速推进了人用疫苗和动物疫苗的研发。例如,Barrett等[12]利用vero细胞生产首个人用疫苗—脊髓灰质炎灭活疫苗;R.Samia等[8]研究发现狂犬病毒接种于悬浮培养Vero细胞中可获得高滴度病毒;Y.Wu等[9]研究发现了猪流行性腹泻病毒在vero细胞多次传代后可获得弱毒株;薛俊欣等[10]研究发现DMSO体积分数低于1%时对vero细胞无明现毒性;韩伟等[11]研究发现猪乙型脑炎病毒接种于Vero细胞培养96 h后,可获得较高滴度的病毒。因此在生物制品研发过程中vero细胞具有不可替代的作用。
为了验证vero细胞的培养条件,因此本试验研究了在不同培养条件下,vero细胞的增殖及其检测病毒含量的情况。首先,通过CCK-8方法检测了不同培养时间对vero细胞增殖的影响,结果表明培养时间的差异对vero细胞增殖有显著作用。当培养72 h时的细胞增殖趋势呈逐渐递增,但72 h之后增殖趋势较平缓,也进一步说明vero细胞最佳培养时间为72 h;然后,利用CCK-8方法检测了不同血清浓度对vero细胞增殖的影响,结果表明:在培养液中添加不同浓度的血清对vero细胞增殖有显著影响。当vero细胞培养72 h时,添加10%血清的细胞增殖显著高于不添加血清和添加5%血清,也进一步说明vero细胞最佳血清浓度为10 %;最后利用TCID50法检测培养液中血清浓度对vero细胞检测病毒含量的影响,结果表明:在添加5%血清和10%血清培养条件下,vero细胞检测活疫苗TCID50值的差异不大,也进一步说明vero细胞检测活疫苗病毒含量受培养液血清浓度的影响不大。综上所述,本试验初步验证了培养vero细胞的最佳培养时间和最佳血清浓度,为生物制品的研发奠定基础。

