糖尿病视网膜病变的发病特点及其民族差异
郭萨日娜,朱丹*,陶勇
1内蒙古医科大学附属医院眼科,呼和浩特 010050;2首都医科大学附属北京朝阳医院眼科,北京 100020
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)的眼部并发症,晚期可严重影响中心视力。随着DM患病率逐年上升及人口寿命延长,DR逐渐成为工作人群主要的致盲疾病之一[1]。DR不仅是导致DM患者视力丧失的严重并发症,亦是预测其他并发症如糖尿病肾病(diabetic nephropathy,DN)的重要指标[2]。DR重在早发现、早治疗,从而可降低致盲率,但其发病机制复杂多变、影响因素众多。在众多危险因素中,种族一直被认为是独立危险因素[3]。我国是一个多民族国家,不同的民族具有其独特的遗传学背景、民族文化、地理环境和饮食方式。此外,在经济水平、文化程度和医疗环境等社会因素的影响下,DM及DR普遍具有患病率高、检出率低的特点。全球范围内对不同种族DR的研究已经取得一些成果,但对我国不同民族DR的研究却较为缺乏。为此本文对DR的发病特点、民族差异及其在西北部少数民族中的特点进行综述如下。
1 概 要
DR是一种高度特异性的神经血管疾病,分为非增殖性(non-proliferative diabetic retinopathy,NPDR)和增殖性(proliferative diabetic retinopathy,PDR)两种。NPDR可出现视网膜微动脉瘤、视网膜出血、硬性渗出和黄斑水肿,进一步发展会出现新生血管、棉绒斑、视网膜瘢痕化、玻璃体积血等一系列改变,最终发展为PDR。其中对视力影响最为严重的是新生血管和黄斑水肿。新生血管来自视网膜,存在新生血管的DR即被判定为PDR,若不积极治疗可造成不可逆的视力损害,预后不良。糖尿病性黄斑水肿(diabetic macular edema,DME)是由于血-视网膜屏障被破坏及视网膜毛细血管渗漏所致,可发生于DR的任意阶段,虽不会导致完全失明,但反复发作会严重损伤中心视力。慢性高血糖可导致视网膜血管病变,同时造成视网膜神经元损伤,两者为视力下降的共同原因。此外,DR的发展会加速其他眼部疾病的发生,如白内障、青光眼等[4]。
国际上两个大型的DR流行病学研究[美国糖尿病视网膜病变早期治疗研究(early treatment of diabetic retinopathy in the United States,ETDRS)和威斯康星糖尿病视网膜病变流行病学研究(Wisconsin epidemiology study of diabetic retinopathy,WESDR)]基于大量的临床观察及数据分析修订了DR和DME的国际临床分型,被广泛应用至今。近年来,光学相干断层扫描(optical coherence tomography,OCT)在DR患者DME的严重程度评估和后期治疗中的应用受到广泛重视,但使用OCT对DR和DME进行分类评估的标准尚未明确。
2 病因学研究
2.1危险因素 截至目前,DR的发生与发展机制尚未明确。经典的DR危险因素包括糖尿病病程、血糖、高血压、肾病、高血脂、使用胰岛素、体重指数、性别等[5-11],其他危险因素有吸烟、亚临床甲状腺功能减低、睡眠呼吸暂停综合征、非酒精性脂肪性肝病、血清泌乳素等[12-16]。当DM患者处于妊娠期[17]或青春期[18]时,DR的发生风险会增加 (表1)。胰岛素抵抗[19]被证实为DR的独立危险因素。很多研究表明使用胰岛素是DR的危险因素。1型糖尿病(type 1 diabetes mellitus,T1DM)患者的首选治疗方案是使用胰岛素,2型糖尿病(type 2 diabetes mellitus,T2DM)患者在长期生活干预和药物治疗后血糖仍控制不佳,出现急性或严重慢性并发症,以及应激(感染、外伤、手术等)情况下,应考虑使用胰岛素治疗。WESDR研究显示,使用胰岛素的T2DM患者的PDR患病率相对较高[9]。T1DM患者的DME患病率为20.1%,使用胰岛素的T2DM患者为25.4%,不使用胰岛素的T2DM患者为13.9%[10]。胰岛素是最有效且理想的控制血糖的治疗方式,由于使用胰岛素的患者大多病情较重、血糖控制不佳,其对DR和DME发生发展的作用机制及影响尚需进一步验证。

表1 糖尿病视网膜病变的危险因素Tab.1 Risk factors for diabetic retinopathy
2.2遗传因素 遗传因素在DR发病机制中尤为关键。有研究显示PDR的遗传率为52%[20]。DM作为DR的基础疾病,患病率逐年上升的同时也表现出了明显的家族聚集性。与异卵双胞胎相比,同卵双胞胎的患病率更高且病情具有更高的一致性[21]。迄今为止,已经发现约60个基因位点与DM相关[22],40多个基因位点与T2DM相关[23]。2005年全基因组关联分析(genome-wide association study,GWAS)广泛应用于复杂疾病的病因学研究,随后在中国人群中证实,DR的易感基因包括CPVL/CHN2、SCYL1BP1、API5、CRP、FNDC5、PLXDC2、RhoARHGAP22等,染色体13q22.2、2q31.1和2q37.2存在3个潜在易感位点[24-30]。GWAS为基因研究开启了新纪元,将患者全基因组范围内检测出的单核苷酸多态性位点与对照研究进行比较,不仅具有明确的针对性且提高了检测效率,但由于人群混杂,易出现假阳性或假阴性结果。
3 流行病学研究
3.1国际研究 DR存在明显的种族差异,黑色人种患病率为36.7%,白色人种为24.8%,黄色人种为25.7%[31]。在不同人群中,DR患者的受检率一直存在差异,即使在控制年龄、性别、教育、婚姻状况、保险、家庭收入和人口普查区域等影响因素后,差异仍有统计学意义[2]。因此,进行研究时还应考虑人群本身的特点及所处环境的影响。在多种因素的作用下,很难解释民族差异的存在和影响,但有研究在统一部分影响因素后分析了全球不同民族的DR的患病情况,发现DR患病率存在显著的民族差异,且发病程度亦明显不同[32],如非裔美国人、高加索人和西班牙人DR患病率明显高于其他民族,虽然中国人DR患病率较低,但DME患病率却与高加索人相当,甚至超过了西班牙人(图1)。
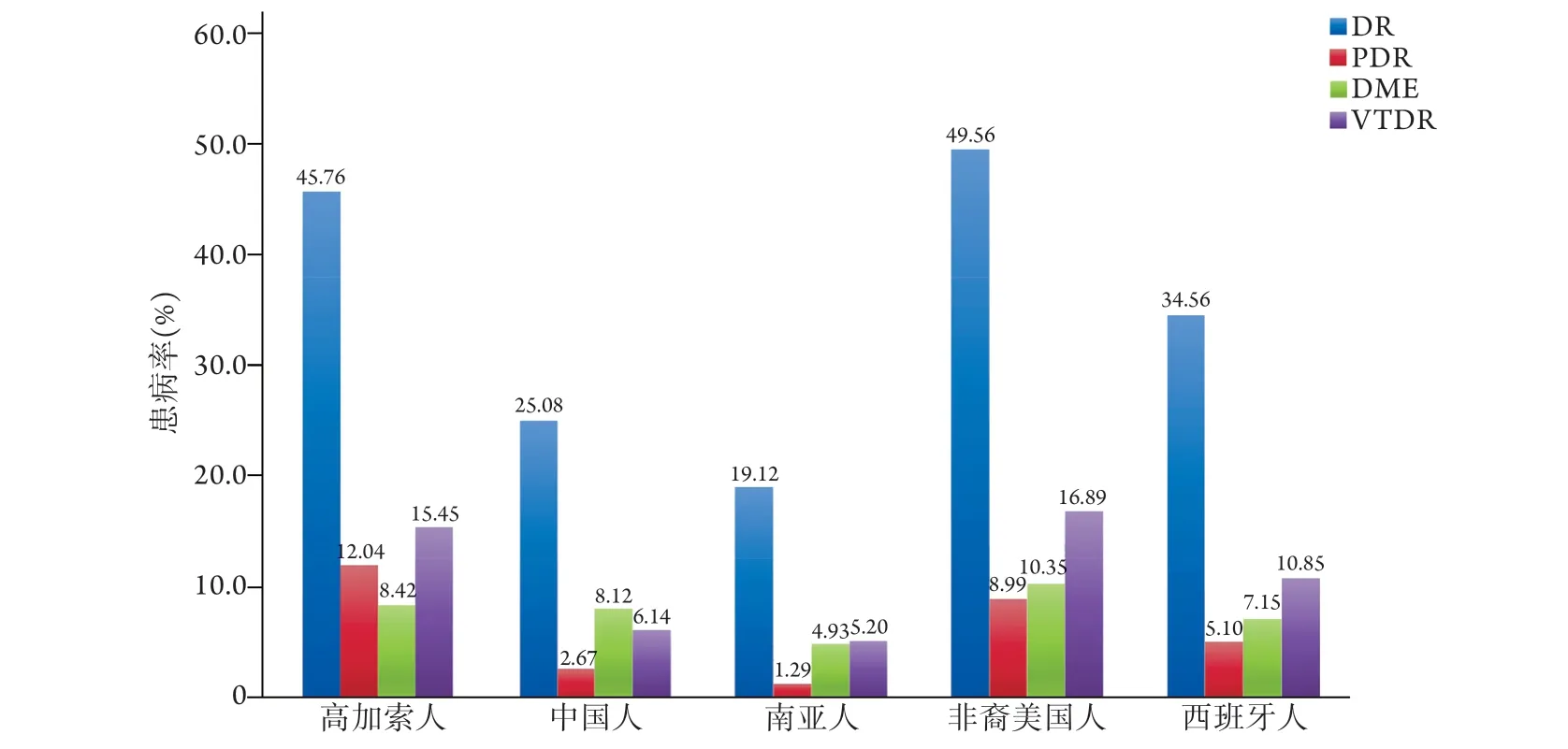
图1 全球部分民族糖尿病视网膜病变患病率及严重程度比较Fig.1 Comparison of prevalence and severity of diabetic retinopathy among selected ethnic groups worldwide
3.2国内研究 中国地域广阔、民族众多,其中汉族占全国人口的91.59%,少数民族占8.41%。一项对1991-2012年中国人口DR患病率的Meta分析显示,中国大陆人群DR患病率为1.3%,其中NPDR为1.1%,PDR为0.1%;DM患者中DR患病率为23.0%,NPDR为19.1%,PDR为2.8%;DR患病率农村高于城市,北方高于南方[33]。
地域差异可影响同种族人群的患病率。中国大陆DM患者中DR患病率为23.0%,美国华裔为25.7%,新加坡华裔为21.0%,中国台湾地区为35.0%,中国香港为18.2%[33-37]。国内T2DM患者中DR患病率北京为37.1%,上海为27.3%,云南为23.6%,天津为16.3%,邯郸为43.1%,佛山为10.7%,泸州为15.6%,呼和浩特为9.4%[38-45]。中国是发展中国家,经济发展不平衡,医疗、卫生保健服务在不同地区存在显著差异,DR作为一种可防可控的疾病与当地的社会、环境因素密不可分。我国发达城市DR患病率相对较高,各地患病率差异大,原因可能为:①受民族差异、经济条件、医疗环境、饮食习惯等多种因素的影响;②我国对DR大规模的横断面研究相对缺乏,在部分研究中,患病率的差异取决于人口数量、调查时间及研究方法。
4 我国部分少数民族DR情况分析
4.1 蒙古族
4.1.1民族特点及发病基础 中国蒙古族人口约581万人,位居世界第一,是我国北方地区主要的少数民族。蒙古族生活在北方,地域寒冷,地理环境决定了该民族独特的生活方式和饮食习惯,即长期以畜牧业作为经济命脉,喜食奶制品和肉类等高热量、高蛋白及高盐饮食,饮用高度白酒次数多且量大。
我国蒙古族血糖和血脂水平偏高,均超出全国平均水平,甚至超过了一些经济发达地区[46-49],但DM患病率却低于全国平均水平(图2)。几乎所有DM患者都要经过糖尿病前期——空腹血糖受损(impaired fasting glucose,IFG)阶段,期间约1/3的人群进展为DM,1/3仍维持IFG状态,1/3血糖恢复正常。国内部分研究对IFG人群进行随访发现,河北开滦地区2年随访中约22.9%进展为DM,北京市朝阳区3年随访中约33.8%进展为DM,内蒙古自治区包头市2年随访中约5.1%进展为DM,上述地区均以汉族人群为主要研究对象[50-52]。对内蒙古自治区古科左后旗和奈曼旗对蒙古族IFG人群进行10年随访发现约15.6%进展为DM[53]。我国早期的少数民族DM流行病学调查显示,蒙古族DM患病率为1.86‰[54],远低于全国平均DM患病率(0.67%)[55]。1996-1997年内蒙古自治区进行了DM普查,结果显示,蒙古族DM患病率(2.57%)低于全国平均DM患病率(3.62%),随后对内蒙古自治区部分地区进行筛查发现,蒙古族DM患病率呈逐年递增趋势,但各地区DM患病率均低于全国平均水平[56-59]。蒙古族大多生活在牧区,受地理位置、医疗环境和语言文化的影响,可能会导致其虽然血糖水平较高但DM检出率偏低。
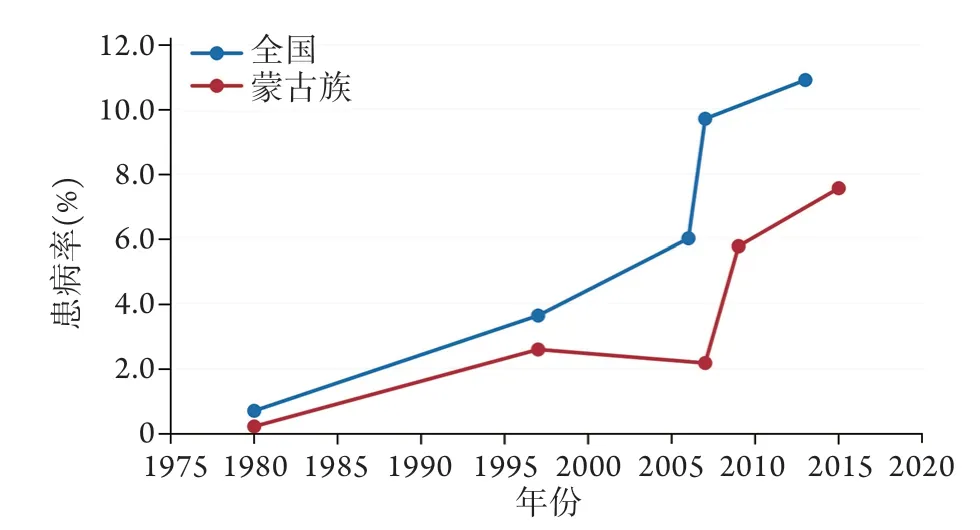
图2 1980-2015年我国蒙古族DM患病率与全国DM平均患病率比较Fig.2 Comparison of Mongolian DM prevalence and National DM prevalence from 1980 to 2015
高血压是糖代谢异常的危险因素之一,其作为DM的前驱症状,可促进DM和DR的发生发展。统计显示,内蒙古牧区蒙古族高血压患病率为26.29%,高于国内其他地区,如上海(20.90%)、天津(17.00%)等[60]。有研究发现,年龄、性别、高血压病程、BMI、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、饮酒和口味偏甜等是蒙古族T2DM患者并发高血压的危险因素,其中高血压病程、饮酒主要影响收缩压,性别主要影响舒张压[61]。酒精摄入对DM的影响存在争议[62]。Shi等[63]研究发现适量饮酒对DM具有保护作用;Todoroki等[64]认为饮酒与DM无相关性;富琳岩 等[65]未发现蒙古族人饮酒与DM存在相关性。
从红肉中摄取的血红素铁含量与T2DM的发生风险呈正相关,过量的铁储备可能会促进胰岛素抵抗,促进T2DM的发展[66]。与日本人相比,蒙古族人的饮食以红肉为主,Batchuluun等[67]发现蒙古族T2DM患者中高铁血症患病率很高,且蒙古族人的BMI和腰臀比高于日本人[68],但DM患病率低于日本人[69]。乌云高娃等[70]的调查显示,蒙古族牧民DM患病率低于蒙古族农民。随着社会发展,蒙古族人的生活环境由牧区迁徙至城市,不再进行游牧工作,劳动量减少,但高热量饮食方式却仍然保留。近年蒙古族人DM患病率呈升高趋势,这可能与其生活环境的改变有关。
4.1.2研究进展 维生素A结合蛋白质-4被认为是脂肪细胞来源的可促进胰岛素抵抗的分子。Munkhtulga等[71]认为,维生素A结合蛋白质-4可增加蒙古族人患DM的风险。研究发现,位于染色体11p15.5的KCNQ1基因编码的于β细胞中表达的成孔亚基(作用于电压门控钾通道,调节胰岛素的分泌),11p15.1上的KCNJ11基因编码的钾通道亚基Kir6.2,以及ABCC8基因编码的磺酰脲受体-1共同形成β细胞三磷酸腺苷敏感性钾通道,调节胰岛素的释放,其多态性可能与蒙古族人患T2DM相关[72]。
维生素D(vitamin D,VD)是一种固醇类衍生物,在肝脏中活化为25-羟基维生素D[25-dihydroxy vitamin D,25-(OH)-VD],进入肾脏后在肾线粒体单氧酶的作用下活化形成1,25-二羟基维生素D[1,25-dihydroxy vitamin D,1,25-(OH)2-VD3],参与调节细胞内钙离子的浓度,影响胰岛素的合成与分泌;维生素D受体(vitamin D receptor,VDR)为亲核蛋白,是介导1,25-(OH)2-VD3发挥生物学效应的核内生物大分子,二者相结合参与免疫调节,可抑制全身炎症反应,减轻胰岛β细胞的免疫损伤,以及增加胰岛素的敏感性。有研究发现,紫外线照射较弱的地区T1DM患病率较高,血清25-(OH)-VD水平较高的个体NPDR患病率较低。血清25-(OH)-VD水平≥75 nmol/L时,可通过抑制炎性因子和其他毒性剂来减轻眼部的炎症状态,从而降低DR患病率[73]。VDR基因多态性与多种疾病相关,包括生长发育迟缓、骨质疏松症、自身免疫性疾病和DM及其并发症DR等。近年来,越来越多的研究开始分析VDR基因多态性及体内VD水平与DR的相关性。目前,VDR基因多态性的研究主要集中在Apa Ⅰ(rs7975232)、Bsm Ⅰ(rs1544410)、Taq Ⅰ (rs731236)、Fok Ⅰ(rs10735810)等4个单核苷酸多态性位点。研究发现克罗地亚南部人群中Bsm Ⅰ与DR患病率显著相关[74];法国人群中Fok Ⅰ和Taq Ⅰ与DR相关[75-76];但Capoluongo等[77]未发现Fok Ⅰ和Bsm Ⅰ 与意大利人DR有相关性。乌云娜等[78]发现Fok Ⅰ与蒙古族T2DM患者DR的发病相关,等位基因f为易感基因,蒙古族ff基因频率高于全国平均水平。由于样本量小,数据不足,尚不能断定VDR基因是中国人群DR的易感基因,二者是否具有相关性尚需更多的研究证实。
大量研究发现屈光不正可能会影响DR的进展,尤其是近视(≤-2.0 D)对PDR的发展具有延缓作用[79-81]。伴有远视、低度近视的DM患者与正视的DM患者发生DR的风险无明显差异[82]。高度近视的DR患者多伴有眼轴增长、后巩膜葡萄肿、视网膜及脉络膜萎缩,随着巩膜壁延伸和后极部变形,视网膜血流速度减慢、血管壁压力降低,致使血管渗漏减少、巨噬细胞聚集减少,进而减轻DM患者眼底的高灌注状态[83]。有研究发现,高度近视患者眼内液中血管内皮生长因子(vascular endothelial growth factor,VEGF)和促红细胞生成素(erythropoietin,EPO)水平均下调,色素上皮衍生因子(pigment epithelium-derived factor,PEDF)水平略升高,这可能对DR的发展起到阻滞作用,但目前尚未证实[84-85]。蒙古族具有眼球小、浅前房、窄房角的解剖特点,因此原发性闭角型青光眼患病率较汉族高[86]。高楠楠等[87]发现,蒙古族青少年的眼轴长度低于汉族,且随着眼轴长度的逐年递增,汉族的增长量较蒙古族多。值得关注的是,黑色人种近视率较低[88],但DR患病率较高。按照解剖结构和生长发育特征,蒙古族具备了近视率低的特点,在排除其他因素的影响下,可进行屈光不正与蒙古族DR的流行病学研究。
4.2 纳西族
4.2.1民族特点及发病基础 纳西族是中国云南省特有的少数民族,具有较高的聚居性和特有的生活方式。纳西族现有人口为30万,其中58%集中分布在云南省玉龙纳西族自治县。纳西族以玉米、青稞为主食,喜食牛肉、腌制猪肉,以及酥油茶等高脂肪、高热量乳制品,好饮酒,以畜牧业为主要经济来源。
肖丽波等[89]研究发现,纳西族T2DM患者中DR检出率明显高于汉族,年龄、糖尿病病程、高血压及BMI是DR发生的独立危险因素。纳西族DM患病率为4.1%,主要影响因素为高血压、高盐饮食、肥胖和年龄增长等[90];纳西族村民高血压患病率为27.0%[91];纳西族居民肥胖率和中心性肥胖率分别为8.9%和39.5%,女性明显高于男性[92]。上述研究表明,很多慢性病(特指DR、DM、高血压等)的发病与患者的社会经济地位及文化教育程度密切相关。
4.2.2研究进展 FOXC2基因存在于脂肪和骨骼肌中,其高表达可诱导棕色脂肪分化,提高胰岛素的敏感性,从而预防肥胖及抑制胰岛素抵抗的发生。不同地域和不同种族的FOXC2基因多态性分布存在一定差异。FOXC2基因全长1506 bp,包含一个独立编码的外显子,由染色体16q24.3区域基因编码,可激活过氧化物酶体增殖物激活受体γ/类维生素A受体(PPARγ/RXR)异二聚体、CCAAT增强子结合蛋白(C/EBP)、脂肪细胞分化决定因子/固醇调控结合蛋白1(ADD1/SREBP1)的转录,从而调控脂肪细胞的分化,在脂肪细胞代谢调节中起关键作用,其中FOXC2 mRNA的表达水平与胰岛素的敏感性明显相关[93-94]。刘文秀等[95]研究发现,在云南省纳西族人群中血脂代谢与FOXC2基因G-350T多态性相关,但与云南省少数民族的T2DM、代谢综合征是否相关仍需进一步研究。其中C-512T等位基因频率与朱王亮等[96]对蒙古族人群FOXC2基因多态性的研究结果不同,进一步证实FOXC2基因表型与地域和环境因素密切相关。
4.3 维吾尔族
4.3.1民族特点及发病基础 维吾尔族是新疆糖尿病的高发民族,喜食高脂、高盐、高糖食物。张宏等[97]的横断面调查显示,新疆糖尿病前期患病率最高的是维吾尔族(31.6%);Yang等[98]的大样本流行病学研究显示,新疆维吾尔族T2DM患病率为6.23%;早期调查显示,维吾尔族T2DM患者DR患病率为31.52%[99]。上述研究发现,患者普遍存在血脂异常、高血压、高尿酸、代谢综合征或肥胖等症状。
4.3.2研究进展 由高血糖引起的慢性视网膜炎症与DR发病密切相关,可在DR患者的玻璃体液、房水及血液中检测到大量炎性因子水平升高,如干扰素γ(IFN-γ)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及IL-1β等[100]。孙家琳等[101]的研究发现,新疆维吾尔族DR患者血清中低水平的IFN-γ和高水平的IL-6是加剧其视网膜病变的危险因素,血清中1,25-(OH)2-VD3水平与DR严重程度呈负相关。IFN-γ是一种多功能的免疫调节因子,亦是内源性血管抑制因子,可被诱导产生干扰素诱导蛋白10(interferon gamma inducible protein 10,IP-10)而发挥作用。有学者认为,DR早期由于内皮细胞及血管基膜受损,促使IFN-γ水平增高、抑制作用增强,随着病情进展,在DR增殖期机体免疫力下降、组织细胞严重缺氧等多种病理因素作用下,抑制作用减弱致使IFN-γ对VEGF等其他生长因子的拮抗作用失衡[102]。IL-6是具有多种生物活性的细胞因子,是由人IL-6基因编码的一种生物活性糖蛋白,在眼内主要由视网膜色素上皮细胞、虹膜、睫状体和角膜上皮细胞产生,其可诱导VEGF的分泌,产生视网膜新生血管,以及增加血管通透性[103],使DR进一步加重并诱发DME。在遗传学方面,周维等[104]研究了维吾尔族VDR基因多态性与DR的遗传易感性,发现Apa Ⅰ(rs7975232)、 Bsm Ⅰ(rs1544410)、Taq Ⅰ(rs731236)3个位点可能与DR发病相关,但尚需进一步验证。
5 总结与展望
DR发生的民族差异和地域特征是一个重要的公共卫生问题。虽然少数民族的生活方式有所改变,但在进化史上已经形成了各自独特的遗传学背景。在不同民族中对DR进行筛查有利于预防和降低视力丧失的风险,因地制宜、因人而异地进行慢性病的防治工作,可以提早发现和防治疾病的易感人群。控制血糖是防治DR最直接、最重要的方法,而进行易感性和危险因素分析对DR的个体化预防和治疗至关重要。此外,通过基因检测和血清、房水、眼内液的检测等新型医疗诊断技术来寻找诱发DR发生的某些细胞因子,应用内皮细胞保护剂或拮抗剂调控其表达及功能,是从根本上阻断DM及其并发症的有力措施。最大限度地提高和改善少数民族DM患者的视力保健可使DR总患病率下降,并为DR的发病机制及治疗和预防研究提供新思路。

