促红细胞生成素产生细胞与慢性肾脏病贫血及肾纤维化关系的研究进展
李菲,魏日胞,2*
1南开大学医学院临床医学系,天津 300071;2解放军总医院第一医学中心肾脏病科/全军肾脏病研究所/肾脏疾病国家重点实验室/国家慢性肾病临床医学研究中心/肾脏疾病研究北京市重点实验室,北京 100853
截至2017年,全球共有6.97亿慢性肾脏病(chronic kidney disease,CKD)患者,影响约10%的人群,死亡率较高,其中近1/3的CKD患者在中国及印度,患病人数分别为1.32亿和1.15亿[1]。CKD 1-5期未透析患者的贫血总患病率为51.5%,CKD 5期患者的贫血总患病率甚至高达90.2%[2],因此深入研究肾性贫血的机制具有重要意义。促红细胞生成素(erythropoietin,EPO)是一种不可缺少的内源性糖蛋白激素,在成人主要由肾脏产生,随着CKD进展,EPO含量下降。肾促红细胞生成素产生细胞(erythropoietin-producing cells,REPs)本质为肾间质成纤维细胞,以产生EPO为主,REPs的功能障碍及向肌成纤维细胞的表型转化在啮齿类动物肾损伤模型中虽已有报道[3],但有关REPs的许多方面仍有待阐明。本文基于REPs的病理生理学研究进展,深入探讨REPs与肾性贫血及肾间质纤维化(renal interstitial fibrosis,RIF)的关系,并以此为基础总结了有关REPs转化机制的中药研究现状。
1 REPs概述
1.1REPs简介 REPs是随着转基因小鼠的出现而被发现的。在缺氧的微环境中,能产生EPO的细胞被称为REPs。研究者分别在1993年、2008年采用原位杂交和转基因小鼠技术证实了REPs是肾脏近髓皮质处的间质成纤维细胞[4-5],且在2011年发现这些细胞表达成纤维细胞标志物CD73及血小板源性生长因子受体β(platelet-derived growth factor receptor alphapositive,PDGFR-β)[3],随后又有研究采用绿色荧光蛋白互补DNA(cDNA)导入内源性EPO位点,进一步佐证了之前的观点,此外还发现这些细胞具有神经元样形态,并表达神经元标记基因[6]。谱系追踪研究表明,REPs起源于肾外部位(迁移的神经嵴细胞),在肾发生过程中进入鼠胚肾[3],而最近的研究发现了REPs的祖细胞,即具有EPO产生能力的细胞,衍生于表达人转录因子叉头框1 (human forkhead box D1,FOXD1) 的基质祖细胞(其在肾脏发育过程中产生肾间质成纤维细胞、周细胞、系膜细胞及血管平滑肌细胞)[7]。以上研究明确证实了REPs位于近髓皮质处,本质为肾间质成纤维细胞,存在神经元标记物的表达可能因为它起源于神经嵴细胞。
1.2REPs调控 EPO生成不足是肾性贫血最主要的因素,其中氧感知障碍可能是CKD患者REPs生成EPO减少的机制之一[8]。在正常生理条件下,REPs在近髓皮质处,但在氧分压下降时,该REPs细胞群扩展至表层的皮质间质纤维细胞[9],诱导EPO表达,且REPs延长其突起将毛细血管固定在小管间质中,为EPO分泌到血液中提供了微环境结构优势。此外,被REPs包围固定的毛细血管携带的血液已通过肾小球滤过,因此,REPs周围的氧供持续处于低水平,从而源源不断地产生EPO。除氧供减少外,REPs细胞旁的肾小管细胞消耗高水平的氧以供其重吸收(图1)。REPs微环境中氧通量的快速变化使REPs对机体缺氧高度敏感。因此,低氧可诱导肾脏中的REPs合成EPO[10]。
机体与缺氧有关的生理及病理过程通常由低氧诱导因子(hypoxia inducible factor,HIF)调节[11-12]。 在基因转录水平上,全身性基因敲除小鼠研究发现,HIF特异性脯氨酰羟化酶(prolyl hydroxylase domain proteins,PHD)2及HIF2α是调控REPs中EPO基因表达最重要的因子[13-14]。REPs细胞在常氧状态处于静止期,且大多数REPs在健康小鼠中不产生EPO[15],为REPs的储存库(OFF-REPs)。当氧分压降低时,OFF-REPs通过PHD2-HIF2α-EPO信号轴产生EPO,转为ON-REPs,致使肾脏总EPO合成明显增加,并刺激骨髓及脾脏生成红细胞,重新建立氧稳态[16](图1)。然而,即使在重度慢性贫血条件下,仍仅有10%的REPs激活为ON-REPs[17],提示每个REPs产生EPO的能力很强,大多数OFF-REPs可能为更加严重的贫血起到储备作用。这些数据表明缺氧是REPs活化的开关,PHD2-HIF2α-EPO信号轴功能障碍是造成肾性贫血的主要原因。
2 REPs的转化
2.1REPs与RIF 在慢性肾病中,除肾性贫血外,RIF也是CKD的常见并发症之一,影响着全球10%的人口,70岁以上的老年人甚至达到50%[18]。RIF的基本特征为肾肌成纤维细胞活化与增殖,细胞外基质大量合成且降解减少,累积到肾小管周围间质中,最终导致肾衰竭[19]。RIF中肌成纤维细胞的来源多种多样,主要包括骨髓来源的成纤维细胞、肾小管上皮细胞、内皮细胞、周细胞及间质成纤维细胞,但其确切起源仍存在广泛争议[20]。如前所述,分布在近髓皮质的REPs是EPO产生的部位,而大量研究表明,REPs在肾脏损伤时转化为肌成纤维细胞-肾促红细胞生成素产生细胞(myofibroblasts-renal erythropoietin-producing cells,MF-REPs),并导致了RIF[3,21-23]。谱系追踪研究显示,在单侧输尿管梗阻(unilateral ureteral obstruction,UUO)模型中,遗传性超级贫血转基因小鼠肾脏近髓皮质处的间质主要被MF-REPs取代,证实REPs是肌成纤维细胞的主要来源。在单侧输尿管梗阻24 h内,REPs丧失产生EPO的能力,在梗阻2 d后,REPs细胞中可观察到α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的强表达(α-SMA是肌成纤维细胞中的一种特异性标志物)。此外,通过基因分析发现,MF-REPs可产生炎性细胞因子、趋化因子及细胞外基质,均可促进肾纤维化[23]。REPs转化为MF-REPs后,基本丧失了产生EPO的能力[24]。本课题组亦发现严重的肾小管间质损伤与肾性贫血有关[25]。因此,CKD贫血与纤维化密切相关。REPs负责CKD的两个表型:贫血及纤维化。这种直接联系提示我们或许可以通过靶向调节REPs的细胞特性来同时治疗CKD的纤维化及贫血。
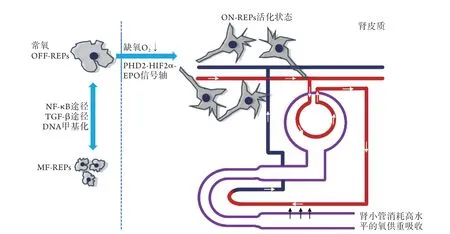
图1 慢性肾病REPs的调控及转化机制Fig.1 Regulation and transformation mechanism of REPs
2.2REPs的转化及逆转机制 近些年来,关于REPs转化为MF-REPs的研究取得了显著的进展,且此过程具有可逆性,为治疗CKD纤维化和贫血开辟了新的途径。Souma等[23]发现UUO诱导的炎症微环境激活了REPs中的NF-κB及TGF-β Smad信号通路,从而抑制了REPs产生EPO,导致其向MF-REPs转化;且NF-κB信号通路负责早期迅速抑制REPs产生EPO,而Smad信号通路则主要负责纤维化的激活。另外,通过逆转炎症微环境,恢复了REPs的能力,并且抗感染治疗加速了这种表型的逆转。López-Hernández等[26]发现,TNF-α参与了炎性细胞的浸润及活化,激活NF-κB,促使成纤维细胞向肌成纤维细胞转化。最近Sato等[27]建立了REPs来源的永生化可培养细胞系(Replic细胞系),证实了TGF-β信号转导途径有助于维持Replic细胞系的肌成纤维细胞特征,再一次表明此通路参与了REPs的转化。通过药物阻断NF-κB和TGF-β Smad信号通路,或许可以逆转REPs的转化,靶向治疗CKD的贫血及纤维化。
最近对REPs的表观遗传学研究发现,间质成纤维细胞的激活及其向肌成纤维细胞的转化受到了表观遗传机制的调控[28]。Bechtel等[29]发现,TGF-β1引起的RASAL1启动子甲基化可导致成纤维细胞活化以及持续的肾脏纤维化,此过程由DNA甲基转移酶(DNA methyltransferase,DNMT)介导。随后Tampe等[30]再一次证实了此观点。此外,Chang等[8]发现DNMT1抑制剂5-氮杂-2'-脱氧胞苷(5-Aza-2'-deoxycytidine,5-Aza)通过抑制EPO基因启动子的DNA甲基化,恢复了原代培养小鼠MF-REPs产生EPO的功能,提示Aza在一定程度上可恢复REPs的功能。然而使用Aza会产生多种不良反应,高剂量的Aza可能因其细胞毒性而诱导骨髓抑制,因此仍需大量实验进一步评估其功效。
Sato等[31]认为REPs的转化分为2个阶段,即PHD过度活化的早期MF-REPs阶段及EPO启动子高甲基化的进行性MF-REPs阶段,因此PHD抑制剂可有效抑制早期MF-REPs。但矛盾的是,Souma等[24]发现,PHD的敲除重新激活了MF-REPs中EPO基因的表达,但对肾脏的病理性纤维化无保护作用,猜测可能的原因是早期MF-REPs基本不参与肾脏纤维化的进程,但仍需要进一步探究。
3 有关REPs转化机制的中药研究现状
3.1抑制TGF-β Smad信号通路
3.1.1纯化合物 茯苓酸(一种茯苓菌核成分)可通过阻断Smad2/3-TGF-β受体蛋白的相互作用,抑制TGF-β1/Smad通路[32]。丹酚酸A、B及丹参酮ⅡA(丹参成分)均可通过抑制TGF-β1/Smad信号通路来抑制肾纤维化并改善肾功能[33-35]。盐酸川芎嗪可明显降低UUO大鼠TGF-β1mRNA的表达[36]。双氢青蒿素可通过调节成纤维细胞增殖及分化治疗肾脏纤维化,且可明显减弱TGF-β1诱导成纤维细胞向肌成纤维细胞的转化[37]。3,3'-二吲哚甲烷(十字花科植物中提取的一种天然酸缩合物)可通过抑制成纤维细胞活化及TGF-β/Smad 2/3信号通路减轻RIF[38]。
3.1.2中草药复方 黄芪汤(由黄芪、茯苓、天花粉、麦冬、五味子、甘草、生地组成)可通过抑制TGF-β1/Smad信号通路逆转5/6肾切除大鼠的肾纤维化,考虑与抑制成纤维细胞转化为肌成纤维细胞有关[39]。抗纤灵颗粒(由丹参、大黄、当归、牛膝、桃仁组成)可抑制成纤维细胞的转化[40]。此外,尿毒清颗粒[41]可抑制UUO小鼠模型的TGF-β1信号通路。
3.2抑制NF-κB信号通路
3.2.1纯化合物 丹参酮ⅡA也可通过抑制NF-κB通路来减轻肾纤维化及炎症[35]。黄芪甲苷(膜夹黄芪生物活性成分)可通过调节NF-κB信号通路的活性抑制成纤维细胞的转化及细胞外基质的形成[42]。红景天苷(玫瑰红景天的活性成分)可明显减少炎性因子的释放,并抑制TLR4/NF-κB信号通路,从而改善RIF[43]。
3.2.2中草药复方 雷公藤总甙片可通过抑制TLR4/NF-κB通路改善肾纤维化[44]。六味地黄丸可通过抑制氧化应激,脂质过氧化,TGF-β/Smad、MAPK及NF-κB信号通路预防肾纤维化[45]。抗纤灵颗粒也可通过抑制NF-κB信号通路预防肾脏纤维化[36]。
3.3干预DNA甲基化 姜黄素(姜黄中提取的多酚类色素)可抑制Klotho(一种抗衰老和纤维化抑制蛋白)启动子的CpG甲基化,从而抑制TGF-β途径、减轻肾纤维化[46]。金雀异黄素(染料木素)通过抑制甲基转移酶,恢复Klotho表达,进而发挥抗纤维化作用[47]。上述中药可能通过恢复Klotho表达,进而抑制TGF-β信号转导途径,最终抑制REPs向MF-REPs的转化,从而达到治疗的目的。总之,干预DNA甲基化为治疗CKD带来了新的曙光。
综上所述,本文对REPs与CKD贫血及纤维化的关系进行综述,阐明了REPs向MF-REPs的转化是CKD发生贫血及纤维化的重要原因,而恢复纤维化肾脏REPs的生理特征将为治疗CKD开辟新的途径。许多中药可明显抑制REPs的转化,但遗憾的是以上研究均侧重的是抗肾纤维化,是否对肾性贫血有改善作用仍需科研工作者的深入研究,且更多中药的抗REPs转化机制也需不断探索。

