移植后糖尿病的药物治疗研究进展
周厚地,郑宏庭,隆敏
陆军军医大学附属新桥医院内分泌科,重庆 400037
移植后糖尿病(post-transplant diabetes mellitus,PTDM)是实体器官移植患者术后常见的慢性并发症,有研究报道移植术后PTDM的累积发病率为20%~40%[1-4],高于2型糖尿病9.3%的全球发病率[5]。 已有研究表明,PTDM与患者最终的不良结局有关,如增加了感染、心血管疾病和慢性同种异体移植物功能障碍的风险[6-8]。因此,根据患者病情制定合理的PTDM治疗方案十分必要。然而,由于其特殊的移植病史,不能简单地参照2型糖尿病的治疗指南,需结合患者免疫抑制药物的使用、移植物功能、血糖水平、肝肾功能等采用恰当的治疗 方案。
2003年,由国际性多学科专家委员会制定的指南[9]首次提出了移植后新发糖尿病(new onset diabetes after transplantation,NODAT)的概念,指移植前没有而移植后新发生的糖尿病。然而,实际上并不是所有移植中心都会在移植前完善口服葡萄糖耐量试验(OGTT)确诊或排除糖尿病,因此,在2014年新的国际共识中,第一次使用PTDM一词来描述移植后诊断的糖尿病并沿用至今,该定义强调糖尿病诊断的时间,而不是发生的时间,换句话说,PTDM并不能完全排除移植前可能已经存在但未能确诊的糖尿病。该共识建议血糖及糖化血红蛋白(glycosylated hemoglobin,HbA1c)标准参照美国糖尿病协会(American Diabetes Association,ADA)关于普通人群的糖尿病诊断标准执行[10]。鉴于PTDM的血糖变化特点,可能不稳定的肾功能,以及我国各地区HbA1c检测标准尚未统一,适用于中国人群诊断糖尿病的HbA1c切点值尚无定论等原因[11],笔者不主张HbA1c作为我国PTDM的诊断指标,但可作为其血糖监测指标及今后研究的方向。
1 PTDM血糖谱改变特点及风险评估
PTDM患者的血糖变化有一定的特点,很多同种异体移植受者在移植后的1~2周即可出现血糖升高,之后血糖逐渐下降并趋于平稳[12-13]。有研究显示,肾移植后第1、2、3年的PTDM累积发生率分别为24.58%、27.93%和30.73%,其中39%的PTDM于移植后3个月内诊断,58%在半年内被诊断[4],因此使用降糖药物要根据血糖情况及时调整用药。术后早期,因为出血、红细胞周转率增高、促红细胞生成素的使用[14]等原因,不推荐使用HbA1c来监测血糖控制情况[10,15]。此时,建议保持空腹血糖<7 mmol/L,餐后血糖<10 mmol/L[16]。而在移植后6~12个月,可以用HbA1c来监测血糖控制情况[17]。一般来说,HbA1c的控制目标为7.0%~7.5%[10,18]。
鉴于PTDM的高发病率,笔者建议所有移植受者均应进行相应的风险评估。既往研究显示,PTDM发生的危险因素主要包括高龄、有糖尿病家族史、使用他克莫司、感染丙型肝炎病毒及多囊肾等[19-21]。我国新近研究结果提示体重指数(body mass index,BMI)≥25 kg/m2、移植前低镁血症、移植后3个月内发生急性排斥反应、移植前空腹血糖升高、移植后第1周血糖升高也是PTDM发病的独立危险因素[4]。
2 传统降糖药在PTDM治疗中的应用
传统降糖药主要指胰岛素、二甲双胍、磺脲类、格列奈类、噻唑烷二酮及α-糖苷酶抑制剂。截至目前,除了α-糖苷酶抑制剂治疗PTDM的临床研究较罕见外,其他种类药物用于PTDM的治疗均有报道,这些数据主要来自肾移植患者(表1)。
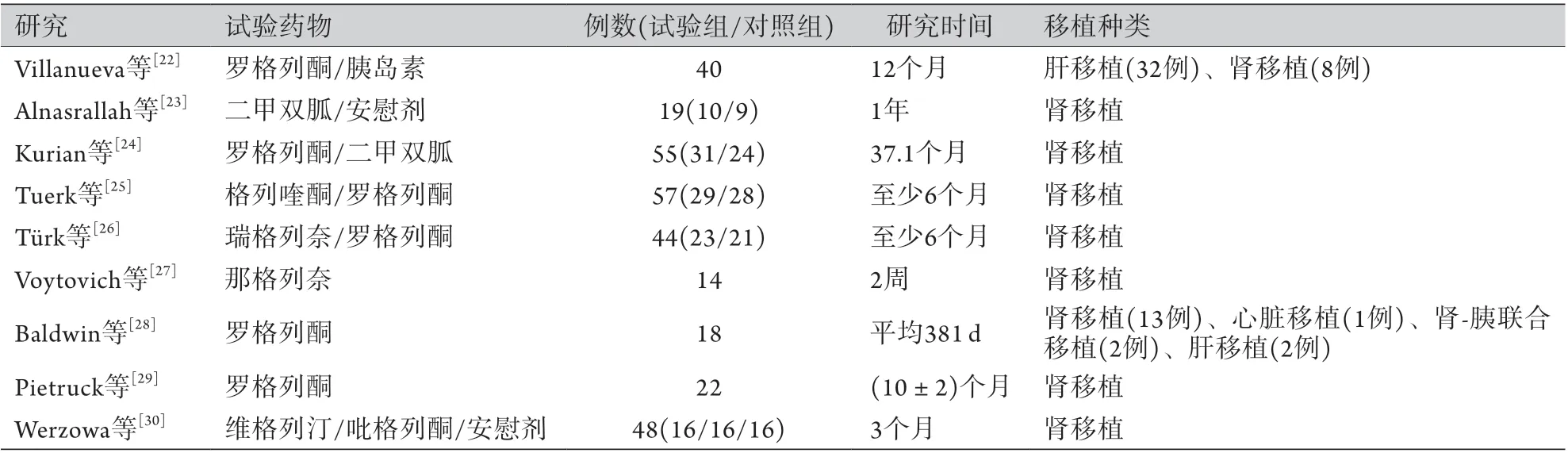
表1 传统降糖药治疗PTDM患者的临床试验概况Tab.1 Clinical trials of traditional hypoglycemic drugs in treatment of PTDM
2.1胰岛素 目前认为在移植后的前1~2个月,胰岛素是PTDM治疗的首选用药[10]。研究发现,对PTDM患者早期用胰岛素治疗对胰岛功能可能具有保护作用,有助于减少长期甚至终生使用胰岛素的可能[22]。Hecking等[12]也证实,在肾移植后第1周内开始使用胰岛素强化治疗,与常规降糖治疗相比,1年后PTDM发生率降低73%,HbA1c水平更低,甚至全部(25例)患者停用胰岛素。
2.2其他降糖药 尽管有多种口服降糖药可治疗2型糖尿病,且这些药物均有确切的降血糖作用,但仅部分药物在器官移植患者中进行了安全性研究。二甲双胍在2型糖尿病治疗中处于一线地位,目前已有关于二甲双胍在PTDM中使用的研究,主要关注其安全性问题。一项研究在肾移植后糖调节受损(impaired glucose tolerance,IGT)患者中使用二甲双胍,结果证实二甲双胍与安慰剂在控制患者体重、心血管事件、血脂变化、急性排斥反应等方面无明显差异,但本研究的受试者较少[23]。另一项单中心有关肾移植后PTDM治疗的研究结果显示,二甲双胍未能明显降低肾小球滤过率(glomerular filtration rate,GFR),也未出现心力衰竭及肝功能损伤[24]。
磺脲类药物格列喹酮[25]、格列奈类药物瑞格列奈[26]和那格列奈[27]均在PTDM的治疗中显示出有效性和安全性。就低血糖而言,这类药物的作用机制为刺激胰岛素分泌,因此,使用中应考虑PTDM特征性的血糖变化,警惕低血糖发生。
关于噻唑烷二酮类药物罗格列酮的临床试验相对较多[22,24,28-29],且不少其他关于PTDM的治疗药物研究将其作为对照组[25-26],由此可见罗格列酮在PTDM治疗中的安全性得到了公认,这是由于罗格列酮在体内被完全代谢,无原形药物从尿中排出,对于轻至重度肾功能损害甚至透析患者都无须调整剂量。吡格列酮对移植后IGT患者血脂、肝肾功能的影响与安慰剂无差别[30]。然而,因为噻唑烷二酮类药物存在引起水钠潴留、增加体重甚至诱发心力衰竭的风险[31-34]等,对于有高危心血管疾病风险的PTDM患者,尤其是心脏移植后发生PTDM的患者使用时应当谨慎。
3 新型降糖药在PTDM治疗中的应用
近10年来,新上市的降糖药主要有二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制剂、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂和钠-葡萄糖协同转运蛋白-2(sodium-dependent glucose transporters-2,SGLT-2)抑制剂,这些药物均有应用于PTDM治疗的临床研究报道(表2)。DPP-4抑制剂用于PTDM治疗时,多使用西格列汀和维格列汀,在多项研究中显示出其安全性,具体表现为低血糖发生率低且对体重无不利影响[35-39],应用前景较好。
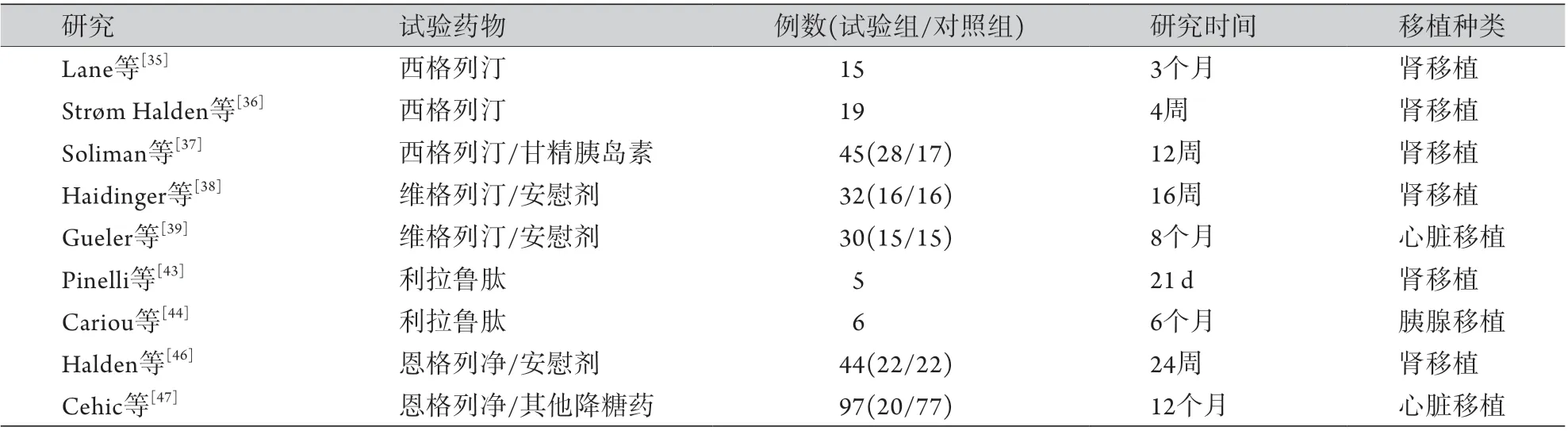
表2 新型降糖药治疗PTDM患者的临床试验概况Tab.2 Clinical trials of new hypoglycemic drugs in treatment of PTDM
GLP-1受体激动剂在PTDM治疗中的临床试验还较少,但因其在有高危心血管事件风险的2型糖尿病患者中被证实可以提高生存率[40-41],使研究人员在PTDM的治疗中把目光投向这些新型降糖药。目前证据显示GLP-1受体激动剂对PTDM患者的降糖治疗具有较好的有效性和安全性。GLP-1可恢复肾移植后PTDM患者的胰岛素分泌并抑制胰高血糖素分泌[42]。一项使用利拉鲁肽治疗肾移植后PTDM患者的短期研究发现,该药在降低血糖和体重的同时,并未显示出对急性排斥反应、肾功能和免疫抑制剂(他克莫司)浓度有影响[43]。另一项为期6个月使用利拉鲁肽治疗胰腺移植术后PTDM的研究也证实了其有效的降糖作用和良好的安全性,且不影响免疫抑制剂方案[44]。
SGLT-2抑制剂是否能用于PTDM的常规治疗尚存争议。理论上,对于GFR<60 ml/(min·1.73 m2)的患者,SGLT-2抑制剂的降糖作用显著[45];对于使用免疫抑制剂的患者,应用SGLT-2抑制剂存在较大的泌尿系感染不良事件发生风险;此外其与免疫抑制剂的相互作用不明确。因此部分学者不建议PTDM患者使用SGLT-2抑制剂。尽管如此,仍有少量临床观察针对这一问题进行了研究。一项前瞻性随机双盲研究纳入GFR ≥30 ml/(min·1.73 m2)的肾移植后PTDM患者24例,使用恩格列净与安慰剂进行治疗,结果发现恩格列净能明显降低血糖,且研究结束时两组患者的GFR无明显差异[46]。此外,PTDM患者应用SGLT-2抑制剂确实存在泌尿系感染风险,该研究中恩格列净组中2例患者因反复尿路感染和尿脓毒症退出研究,而对照组中3例患者退出研究与泌尿系感染无关;该研究并未发现恩格列净与免疫抑制剂存在明显的药代动力学相互作用[46],这一结论同样在另一项回顾性研究中得到证实[47]。
4 免疫抑制剂在PTDM治疗中的应用
除了降糖药物外,PTDM患者不可避免地需要使用免疫抑制剂治疗,这些药物可能会影响血糖,而且其中多数会经过P450酶代谢,还可能与同样需要经过该酶代谢的其他降糖药物相互作用,进而影响疗效。目前常用的免疫抑制剂主要包括钙调神经蛋白抑制剂(calcineurin inhibitor,CNI)、西罗莫司靶蛋白(mammalian target of rapamycin,mTOR)抑制剂和糖皮质激素等。
4.1CNI 他克莫司和环孢素是移植术后常用的CNI类免疫抑制剂。由于钙调神经蛋白/活化T细胞核因子通路能促进胰岛β细胞的生长并提高其功能[48], 因此使用CNI不可避免地会导致血糖升高。近年来一些研究者开始关注移植后使用他克莫司对血糖的影响,发现可通过减少其使用剂量或者改换为环孢素来减轻血糖升高[18,49]。具体来讲,大剂量用他克莫司[0.2~0.4 mg/(kg·d)]比环孢素导致血糖升高的风险更高[50],而较低剂量的他克莫司维持量[0.1 mg/(kg·d)]仍可发挥良好的免疫抑制效果[51]。一项前瞻性随机对照试验的研究组处理措施为肾移植术后先使用他克莫司治疗6个月,然后再换为环孢素治疗6个月,对照组为持续使用他克莫司治疗12个月,结果发现对照组中10%的患者PTDM得到逆转,而研究组中34%的患者PTDM发生逆转[49]。
4.2mTOR抑制剂 既往研究表明,mTOR抑制剂也可能对血糖有影响,尤其是西罗莫司。Johnston等[52]对2万例肾移植患者连续研究8年,结果显示mTOR抑制剂西罗莫司不论是与CNI联用,还是与抗代谢药联用,都会增加PTDM的发生风险。随着临床使用经验的累积,mTOR抑制剂固定剂量逐渐被达到药物目标谷浓度的使用剂量所替代,研究人员试图减少西罗莫司剂量以期最大限度降低其带来的不良反应。在最近的大规模随机试验中发现,与他克莫司治疗组相比,西罗莫司(剂量较之前减少40%~60%[53])治疗组新发PTDM更少[54]。与西罗莫司不同,另一常用的mTOR抑制剂依维莫司对血糖影响较小。研究表明,依维莫司不论高剂量(3.0 mg/d)还是低剂量(1.5 mg/d)对血糖的影响都不大[55-56]。一项针对心脏移植患者的干预性研究发现,使用依维莫司干预3年后需要胰岛素治疗的人数与基线时比较无明显差异,进一步与持续接受CNI治疗的患者相比,依维莫司可使需要接受胰岛素治疗的人数明显减少[57]。总之,以谷浓度为目标的西罗莫司最小使用剂量,以及采用依维莫司替代CNI或许是控制移植后高血糖的重要途径。
4.3糖皮质激素 糖皮质激素可以拮抗胰岛素的作用,使血糖升高,因此一般认为完全停用糖皮质激素可能会预防糖尿病的发生,但有随机对照试验研究发现停用糖皮质激素并未能预防肾移植患者PTDM的发生[58-59]。在发生急性排斥风险低的患者中,与持续低剂量使用激素(5 mg/d泼尼松)相比,早期(术后7 d内)停用糖皮质激素未能减少PTDM的发生,但血糖控制更好且使用胰岛素剂量更少[59]。进一步研究发现,对接受肾移植后的PTDM患者使用20 mg/d泼尼松,采用分次给药的方法能降低全天的血糖峰值及血糖变异性[60]。因此,早期停用糖皮质激素虽然不能预防PTDM的发生,但能更好地控制血糖;在必须使用糖皮质激素的情况下,可予以分次给药,以减轻血糖负荷;长期使用者,宜选择较低适合剂量维持,以尽可能减少对血糖的 影响。
综上所述,对移植后早期的高血糖主要给予胰岛素治疗,二甲双胍、噻唑烷二酮类、磺脲类药物(格列喹酮)、格列奈类、DPP-4抑制剂(西格列汀和维格列汀)、GLP-1受体激动剂(利拉鲁肽)和SGLT-2抑制剂(恩格列净)均不同程度地显示出对PTDM治疗的有效性和安全性。但是目前证实口服降糖药或强化胰岛素治疗对PTDM长期保护作用的证据非常有限。一项关于胰岛素和SGLT-2抑制剂恩格列净长期(1年以上)治疗PTDM的研究(项目名称:EMPTRA-DM,临床试验注册号:NCT03113110)正在进行中[61]。另一方面,合理选择免疫抑制剂的类型、剂量以及给药方式或频率有利于PTDM的转归。
未来关于PTDM的治疗还需要解决几个主要问题:①基于目前相关研究纳入背景,建议进一步通过增加受试者人数和延长观察时间来明确降糖药物在PTDM中的安全性,特别是其对肾功能和心血管系统的影响;②不同类型的器官移植PTDM患者的个体化降糖方案值得进一步探讨;③针对患有PTDM的高危患者应寻求更优的免疫抑制方案。随着这些问题的解决,应该可以减少PTDM的发生及由PTDM带来的不良结局。

