降钙素原联合中性粒细胞/淋巴细胞比值在不同类型血流感染中的应用价值*
刘 洋,曹慧玲,赵苏瑛,李 岷,程迎迎,李鹏飞
(南京中医药大学附属医院/江苏省中医院检验科,江苏南京 210029)
血流感染(BSI)是一种严重的感染性疾病,细菌侵入血流,引起严重感染,尤其在临床重症监护病房(ICU)最为显著,BSI是这些危重患者住院期间死亡的主要原因之一[1]。ICU患者院内获得性BSI的发生率为1%[2],骨髓移植患者BSI的发生率可达到36%[3]。美国的一项调查显示,大约10%的院内获得性感染为BSI,与院内获得性感染相关的死亡事件中,院内获得性BSI是仅次于院内获得性肺炎的死亡原因[4]。因此,及时诊断BSI并掌握BSI的基本情况,对指导医生用药意义重大。目前,细菌培养是诊断细菌性BSI的“金标准”,但由于患者病情危急,而细菌培养存在采样复杂、诊断时间长、阳性率低和有一定污染率等缺陷,使得该方法在及时、准确判断患者病情上存在困难[5]。
近来研究发现,血中降钙素原(PCT)、C-反应蛋白(CRP)等在BSI所致脓毒症的早期诊断中可以作为预警和预后判断的炎性指标,有一定的临床指导意义[6-7]。BSI患者通常存在免疫力低下,淋巴细胞大量凋亡,进一步引起免疫系统紊乱的情况,故淋巴细胞水平与患者病情严重程度及预后密切相关[8]。同时,BSI造成外周血白细胞亚群计数,尤其是中性粒细胞的增加和淋巴细胞的减少,故中性粒细胞/淋巴细胞比值(NLR)也可以作为反映炎症状态的指标[9]。本研究探讨PCT及NLR对不同类型BSI的预测和鉴别诊断作用。
1 资料与方法
1.1一般资料 选取2017年8月至2018年8月本院收治的251例血培养阳性成年患者作为研究对象,将其分为血培养污染组和BSI组,以血培养双份标本培养呈阳性作为“金标准”,BSI实验室诊断符合美国疾病控制与预防中心1996年BSI诊断标准[10],血培养污染判断以专家共识为标准[11]。具体临床资料见表1。研究经本院伦理委员会批准进行,所有治疗和检查均获得患者或家属的知情同意。

表1 BSI组和血培养污染组一般临床资料比较
1.2研究对象纳入和排除标准
1.2.1纳入标准 (1)临床及微生物学明确诊断为BSI,临床标准为体温>38 ℃或<36 ℃,可伴有寒战并合并下列条件之一:有入侵门户或迁徙病灶;有全身中毒症状而无明显感染灶;有皮疹、出血点,伴有肝脾淋巴结肿大,血液中性粒细胞核左移,且无其他原因可解释;收缩压<90 mm Hg或较之前下降40 mm Hg。(2)年龄≥18岁。(3)住院治疗的病史资料齐全。
1.2.2排除标准 (1)年龄<18岁,入院时间<24 h;(2)患有其他血液系统恶性疾病;(3)患有肝脏、肾脏、心脏及肿瘤等严重性疾病;(4)合并其他慢性感染;(5)BSI分离出一种以上的致病菌。
1.3方法
1.3.1常规检测 血常规采用DXH Coutler全自动血细胞分析仪检测(美国贝克曼库尔特公司)。CRP采用芬兰Orion Diagnostica公司生产的QuickRead CRP检测系统测定,所用试剂均为仪器配套试剂。PCT采用南京基蛋生物科技有限公司Getein1100荧光免疫定量分析仪及其配套试剂盒测定。
1.3.2血培养 患者出现体温>38.5 ℃且根据临床表现怀疑BSI者,根据标准操作规程进行采集,于江苏省中医院检验科细菌室培养,查看培养阳性者细菌生长曲线,镜检阳性,接种培养18~24 h,挑取菌落,利用BioMerieux VITEK 2 Compact全自动细菌鉴定仪分析。所选取患者的PCT、血常规送检时间以及血培养送检时间相差不超过24 h,若同一患者的送检时间间隔超过7 d,将每次的PCT与血培养检测结果录入统计;若同一患者7 d内有两次以上的送检结果,只统计第1次的检测结果。
1.3.3分组 根据细菌的生理结构不同可分为革兰阳性菌(G+)和革兰阴性菌(G-),临床对G+与G-的治疗有着很大区别。BSI以金黄色葡萄球菌(SA)、G-多见,而凝固酶阴性葡萄球菌(CNS)导致的BSI由于介入治疗手段的成熟也呈上升趋势,这样与皮肤定植菌造成的血培养污染的鉴定就显得尤为重要。因此,本文初步将血培养阳性者分为BSI组和血培养污染组。进一步,根据BSI组血培养结果不同分为SA组、G-组、CNS组。其中CNS诊断标准[12]为至少含有两项全身炎症反应综合征(SIRS)的指征,且符合下列情况之一:(1)两次或以上血培养CNS阳性;(2)血培养阳性时间<15 h;(3)不同部位血培养同时阳性且均为CNS;(4)分离CNS耐药谱及基因型一致;(5)排除导管内定植菌。
1.3.4PCT、NLR及其联合诊断对不同类型BSI的诊断价值 根据血常规结果计算NLR, 分别绘制PCT、NLR单项及两项联合检测的受试者工作特征(ROC)曲线,以评价上述指标对鉴定不同BSI的辅助诊断价值。
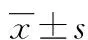
2 结 果
2.1临床资料总体特征 符合纳入标准的BSI组患者200例,其中男122例,女78例;血培养污染组患者51例,其中男31例,女20例。见表1。
2.2不同组白细胞计数(WBC)、中性粒细胞百分比(NEU%)、淋巴细胞百分比(Lym%)、CRP、NLR、PCT的比较 WBC、NEU%、CRP、NLR、Lym%和PCT在血培养污染组和BSI组间差异有统计学意义(P<0.01),见表2。按照分组,对血培养污染组、SA组、CNS组、G-组两两比较,结果显示,WBC仅在G-组与血培养污染组间差异有统计学意义(P<0.05),NEU%在G-组与血培养污染组、SA组与血培养污染组、CNS组与血培养污染组之间差异均有统计学意义(P<0.05),NLR在G-组与血培养污染组、SA组与血培养污染组、CNS组与血培养污染组、G-组与CNS组、SA组与CNS组间差异均有统计学意义(P<0.05)。CRP在G-组与血培养污染组、SA组与血培养污染组、CNS组与血培养污染组以及G-组与CNS组之间差异均有统计学意义(P<0.05)。PCT在G-组与血培养污染组、SA组与血培养污染组、CNS组与血培养污染组间差异均有统计学意义(P<0.05)。见表3。

表2 血培养污染组、BSI组相关指标比较

表3 不同BSI分组间相关指标的比较
注:与血培养污染组比较,aP<0.05;与血培养污染组比较,bP<0.05;与血培养污染组比较,cP<0.05;与CNS组比较,dP<0.05;与CNS组比较,eP<0.05。
2.3PCT、NLR以及两者联合检测对不同类型BSI的诊断价值 研究发现,PCT鉴别BSI与血培养污染、G-与血培养污染、SA与血培养污染、CNS与血培养污染、G-与SA的AUC分别为0.895、0.951、0.877、0.919、0.680,具有诊断价值(P<0.05),但对鉴别G-与CNS、SA与CNS无诊断价值(P>0.05)。NLR鉴别BSI与血培养污染、G-与血培养污染、SA与血培养污染、CNS与血培养污染的AUC分别为0.922、0.934、0.929、0.856,具有诊断价值(P<0.05),但对鉴别G-与SA、G-与CNS、SA与CNS无诊断价值(P>0.05)。PCT+NLR联合检测用于鉴别BSI与血培养污染、G-与血培养污染、SA与血培养污染、CNS与血培养污染、G-与SA的AUC分别为0.946、0.950、0.947、0.856、0.664,具有诊断价值(P<0.05),但联合检测对鉴别G-与CNS、SA与CNS无诊断价值(P>0.05)。见表4、5,图1~5。

表4 PCT、NLR对血培养污染组和不同BSI组的诊断价值
注:-表示此项用于鉴别诊断无意义(P>0.05)。

表5 PCT与NLR联合检测对血培养污染组和不同BSI组的诊断价值

图1 PCT、NLR及两者联合检测用于鉴别BSI与血培养污染的ROC曲线图

图2 PCT、NLR及两者联合检测用于鉴别G-与血培养污染的ROC曲线图

图3 PCT、NLR及两者联合检测用于鉴别SA与血培养污染的ROC曲线图

图4 PCT、NLR及两者联合检测用于鉴别CNS与血培养污染的ROC曲线图

图5 PCT、NLR及两者联合检测用于鉴别G-与SA的ROC曲线图
3 讨 论
本研究中,血培养阳性标本主要来源于高龄患者,此类患者基础疾病复杂、免疫力低下,极易引起BSI,继而引起脓毒血症及其他严重并发症,导致患者死亡。据国外有关文献报道,BSI的发生率在1986年仅为1.6%,而在20年之后便增加到3.1%,病死率为21%~48%[13]。血培养作为诊断BSI的“金标准”已被临床作为诊断疾病和监测病情的重要手段[14],但其耗时长,操作复杂,有一定的污染率,并且时效性并不理想,往往给临床诊断及鉴别诊断带来一定困难。故早期诊断BSI的病原菌类型和评估其疾病的严重程度非常必要。
NLR指外周血中性粒细胞数与淋巴细胞数之比,该指标的研究始于20世纪90年代,IETONI[15]观察到一些恶性肿瘤发生扩散时外周血WBC中发生NEU%升高的现象,曾提出NLR与癌症患者疾病发展及预后的相关推断。2004年,WYLLIE等[16]研究发现,BSI患者的淋巴细胞明显减少,其原因是在细菌刺激下T细胞出现大量凋亡,使机体免疫功能下降,增加耐药菌感染的概率,进而出现多器官功能障碍综合征(MODS),甚至死亡。
近年来研究发现,血中PCT、CRP等在脓毒症的早期诊断中可作为预警和预后判断的炎症指标,有一定临床意义。VAN NIEUWKOOP等[17]的研究报告同样指出,PCT在诊断BSI时AUC为0.73,最佳截断值为0.5 μg/L时对BSI最具诊断价值,其阳性预测值为41.0%,阴性预测值为93.0%。国内张有江等[18]研究指出血浆PCT诊断BSI的AUC为0.801,最佳截断值为0.7 μg/L时的阳性预测值为41.0%,阴性预测值为95.4%。本文研究发现,血浆PCT诊断BSI的最佳截断值为0.620 μg/L,AUC为0.895,与前文报道一致。
目前,国内研究报道NLR及PCT等指标可以用于早期预测BSI[19],但将PCT、NLR等指标联合检测并用于鉴别不同类型BSI的研究较少,因此本研究将不同指标联合用于诊断BSI,并评价了PCT、NLR及联合检测用于诊断BSI和鉴别不同类型BSI的价值。
本文研究发现,针对不同类型的BSI,PCT和NLR均表现出一定的应用价值。在鉴别BSI与血培养污染、G-与血培养污染、CNS与血培养污染、SA与血培养污染时,PCT、NLR都表现出了较好的诊断效能,灵敏度和特异度均较高,但PCT的灵敏度要高于NLR,而NLR的特异度要高于PCT。将两者联合检测,AUC值、灵敏度和特异度都有不同程度地提升,表现出更好的诊断能力。
在鉴别SA与G-时,仅PCT表现出了诊断价值,其AUC、最佳截断值、灵敏度、特异度分别为0.680、7.370 μg/L、47.6%、92.6%;NLR无诊断价值(P>0.05);联合检测的AUC、灵敏度、特异度为0.664、54.8%、89.9%。表明PCT在鉴别G-与SA时,较NLR具有更高的诊断效能,并与联合检测比较,AUC值和灵敏度更高。
在鉴别G-与血培养污染时,PCT的灵敏度、特异度及约登指数均较NLR及联合检测更高,且PCT的AUC值略大于联合检测的AUC值,这表明PCT在鉴别G-导致的BSI更具优势。有学者给内毒素休克鼠体内输注PCT,发现其存活率降低,死亡率升高,提示PCT是内毒素休克时的有害介质[20-21],表明PCT水平与G-感染有密切联系。而本研究结果同样证实,G-感染的刺激是诱发患者机体PCT水平升高的一个重要原因。而顾敏等[22]研究亦发现,G-感染组血浆PCT水平明显高于G+感染组,当最佳截断值为5.611 μg/L时,其灵敏度为73.70%,特异度为81.80%,故认为血中PCT水平的高低有助于区分是G-杆菌还是G+球菌感染,可为临床及时使用不同类型的抗菌药物提供支持。
血中PCT、NLR等炎症指标检测便捷,可弥补血培养时效性差、易污染的不足,然而这些指标在血中水平的高低并不能反映BSI的病原菌,在如何选择抗菌药物时,血培养检测及药敏试验的价值是毋庸置疑的。故将血中一些炎症指标定量检测与血培养动态检测结合,可以极大地提高对细菌性BSI患者临床诊断的正确性,鉴别污染菌导致的假阳性,同时可以缩短其诊断时间,提高诊断效率,为早期的经验用药提供帮助,降低病死率。
检测上述炎症因子等指标在早期检测BSI中具有速度快、操作简便、高灵敏度、高特异度的优点,尤其是连续观测脓毒症患者血中PCT、NLR等指标,还可预测不同类型的BSI及鉴别是否存在由于操作不规范等原因造成的定植菌污染的情况,为指导抗菌药物的使用提供了重要的实验支持。因此,联合检测可能是最有价值的检测方法,有望早期应用于细菌性BSI患者的临床诊断。在今后的研究中,笔者希望对不同类型BSI患者血中不同炎症因子体内水平的差异在诊断方面的意义进行更深入而细致的探索。
4 结 论
综上所述,PCT、NLR能够较好地预测BSI,与BSI有着较好的相关性,可以作为早期预测BSI的指标。同时,本研究发现,PCT、NLR对鉴别不同类型的BSI有着一定价值,可以为临床提供早期的用药指导。而两者联合诊断,能够不同程度地提高不同类型BSI的诊断效率,为临床诊断治疗BSI提供新的思路。

