囊性包虫病患者外周血PD-1在Treg细胞上的表达与Foxp3、TGF-β和IL-10的相关性研究
赵 慧,张峰波,朱玥洁,庞楠楠,安梦婷,李 斌,马秀敏,丁剑冰,
细粒棘球蚴病又称囊性包虫病(cystic echinococcosis,CE),是由细粒棘球绦虫所致的最为常见的人兽共患病,是新疆、青海、西藏等农牧地区的高发疾病[1]。虽大部分CE患者可通过手术和药物进行治疗,但依旧存在术后复发、药物耐受和部分不良反应等问题,治疗效果不理想[2-5]。共刺激分子程序性死亡受体 1(programmed death 1,PD-1)是近年发现的免疫抑制分子,因在免疫耐受中发挥重要作用而被人们逐渐重视[6]。研究发现PD-1参与抑制调节T细胞、NK细胞和树突状细胞等多种免疫细胞的功能,且在肿瘤和病毒感染等疾病中通过抑制效应细胞发挥作用,从而促进疾病的发展[7-9]。调节性T细胞(regulatory T cell,Treg或Tr)是一群能识别靶细胞MHC分子所提呈的TCR-抗原肽,并发挥一定免疫抑制功能的T细胞。通过抑制效应T细胞的活化增殖达到机体的免疫耐受和预防自身免疫性疾病的作用。这类细胞以表达Foxp3、CD25、CD4为细胞表型特征,通过分泌具有抑制作用的细胞因子TGF-β和IL-10发挥其功能[10-13]。在过去20年内,研究已经证实了Treg细胞在感染、肿瘤、器官移植、同种异体胎儿免疫相关疾病方面具有抑制各种途径的病理生理免疫应答的作用[14]。然而,Treg细胞的抑制作用也同时促进了感染、肿瘤等疾病的发生发展[15]。
本研究欲采用流式细胞术(FCM)检测CE患者外周血中Treg细胞上PD-1的表达,通过荧光定量RT-PCR(QRT-PCR)法检测CE患者外周血单个核细胞(PBMCs)中PD-1 mRNA和Treg细胞转录因子Foxp3 mRNA的表达,用ELISA法检测CE患者血清中Treg细胞相关细胞因子TGF-β和IL-10的水平,进一步探讨负性共刺激分子PD-1与Treg细胞在该疾病中的关系和作用。
1 材料与方法
1.1研究对象 本研究涉及的所有实验内容均征得CE患者和对照人群的知情同意,研究已通过新疆医科大学第一附属医院伦理学委员会批准。研究对象由CE患者和对照人群组成。CE患者30例,为2017年1月至2017年12月在新疆医科大学第一附属医院消化血管外科中心肝胆包虫外科住院的确诊患者(根据B超分型,均为活动性CE1-CE3患者),其中男性18例,女性12例,平均年龄44±13.42岁。CE患者经临床表现及体征、免疫学检查、B超和CT检查进行确诊,所有患者均为初次手术,且无慢性感染病、先天性肝囊肿、胆囊积液等其他肝胆系统疾病;对照组30例为体检人群,其中男性16例,女性14例,平均年龄41±10.21岁,均排除慢性感染、右侧肾盂积水、细菌性肝脓肿、先天性肝囊肿、胆囊积液、先天性胆总管囊型扩张症等肝胆系统疾病及其他重大疾病。
1.1.1标本采集 30例CE患者和30例对照人群均空腹8 h后采集EDTA抗凝血5 mL和不抗凝血3 mL。EDTA抗凝血为FCM检测和QRT-PCR检测用。不抗凝血经3 000 r/min 离心5 min(德国eppendorf -5415R),吸取血清于EP管中,-20 ℃冻存待ELISA检测用。
1.2 方 法
1.2.1FCM法检测外周血PD-1+CD4+CD25+Treg细胞的百分比 将30例CE患者和30例对照人群的外周血放置于流式管中,裂解红细胞,制备单细胞悬液,用台盼蓝染色计活细胞数>95%,分别加入流式抗体(美国BD公司)CD3-APC 2 μL、CD4-Percp 2 μL、PD-1-PE 2 μL、CD25-Pecy7 2 μL,室温避光孵育20 min后,用磷酸盐缓冲液(PBS)洗涤2次,用PBS重悬细胞,调整细胞数为2×106/mL,用流式细胞仪(德国美天旎生物技术有限公司)检测。
1.2.2QRT-RCP法检测外周血PBMCs中PD-1 mRNA和Foxp3 mRNA的含量。
1.2.2.1设计引物 从GenBank获取人PD-1和Foxp3基因全序列,用VectorNTIsulte7.0软件包对获取的人的各基因序列进行比对分析,选取相对保守、同源性高的区域应用Primer5.0进行引物设计,以β-actin作内参照(表1)。

表1 PD-1、Foxp3和β-actin基因引物序列Tab.1 Gene primers sequence of PD-1、Foxp3and β-actin
1.2.2.2人全血DNA的提取 所有用品均严格按消除RNase的常规方法处理,玻璃及金属器皿在250 ℃烘烤4 h,塑料器皿用DEPC溶液浸泡24 h,高压灭活DEPC后烤干备用。采集CE患者和对照人群外周血,分离外周血PBMCs并保存于液氮中作进一步分析。用Trizol-LS试剂(Invitrogen,Life Technologies,美国)从PBMCs中提取总RNA,用M-MLV逆转录酶(Invitrogen,Carlsbad,CA,美国)反转录成cDNA。提取的cDNA用Smartspec3000型紫外分光光度计测定浓度和纯度。
1.2.2.3目的基因检测 采用SYBR-GREEN-PCR预混料(中国大连TaKaRa生物技术有限公司)按照制造商的方案进行QRT-PCR(美国BIO-RAD公司)。扩增目的基因和内参基因β-actin。反应条件:50 ℃ 2 min(UDG孵育),95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环。用2-ΔCt对靶基因进行Ct值量化。重复实验至少3次。
1.2.3ELISA法检测血清中TGF-β和IL-10的水平 检测CE患者和对照人群血清中TGF-β和IL-10的水平。检测按照ELISA试剂盒说明书进行操作,酶标仪(美国BIO-RAD公司)450 nm处读吸光度(OD)值,根据标准曲线计算浓度。

2 结 果
2.1CE患者和对照人群中PD-1+CD4+CD25+Treg细胞的表达 通过流式细胞术检测CE患者和对照人群中PD-1+CD4+CD25+Treg细胞的表达分别为(34.03±5.97)%和(12.82±3.92)%;与对照人群相比,CE患者PD-1+CD4+CD25+Treg细胞(P=0.000)的表达均增高(图1)。
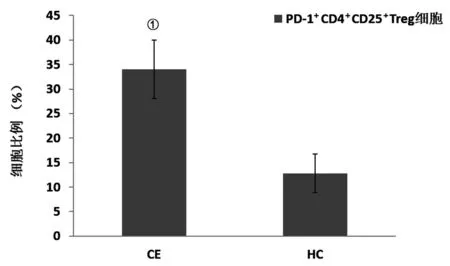
注:①P<0.001图1 外周血中PD-1+CD4+CD25+ Treg细胞的比例Fig.1 Ratio of PD-1+CD4+CD25+ Treg cells in peripheral blood
2.2CE患者和对照人群中PD-1和Foxp3 mRNA含量的表达 通过荧光定量PCR检测CE患者和对照人群中PD-1 mRNA含量的表达分别为4.79±0.95和1.03±0.4; Foxp3 mRNA含量的表达分别为17.92±2.66和8.36±2.29。与对照人群相比,CE患者中PD-1(t=18.35,P=0.000)和Foxp3 mRNA(t=14.89,P=0.000)含量均显著增高(P<0.01)(图2)。

注:①P<0.001图2 外周血单个核细胞中PD-1和Foxp3 mRNA含量的表达Fig.2 The mRNA expression of PD-1 and Foxp3in peripheral blood mononuclear cells
2.3CE患者和对照人群中TGF-β和IL-10水平的表达 通过ELISA法检测CE患者和对照人群血清中TGF-β水平的表达分别为15.10±2.35和9.76±1.53;IL-10水平的表达分别为19.81±3.36和10.02±2.31。与对照人群相比,CE患者TGF-β(t=10.43,P=0.046)和IL-10(t=13.13,P=0.000)水平的表达均增加(P<0.05)(图3)。

注:a)The levels of TGF-β in sera; b) The levels of IL-10 in sera图3 血清中TGF-β 和 IL-10水平的表达Fig.3 Levels of TGF-β and IL-10 in sera
2.4 相关性分析
2.4.1CE患者外周血中PD-1和Foxp3 mRNA含量的表达的相关性 通过Pearson法分析CE患者外周血中PD-1mRNA及Treg细胞转录因子Foxp3 mRNA表达的相关性发现,CE患者外周血PD-1 mRNA的表达均与Foxp3 mRNA表达水平呈正相关(r=0.602,P<0.01)(图4)。
2.4.2CE患者外周血中PD-1+CD4+CD25+Treg细胞与血清中TGF-β和IL-10水平的相关性 通过Pearson法分析CE患者外周血中PD-1+CD4+CD25+Treg细胞的表达及血清中TGF-β和IL-10的相关性发现,CE患者外周血中PD-1+CD4+CD25+Treg细胞与TGF-β(r=0.477,P<0.01)和 IL-10(r=0.825,P<0.01)的水平均呈正相关(图5)。
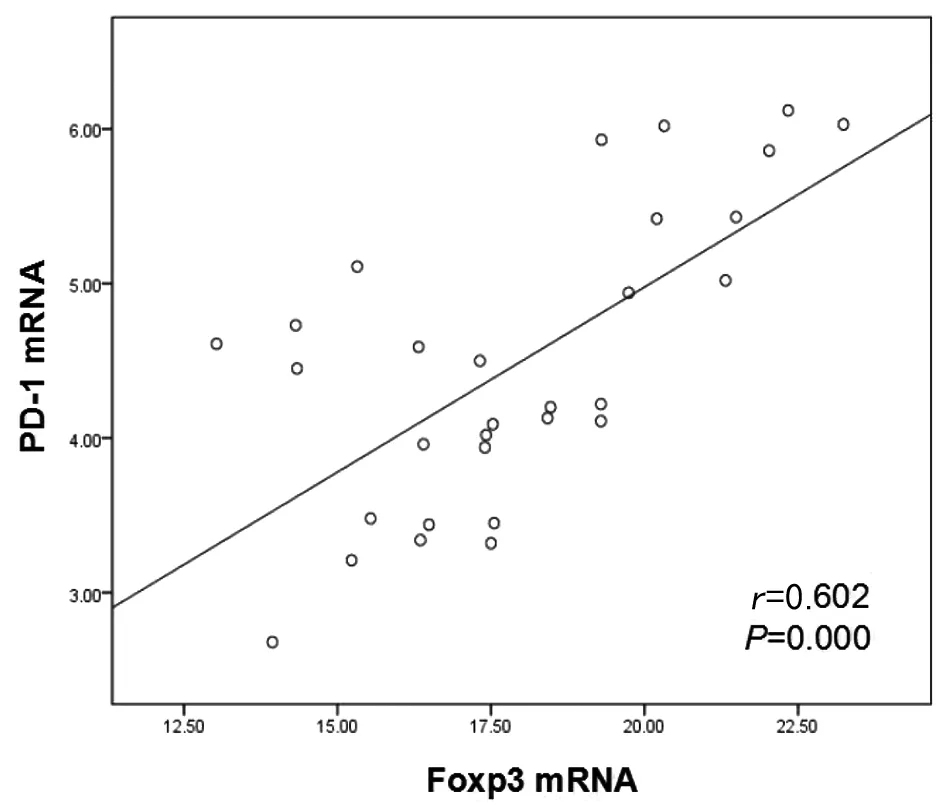
图4 PD-1 mRNA与Foxp3mRNA的相关性分析Fig.4 Correlation analysis of PD-1 mRNA and Foxp3 mRNA

注:a) The correlation analysis between PD-1+CD4+CD25+Treg cells and TGF-β; b) The correlation analysis between PD-1+CD4+CD25+Treg cells and IL-10图5 外周血中PD-1+CD4+CD25+Treg细胞和TGF-β、IL-10水平的表达的相关性Fig.5 Correlation analysis of PD-1+CD4+CD25+Treg cells and TGF-β、IL-10
3 讨 论
细粒棘球蚴感染会逐渐形成慢性感染,传统治疗方法如手术清除和药物治疗都难以有效根除感染。前期研究发现细粒棘球蚴病不断发展成为慢性化感染的一个主要原因是机体细胞免疫功能紊乱,导致免疫失衡现象明显,表现为机体不能有效清除病原体,且向有利于细粒棘球蚴感染的方向发展[16]。临床试验和动物实验结果均显示,人和小鼠感染棘球蚴后体内CD4+T细胞起到了主要免疫调节作用,不同辅助性T细胞亚群发挥了各自的功能。其中有以Th1和Th17细胞为主的抗感染免疫,也有以Th2细胞为主的抑制性免疫[17-19]。本研究结果显示,CD4+T细胞中一组重要亚群Treg细胞在细粒棘球蚴感染中也发挥了重要作用,且可能与负性共刺激分子PD-1的高表达相关。
目前普遍认为Treg细胞可通过分泌具有抑制作用的细胞因子TGF-β和IL-10发挥功能[20]。本研究结果显示在CE患者中,Treg细胞的转录因子Foxp3水平明显升高,同时相关细胞因子TGF-β和IL-10的水平也显著增高,这均说明在CE患者中Treg细胞发挥了作用。正常机体内Treg细胞的存在是为了抑制效应T细胞的活化增殖达到机体的免疫耐受和预防自身免疫性疾病的发生。一旦发生感染、肿瘤等疾病,机体会产生大量效应T细胞通过分泌炎性因子等对病原体进行清除[21]。与此同时,Treg细胞也会相应大量增殖,控制炎性因子等对机体的病理损害。然而这种关系一旦发生失衡,Treg细胞的抑制作用会不利于疾病的控制,并促进感染的发展[22]。因此,推测Treg细胞及其相关因子的免疫抑制作用使细粒棘球蚴发生免疫逃避,从而促进感染的持续性发展,甚至可能与术后感染复发和药物耐药有关。
另本研究发现CE患者外周血中PD-1在Treg细胞表面的表达显著增加。研究发现PD-1/ PD-L1通路可通过TGF-β诱导人外周血T淋巴细胞向Treg细胞分化,从而促进肿瘤的发生[23]。另PD-1的高表达与肿瘤浸润性Treg细胞的增加和效应T细胞的减少有关,阻断PD-1可有效增强抗肿瘤免疫[24]。本研究发现Treg细胞上PD-1的表达与其特异性转录因子Foxp3及相关细胞因子TGF-β和IL-10均呈正相关,由此考虑在CE患者中PD-1对Treg细胞的生成起诱导促进作用。推测其通过促进其转录因子Foxp3的表达,促进Treg细胞的增殖,从而促进TGF-β和IL-10的分泌。研究认为活化的Treg细胞表达PD-1,并且有可能通过PD-1/ PD-L1途径发挥效应机制。用PD-L1抗体封闭PD-1/ PD-L1通路可阻断Treg细胞的抑制功能,恢复效应T细胞的增殖[25]。因此CE患者中Treg细胞表面PD-1表达的增加提示负性共刺激分子PD-1与该疾病有关,且参与细粒棘球蚴感染中Treg细胞介导的抑制性免疫。另PD-1与其配体PD-L1结合后,可使效应T细胞功能受损[9,27],故推测PD-1可协同Treg细胞增强该疾病的免疫逃避作用,加重感染进程和慢性化的发展。
综合分析,本研究考虑CE患者中负性共刺激分子PD-1的表达与Treg细胞转录因子Foxp3和相关细胞因子TGF-β和IL-10相关。Treg细胞上PD-1的高表达会促进Treg细胞的生成及细胞因子TGF-β和IL-10的产生,且PD-1与Treg细胞共同参与细粒棘球蚴感染的免疫逃避过程,从而促进感染的持续性发展。其具体机制待进一步深入研究。机体免疫细胞种类繁多,作用机制复杂。因此,深入研究细粒棘球蚴感染的免疫机制,对进一步设计有效控制感染的免疫治疗方法至关重要。
利益冲突:无

