锌指抗病毒蛋白抑制HEV体内复制
纪汉斌,何秋霞,龚石林,王文静,龙飞燕,杨臣臣,禹文海,黄 芬
戊型肝炎病毒(Hepatitis E virus,HEV)属肝炎病毒科,正肝炎病毒属,是一种经肠道传播的病毒性肝炎病原体[1-2]。HEV是一种单股正链RNA病毒,基因组大小约为7.2 kb,包含3个开放式阅读框架(Open reading frames,ORFs)[3]。ORF1编码病毒复制相关的结构蛋白;ORF2编码病毒衣壳蛋白;ORF3与ORF2部分重叠,与病毒颗粒的释放有关。其5′非翻译区(UTR)被7-甲基鸟嘌呤覆盖,3′ UTR以多聚(A)尾巴结束[4]。HEV感染是世界范围内肝病发生的主要原因之一。据WHO报道,全球每年约有2 000万人感染HEV,约7万人死亡,其中东南亚地区HEV感染率和死亡率占全球的60.6%和64.7%[5]。近年来,我国戊型肝炎发病率持续上升,已成为戊型肝炎的高发国家[6]。
由于HEV缺乏有效的培养模型,目前HEV尚无有效的治疗药物。临床治疗主要采用利巴韦林(ribavirin,RBV)和聚乙二醇干扰素(pegylated interferon alpha,peg-IFN)。RBV在腺苷酸激酶作用下被磷酸化为5′-单磷酸利巴韦林(PRV)。PRV抑制次黄嘌呤磷酸脱氢酶(IMPDH),从而使宿主细胞内鸟嘌呤核苷酸的水平降低,进而发挥抗病毒作用[7]。此外,长期大剂量服用RBV极易导致患者产生贫血等副作用[8-10]。IFN-α是治疗慢性乙肝和丙肝的常用药,在天然免疫反应中发挥重要作用[11-12]。它能够通过激活干扰素诱导基因(interferon-stimulated gene, ISG)表达,抑制HEV复制[13-15]。但IFN-α治疗会使患者出现外周血白细胞和血小板减少等不良反应,增加肾脏移植接受者急性排斥反应风险[16-17]。目前,RBV和IFN-α联合使用在能在一定程度上治疗慢性戊型肝炎。然而,对于大部分患者联合用药的疗效有限,治疗周期长,毒性较大,其有效性和安全性仍有待研究[18]。
先天性免疫是机体防御病毒入侵的第1道防线。病毒入侵机体后可被细胞的模式识别受体(pattern-recognition receptors,PRRs)识别,刺激机体产生干扰素和白介素等物质,从而消灭病毒[19-24]。宿主限制因子有潜在的抗病毒活性,例如: Trim5α和APOBEC3G都会通过特定的方式在HIV复制阶段阻断HIV复制[25-26]。2002年高光侠等人发现了一种重要的宿主限制因子:锌指抗病毒蛋白(zinc finger antiviral protein,ZAP),ZAP参与天然免疫干扰素途径,是PRRs中的一员,能够识别并消除细胞质内的病毒RNA[27-28]。ZAP作为反式作用因子,直接作用于病毒RNA中的ZAP敏感元件(ZAP-responsive element, ZRE),利用细胞poly(A)特异性核酸酶(poly(A)-specific ribonuclease,PARN)切除病毒的poly(A)尾,从而利用RNA外切酶加工复合体exosome降解病毒RNA[27, 29-31]。ZAP还能利用辅因子RNA解螺旋酶p72招募细胞脱帽复合体Dcp1/2去除病毒5′帽子结构,从而利用5′外切酶XrnI降解病毒RNA[32]。这表明ZAP在病毒感染的先天防御中发挥着重要作用。
目前已经证实ZAP能够抑制逆转录病毒、丝状病毒、嗜肝DNA病毒和披膜病毒的复制[27, 33-35],但ZAP与HEV的关系尚不清楚。本实验经BALB/c小鼠尾静脉注射ZAP真核表达质粒,过表达ZAP后接种HEV,结果表明ZAP抑制HEV的复制,为HEV的预防与治疗提供新的方法和思路。
1 材料与方法
1.1细胞、毒株和质粒 基因Ⅳ型HEV(strain KM01,GenBank No.KJ155502)(1×104copies/mL)、18T-ZAP、pcDNA3.1-N1以及pcDNA3.1-ZAP均由昆明理工大学病毒感染与免疫实验室提供。
1.2主要试剂 限制性内切酶、T4 DNA连接酶、 MLV逆转录试剂、DNA marker DL15000 购自宝生物工程(大连)有限公司;DNA 聚合酶和 dNTP 购自天根生化科技(北京)有限公司;Trizol购自美国 Invitrogen 公司;质粒小量快速提取试剂盒和 DNA 胶回收试剂盒购自北京庄盟生物技术有限公司; HEV ORF2抗体购自美国Millipore公司(MAB8003); ZAP多克隆抗体购自美国 Proteintech 公司;HRP 标记的山羊抗兔和山羊抗小鼠的 IgG购自北京天德悦公司。
1.3引物设计及合成 根据GenBank中ZAP的基因序列(GenBank No.BC025308),经Oligo软件分析设计引物,序列如下,上游5′-CGGATCCG atggcggacccggaggtgtgc,下游5′-CAAGCTTG gtaga-gtttactgagcagttc,扩增片段大小约为2 740 bp,引物由上海捷瑞生物工程有限公司合成。
1.4RT-PCR扩增ZAP片段 以5 μL 的18T-ZAP为模板,RT-PCR扩增ZAP基因,PCR扩增条件为:94 ℃ 3 min,94 ℃ 30 s;50 ℃ 30 s;72 ℃ 3 min 共35个循环,72 ℃ 10 min。扩增产物用1%琼脂糖凝胶电泳鉴定,用DNA胶回收试剂盒进行片段回收,得到扩增的ZAP片段。
1.5真核表达质粒pcDNA3.1-ZAP的构建 将pcDNA3.1载体和ZAP的RT-PCR 产物分别经BamH I和Hind III双酶切,胶回收载体和目的基因,以T4 DNA 连接酶16 ℃连接过夜,反应体系如下:pcDNA3.1载体骨架(200 ng/μL) 5 μL,目的片段(100 ng/μL)12 μL,10× T4 DNA Ligase Buffer 2 μL,total 20 μL。利用大肠杆菌DH5α感受态细胞转化,筛选阳性克隆,提取质粒。质粒用BamH I和Hind III双酶切鉴定,并送至生工生物工程(上海)股份有限公司测序,测序正确的质粒命名为pcDNA3.1-ZAP。pcDNA3.1-ZAP示意图见图1。

图1 pcDNA3.1-ZAP载体图谱Fig.1 pcDNA-ZAP vector map
1.6ZAP抵抗HEV复制的体内实验 将BALB/c小鼠分为6组,共18只,每组3只。对其中4组(G1、G2、G3和G4)分别尾静脉注射不同浓度pcDNA3.1-ZAP质粒(20 ng、40 ng或60 ng)或pcDNA3.1-N1质粒(60 ng)。24 h后,对以上4组接种200 μL HEV病毒悬液。剩余两组分别设置为HEV单纯感染组G5(接种200 μL HEV病毒悬液)和正常对照组G6(Mock)。HEV感染24 h后,对各组小鼠进行安乐处死,采血并收集肝脏组织。
1.7HEV RNA的提取及RT-qPCR检测 取小鼠血清200 μL,利用 Trizol 试剂盒提取细胞总RNA,按照MLV逆转录试剂盒说明书进行逆转录合成cDNA。以cDNA为模板进行RT-qPCR检测,反应体系为:cDNA 2 μL、2× ChamQ SYBR Color qPCR Mix 5 μL及上下游引物各0.2 μL,ddH2O补齐至10 μL。反应条件为:95 ℃ 3 min,95 ℃ 10 s;60 ℃ 31 s共40循环。内参基因(GAPDH)用作对照。目的基因的差异表达倍数采取2-△△Ct法进行相对定量分析。
1.8免疫组化 将保存于4%多聚甲醛中的小鼠肝脏组织进行石蜡包埋、切片、脱蜡、脱水、乙醇复水和Tris-EDTA修复。3% H2O2室温孵育10 min;5%脱脂奶封闭30 min;HEV(ORF2一抗1∶200,4 ℃孵育过夜,鼠HRP二抗,1∶250,37 ℃孵育1 h)。ZAP(ZAP一抗1∶200, 4 ℃孵育过夜,兔HRP二抗,1∶250,37 ℃孵育1 h),DAB染色,苏木精染色8 min,1%盐酸乙醇分化8 s,0.5%氨水反蓝8 s,脱水,中性树胶封片后显微镜下观察。
1.9统计分析 使用Image-Pro Plus 6.0 (IPP) 软件进行积分光密度分析。采用GraphPad Prism 5.01软件进行统计分析。采用Student-t检验分析两组间的差异。P<0.05为差异有统计学意义。
2 结 果
2.1ZAP片段的扩增 以18T-ZAP为模板进行RT-PCR体外扩增,将扩增产物经1%琼脂糖凝胶电泳分析,在2 740 bp左右出现特异性条带。结果表明,ZAP目的片段扩增成功,见图2。
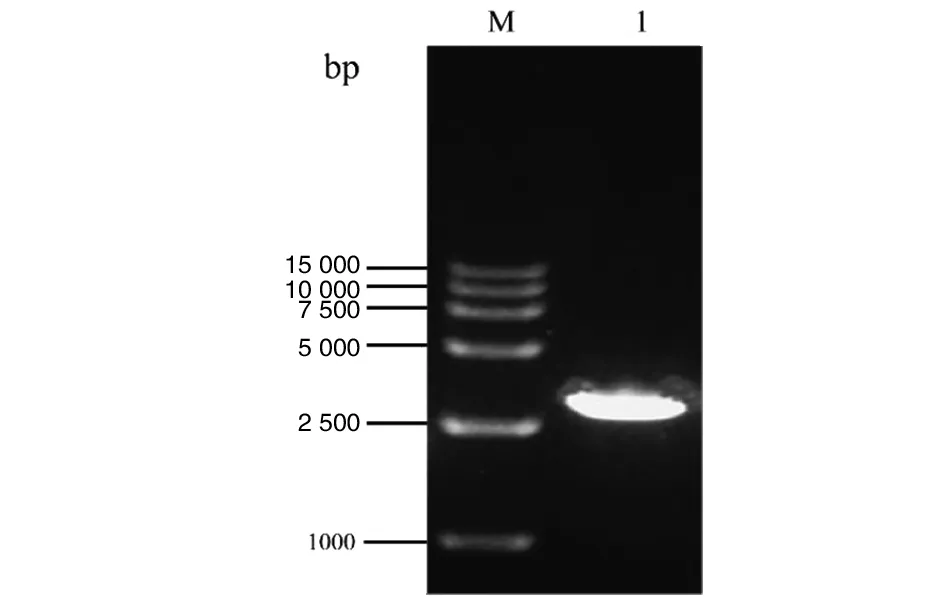
M为15000 marker;1为PCR扩增ZAP目的片段图2 RT-PCR扩增ZAP目的片段Fig.2 RT-PCR products of ZAP target fragment
2.2真核表达质粒pcDNA3.1-ZAP的构建及鉴定 将ZAP目的片段进行胶回收,经连接转化后挑选阳性菌落,扩大培养后提取质粒。琼脂糖凝胶电泳鉴定结果显示质粒提取成功。将真核表达质粒pcDNA3.1-ZAP采用BamH I和Hind III双酶切鉴定,可见2 740 bp的目的片段,与预期结果一致,见图3。
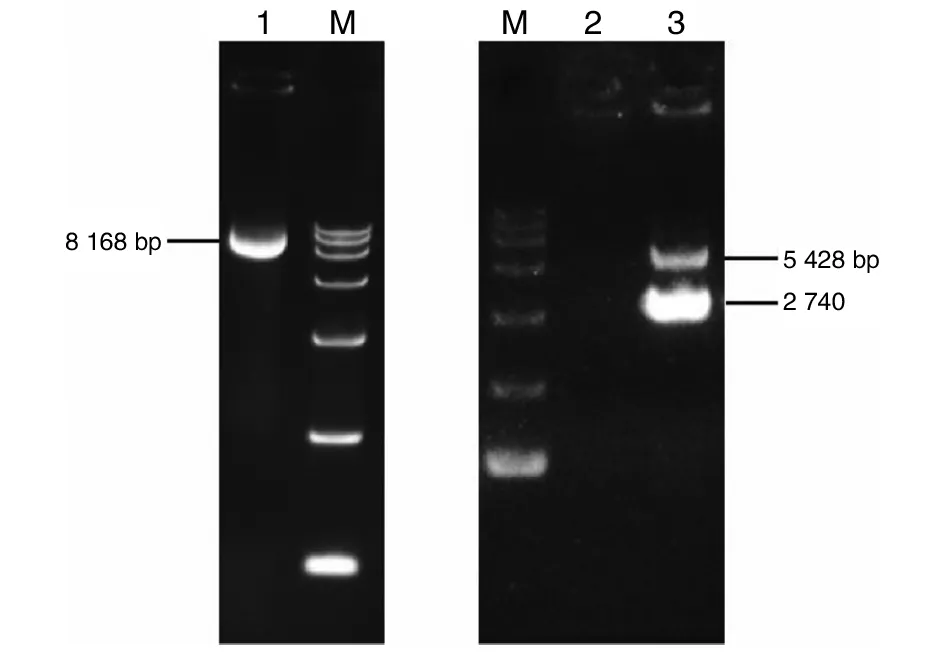
M为15000 marker;1为未酶切pcDNA3.1-ZAP质粒;2为空白对照;3为pcDNA3.1-ZAP质粒双酶切产物图3 真核表达质粒双酶切产物的鉴定Fig.3 Identification of pcDNA3.1-ZAP eukaryotic expression vector
2.3ZAP在BALB/c小鼠体内成功过表达 为了验证BALB/c小鼠注射pcDNA3.1-ZAP质粒后体内ZAP能否成功过表达,通过免疫组化检测小鼠肝脏组织中ZAP的表达,并进行积分光密度分析。结果表明,与正常对照组 G6相比,注射pcDNA3.1-ZAP后小鼠肝脏中ZAP表达升高5.8倍(t=29.47,P=0.001 1<0.05),表明ZAP过表达成功,见图4和图5。
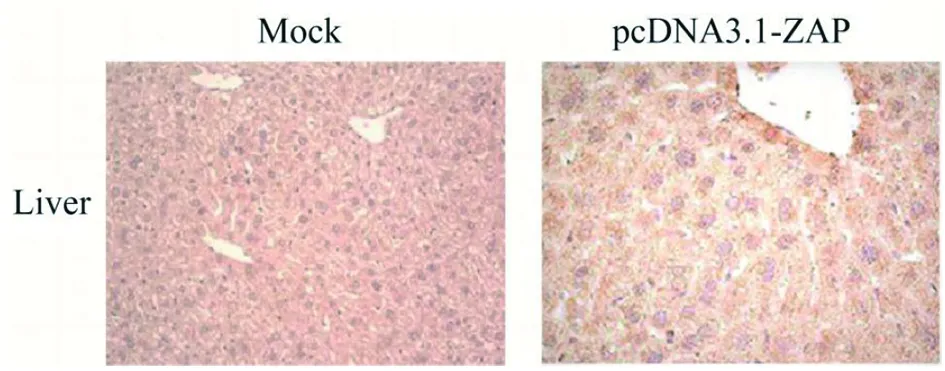
图4 免疫组化检测ZAP的变化Fig.4 Detection of ZAP by Immunohistochemical

图5 积分光密度分析ZAP表达的变化Fig.5 Change of ZAP expression by Integral Optical Density Analysis
2.4ZAP抑制BALB/c小鼠体内HEV复制 为了探究ZAP对HEV复制的影响,我们对BALB/c小鼠注射pcDNA3.1-ZAP质粒,24 h后接种HEV,感染后24 h对小鼠肝脏进行免疫组化检测及积分光密度分析。结果显示,与HEV单纯感染组G5相比,小鼠体内过表达ZAP后肝脏中HEV阳性颗粒数降低82%(t=23.44,P=0.001 8<0.05),见图6和图7,说明ZAP能够抑制体内HEV的复制。
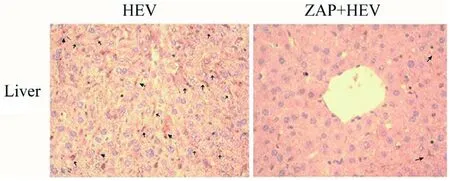
图6 免疫组化检测HEV的变化Fig.6 Detection of HEV by Immunohistochemical

图7 积分光密度分析HEV表达的变化Fig.7 Change of HEV expression by Integral Optical Density Analysis
为进一步验证ZAP对HEV复制的影响,我们对BALB/c小鼠分别注射不同浓度的pcDNA3.1-ZAP质粒,24 h后接种HEV,感染后24 h对小鼠血清中HEV进行定量分析。结果表明,与单纯注射HEV和注射了pcDNA3.1-N1的小鼠相比,注射pcDNA3.1-ZAP的小鼠能够抑制HEV在血液中的复制,见图8。且随着ZAP浓度增加,HEV在血液中的拷贝逐渐降低,说明ZAP对HEV的抑制效果与剂量相关。
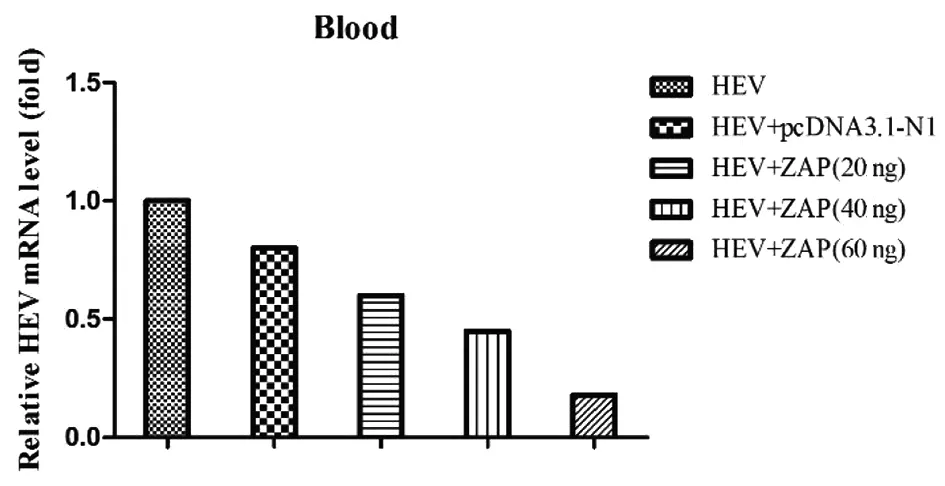
图8 RT-qPCR检测HEV的变化Fig.8 Detection of HEV by RT-qPCR
3 讨 论
HEV是全球肠道传播病毒性肝炎的主要病因。本研究证明了ZAP在体内具有抗HEV的作用。ZAP最初是作为表达抗莫洛尼氏鼠白血病病毒(Moloney Murine Leukemia Virus,MMLV)复制蛋白而分离出来的,包含4种CCCH型锌指结构,与负调控RNA稳定性的RNA结合蛋白功能相似[36-37]。ZAP可能直接与病毒RNA相互作用,影响其稳定性。ZAP还可能通过影响蛋白-蛋白或核酸-蛋白相互作用,进而影响病毒复制。
ZAP的抗病毒活性部分取决于病毒基因组中ZREs的存在,其作为宿主抗病毒因子,可通过降解病毒mRNA或抑制病毒mRNA的翻译,从而抑制病毒在细胞质中的积累来阻止猕猴轮状病毒和委内瑞拉马脑炎病毒的复制,并能够通过靶向L基因序列抑制埃博拉病毒的复制活性。但ZAP不具备广谱抗病毒活性。它不能抑制黄热病病毒、泡状口炎病毒和单纯疱疹病毒1型。Stefanie 等人的研究表明,ZAP在细胞质中发挥作用,仅在细胞质中复制的RNA病毒会受ZAP影响[34-35]。而本研究结果表明,HEV作为胞质中复制的RNA病毒,其在小鼠体内的复制能被ZAP显著抑制。这可能也是通过抑制HEV的mRNA水平实现的。
与逆转录病毒、丝状病毒、嗜肝DNA病毒和披膜病毒不同的是,HEV很难在体外成功培养,致使抗戊型肝炎病毒药物的研制受阻。2011年,一种针对戊型肝炎病毒的重组基因疫苗(p239)在中国上市[38]。 但p239疫苗是针对基因1型HEV设计,但中国目前主要以基因4型为主,p239是否能达到有效的保护作用,还有待进一步的观察。 目前,尚无有效治疗HEV的药物。临床常用的RBV和IFN不适用于器官移植患者,会导致患者严重贫血和并发性肾功能损伤。并且RBV对胎儿有致畸性,且会导致大量HEV耐药株(G1634R突变株)产生[8-10, 40-41]。因此,RBV和IFN治疗范围有限,对慢性肝病及免疫力低下患者的长期疗效和安全性仍有待进一步临床确认。
ZAP作为一种天然宿主抗病毒蛋白,不仅易于表达,且能够靶向作用于病毒基因组,在转录和翻译水平抑制病毒复制,在天然免疫抗病毒过程中起到了至关重要的作用。本研究已证实ZAP能够有效抑制HEV在动物体内的复制,为今后实现ZAP有效治疗HEV提供了重要的前期基础。
综上所述,ZAP在机体抗HEV感染过程中发挥着重要作用。这表明ZAP可成为抗HEV药物开发的靶标,突出开发靶向作用HEV基因组药物的重要性。为有效治愈孕妇、免疫缺陷患者及其他脆弱人群提供可能,以及为进一步研究宿主与HEV相互作用机制提供实验基础及为筛选抗HEV新型药物提供新思路。
利益冲突:无

