应用Sniffin′嗅棒方法评价新疆维吾尔自治区阿尔茨海默病病人的嗅觉功能及其影响因素
阿尔茨海默病(Alzheimer′s disease, AD)是一种进行性神经退行性疾病,随着人口老龄化,其发病率呈逐年上升趋势。目前, 国内约有5 000 万痴呆和轻度认知障碍病人,给病人和家庭带来了沉重经济负担, 已成为重要公共卫生问题[1]。2016年痴呆症是全球第五大死因,痴呆导致的死亡占总死亡人数的4.4%(240万人死亡),但在70岁以上的人中占死亡人数的8.6%(220万人死亡)[2];在70岁年龄段,痴呆是除了缺血性心脏疾病外导致死亡的第二大原因。中国65岁以上人群,超过60%的痴呆症病人患有AD[1]。2018年报道的96项观察性研究的荟萃分析报告显示,中国60岁及以上人群的痴呆症总体患病率为5.30%[3]。越来越多的证据表明,老年痴呆症的危险因素、生活方式、其他干预措施如果得到有效实施,可能有助于延缓发病和减少未来痴呆症病人的人数[1-4]。尽早发现AD可能是预防,延缓疾病的关键,嗅觉是当今衰老和神经退行性疾病研究的关注焦点之一,嗅觉功能障碍是认知能力下降之前出现的最初症状之一,被认为是这些疾病早期的临床标志,是疾病进展和认知能力下降的标志。在认知正常的老年人中,气味识别降低与皮质淀粉样蛋白增加和内嗅皮质变薄相关[5]。关注嗅觉功能可能有助于提高神经保护和疾病缓解治疗策略的成功机会。本研究探讨嗅觉障碍与AD的相关性,进而为AD的早期诊断、治疗提供新的思路。
1 资料与方法
1.1 研究对象 收集2018年1月—2019年2月在新疆医科大学附属中医医院神经退行性疾病临床大数据库中的AD病人50例(AD组),男17例,女33例;年龄62~86(75.18±6.54)岁。选取与病例组相匹配的非AD病人或健康志愿者50名作为对照组,男20名,女30名;年龄54~89(73.02±8.11)岁。所有研究对象均需在知情同意书上签字,本研究通过新疆医科大学附属中医医院伦理委员会批准。
1.2 诊断标准 痴呆诊断标准采用美国精神病学会制定的精神障碍诊断和统计手册第4修订版标准(DSM-Ⅳ),且符合美国国立神经病、语言机能障碍和卒中研究所及AD和相关疾病协会(the National Institute of Neurological and Communicative Disorders and Strokeand the Alzheimer′s Disease and Related Disorders Association,NINCDS-ADRDA)制定的“很可能AD”诊断标准,CDR为1~2分。所有病人分别由神经内科两位医师根据上述诊断标准确诊为AD。嗅觉障碍(olfactory disturbance,OD)的诊断依据:年龄≥55岁,Sniffin′Sticks检测测试者嗅觉功能(即TDI测试)TDI<19.6。
1.3 排除标准 经头部核磁共振(MRI)及CT排除颅内感染、脑积水、脑血管疾病; 用哈金斯基缺血(HIS)量表评分排除血管性痴呆和混合型痴呆,排除CDR为3分的重度痴呆及无法配合嗅觉检查的痴呆病人;3周内出现急性呼吸道感染;慢性鼻炎和鼻窦炎,慢性阻塞性肺疾病;严重的头部外伤,鼻腔手术;长期或大量接触挥发性物质,如杀虫剂、除草剂、金属粉尘、酸雾、工业溶剂、清洁产品或锯末;吸烟和吸毒;其他影响嗅觉功能的神经精神疾病,如帕金森病、多发性硬化和癫痫。
1.4 研究方法 所有入选对象均于安静状态下,采用TDI测试观察者嗅觉功能,由嗅觉阈值(olfactory threshold,THR)、嗅觉辨别(odour discrimination,DIS)和识别能力(olfactory identification,ID)子试验组成。AD病人的入选均须通过颅脑MRI检查来完成。
1.5 统计学处理 组间计量资料比较选用t检验和Mann-WhitneyU检验;计数资料比较用χ2检验。通过单因素方差分析,CDR作为协变量,比较各组间嗅觉测试得分,采用LSD方法进行多重比较。进行受试者工作特征曲线(ROC)分析以估计嗅觉测试的能力,计算曲线下面积(AUC),以灵敏度和特异性评估测试的辨别能力。两变量间相关性分析,计量资料满足正态分布用Pearson相关分析,计量资料不满足正态分布、等级资料、计数资料使用Spearman相关分析。所有统计学检验均为双侧概率检验,检验水准以P<0.05为差异有统计学意义。
2 结 果
2.1 AD组与对照组基线资料比较 本研究对AD组与对照组和AD伴嗅觉障碍(AD-OD)组与AD不伴嗅觉障碍(AD-NOD)组一般资料比较差异均无统计学意义(P>0.05),具有可比性。AD-OD组与AD-NOD组相比简易精神状态检查量表(MMSE)评分和蒙特利尔认知评估量表(MoCA)评分较低,两组比较差异有统计学意义(P<0.05)。详见表1、表2。

表1 AD组与对照组临床资料比较

表2 AD-OD组与AD-NOD组临床资料比较
2.2 AD组与对照组OD发生情况 在50例AD病人中,AD-OD有33例(66.0%),AD-NOD有17例(34.0%)。对照组50名研究,有OD 2名(4.0%),有NOD 48名(96.0%)。AD组嗅觉障碍发生率高于对照组(66.0% 与 4.0%,χ2 =42.242,P=0.000)。
2.3 AD组与对照组嗅觉功能评分 AD组TDI、THR、DIS及ID评分均低于对照组(P<0.05)。详见表3。AD-OD组TDI、THR、DIS及ID评分均明显低于AD-NOD组(P<0.05)。详见表4。AD组整体CDR分层后TDI、THR、DIS及ID评分差异有统计学意义(P<0.05)。组间分层后,TDI、THR、DIS及ID评分CDR 0分与CDR 1分及CDR 2分相比差异有统计学意义(P=0.000);CDR 1分及CDR 2分相比,TDI(P=0.459)、THR(P=0.125)、DIS(P=0.219)及ID(P=0.133)评分差异无统计学意义。详见表5。

表3 AD组与对照组嗅觉功能评分比较(±s) 单位:分

表4 AD-OD组与AD-NOD组嗅觉功能评分比较(±s) 单位:分

表5 AD组经CDR分层整体嗅觉功能评分比较(±s) 单位:分
2.4 相关性分析 在嗅觉功能相关因素分析中,AD组的嗅觉TDI、THR、DIS及ID评分与年龄、性别、文化程度、体质指数、汉密尔顿焦虑量表(HAMD)评分、汉密尔顿抑郁量表(HAMA)评分无相关性。详见表6。与MoCA评分和MMSE评分呈正相关(P<0.05),与CDR呈负相关(P<0.05)。详见表7。

表6 AD病人嗅觉功能评分与临床资料的相关性
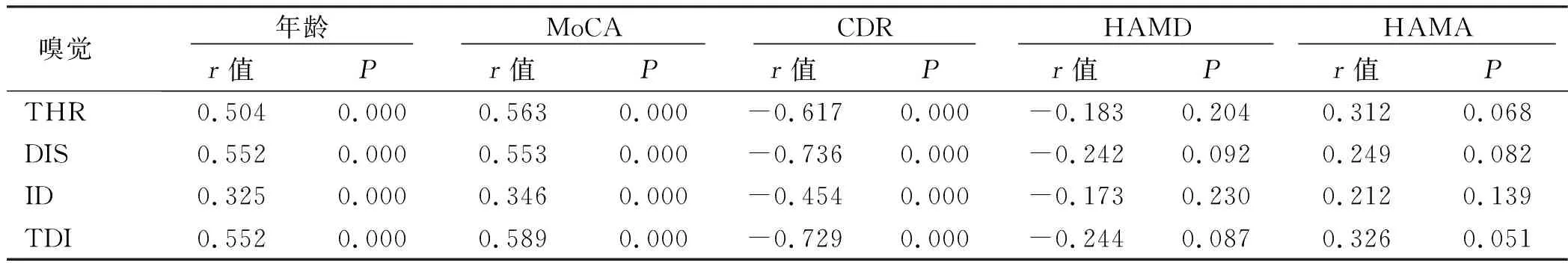
表7 AD病人嗅觉功能评分与相关量表评分的相关性
2.5 ROC分析 嗅觉阈值6.5(AUC=0.864,敏感度=84.0%,特异度=24.0%);嗅觉辨别8.5(AUC=0.923,敏感度为=82.0%,特异度= 10.0%);嗅觉识别6.5分(AUC=0.748,敏感度=88.0%,特异度=56.0%);嗅觉TDI 22.5(AUC=0.922,敏感度=88.0%,特异度=22.0%)作为区分AD 组和对照组的界值时,约登指数最大。详见图1。

图1 ROC分析
3 讨 论
AD两种主要病理机制是由淀粉样β(Aβ)蛋白在细胞外蓄积形成老年斑和由在细胞内通过磷酸化tau(p-tau)沉积形成神经原纤维缠结[6]。AD的主要临床症状是记忆障碍,但是已经发现Aβ和p-tau在嗅觉相关区域中积累,然后在涉及记忆的海马中积累,介导嗅觉信息从初级嗅觉系统到海马的内嗅皮层可能在AD相关的气味识别缺陷中起着核心作用。众所周知,内嗅皮质是AD发病最早涉及区域之一[7-8],在产生和检索长期记忆中起作用[9-10],其在感觉输入的整合中也起着重要的作用[8]。此外,嗅觉结构是唯一直接投射到内嗅皮质的感觉系统组件。因此,推测嗅觉功能障碍可出现在AD疾病过程的早期。嗅觉障碍可能是AD早期的临床标志。本研究显示,AD组嗅觉障碍发生率高于对照组(66.0% 与4.0%,χ2 =42.242,P=0.000)。AD组TDI、THR、DIS及ID评分均明显低于对照组(P<0.05),整体CDR 分层后TDI、THR、DIS及ID评分差异有统计学意义(P<0.05)。组间分层后,TDI、THR、DIS及ID评分CDR 0分与CDR 1分及CDR 2分相比差异有统计学意义(P<0.05);CDR1分及CDR2分相比,TDI、THR、DIS及ID评分差异无统计学意义;轻度AD病人与正常对照组嗅觉差异有统计学意义(P<0.05),由此可见AD早期即出现嗅觉障碍。
在一项1 630名认知健康参与者的研究中发现,嗅觉障碍与轻度认知障碍及其发展为AD有关[11]。Devanand等[12]研究表明,在无痴呆症人群中,嗅觉下降与临床症状出现前2~5年AD诊断有关,嗅觉障碍也预测着认知能力的更快下降。Dintica等[13]调查了380名无痴呆症参与者接受嗅觉测试,完成年度认知评估,并随访15年,与正常嗅觉相比,嗅觉障碍与较快的认知能力下降有关。然而,在AD病人中,嗅觉下降更快,并且与认知下降发生率相似[14]。因此,AD病人嗅觉缺陷的严重程度似乎与认知能力下降的速率有关。Doorduijn等[15]研究发现,MCI和AD病人在气味辨别和识别方面得分较低,各组嗅觉检测阈值比较差异无统计学意义,MCI和AD痴呆症病人的Aβ42水平较低,tau和p-tau水平高于对照组,各组在所有认知领域的表现均不同,对照组得分最高,AD痴呆病人得分最低。本研究结果显示,与AD-NOD组相比, AD-OD组MMSE、MoCA评分均明显降低,评分与TDI、THR、DIS及ID呈正相关(P<0.05),提示随着认知功能下降,嗅觉功能呈下降趋势 。
目前虽然有许多嗅觉测试已被用于测量嗅觉功能,但最常用的是TDI测试和宾夕法尼亚大学气味识别测试(UPSIT),存在与年龄和性别相关的评定标准,并可用于不同的语言和文化。我国目前还没有TDI参考值的标准值,杨凌等[16]研究表明TDI正常参考值是老年组TDI值>20.43;Humnlel等[17]研究表明TDI正常参考值:年龄≥55岁,TDI≥19.6。本研究显示嗅觉阈值6.5(AUC=0.864,敏感度=84.0%,特异度=24.0%)、嗅觉辨别8.5(AUC=0.923,敏感度为=82.0%,特异度=10.0%)、嗅觉识别6.5分(AUC=0.748,敏感度=88.0%,特异度=56.0%)、嗅觉TDI 22.5(AUC=0.922,敏感度=88.0%,特异度=22.0%)作为区分AD组和对照组的界值时,约登指数最大。
本研究显示AD病人嗅觉障碍的发生率较高;AD嗅觉障碍主要表现为嗅觉阈值、嗅觉辨别能力及嗅觉识别能力全面下降,嗅觉障碍作为AD常见的症状之一,在AD的早期诊断中具有重要的参考价值;嗅觉障碍有可能成为AD早期临床标志物。本研究应用TDI测试新疆维吾尔自治区受试者的嗅觉,由于样本量较少,研究设计是横断面设计,无法对AD受试者的疾病轨迹做出准确结论,嗅觉测试尚需更大样本、多中心研究进一步确定嗅觉障碍的诊断。

