基于惰性基质固态发酵产物聚谷氨酸的分离纯化研究
王 利,刘 宁,周 斌,洪康进,臧毅鹏,王梦梦,聂光军
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
γ-聚谷氨酸(γ-PGA)是由谷氨酸单体通过α-氨基与γ-羧基形成γ-酰胺键而聚合成的氨基酸均聚物,熔点为223.5 ℃,热分解温度为253.9 ℃,具有可食性、吸水性与保水性、可生物降解、无毒和环境友好等特性,已被广泛应用于医药、食品、环境和护肤品等领域[1-4]。目前,困扰γ-PGA开发应用的主要问题之一是分离纯化[3],其分离纯化成本与发酵液的复杂程度有着密切的联系。液体发酵生产γ-PGA的主要问题有:发酵液黏度较高,发酵液传质扩散慢和溶氧量低下;液体发酵液成分复杂,副产物积累多,导致γ-PGA纯化成本高[5]。固态发酵产γ-PGA的常用基质大多为农业固体废弃物,如稻壳、农林业秸秆和下脚料等,这在一定程度上降低了生产成本,但因其可溶物的溶出作用导致发酵液颜色加深和副产物增加,从而导致γ-PGA的分离纯化成本也相应提高[6]。基于惰性固体基质的发酵,增加菌丝体与营养介质接触的比表面积,增加通气量,提升γ-PGA产量,不仅可以有效避免液体发酵的诸多不足,而且可以最大程度降低发酵基质组分的复杂程度,提升γ-PGA的分离纯化效率。
γ-PGA分离纯化的主要内容包括除菌、除蛋白和色素。高黏发酵液常用的除菌方法主要有高速离心法、絮凝法和微孔滤膜法[7-8],高速离心法需要多次离心,处理量小;絮凝法成本高;由于γ-PGA分子量大小与微滤膜孔径相近,所以微孔滤膜法不易分离。除蛋白和色素的方法主要有有机溶剂沉淀法、化学沉淀法和膜分离法[9-10]。在单纯应用有机溶剂沉淀和化学沉淀分离γ-PGA时,随着发酵液组分复杂性的增加,分离步骤会增加,所用的有机试剂的量相应增加,分离成本随之增加。而膜分离中,膜成本高,易堵塞,分离效率低下。目前,发酵液的分离纯化方法不针对于液态发酵液或固体发酵物,因固态发酵只需加入生理盐水,震荡后过滤去除固体基质,即可按液态发酵液分离纯化。Wang[11]等通过稀释发酵液除细胞,活性炭脱色和超滤,脱色88%,γ-PGA产量为35 g/L。但活性炭脱色时间短,脱色效率低;脱色时间长会导致难以与γ-PGA分离。乔长晟[12]等通过板框法除菌,酶解法除大分子多糖,活性炭法脱色,超滤法除小分子杂质,冷冻干燥得γ-PGA成品,γ-PGA纯度达90%。效果较好但流程复杂,成本较高,耗时长。Yuan[13]等用铜离子从发酵液中回收γ-PGA,后经EDTA螯合铜离子,透析,冷冻干燥得γ-PGA,回收率达90%以上。操作相对简便,但用铜离子会造成污染,而EDTA价格昂贵,增加成本。为此,建立一种高效的分离纯化方法对γ-PGA开发应用至关重要。
选择珍珠岩作为惰性基质进行固体发酵,因其化学稳定性好,不参与反应,且可重复使用,可增大发酵基质的利用效率和发酵过程中氧传递效率,有效提高γ-PGA的产量,降低其发酵液中杂质的含量;再组合应用醇沉、透析和萃取等方法,建立了一种综合性纯化策略。此法统筹考虑了生产与分离,简化了发酵液的预处理,降低了有机试剂的使用量,一定程度上降低了γ-PGA分离纯化的成本,为γ-PGA的规模化生产提供了参考依据。
1 材料与方法
1.1 材料与仪器
纳豆菌(Bacillus Subtilis Natto)从市售纳豆菌粉中分离筛选所得;乙醇、丙酮(分析纯,国药化学试剂有限公司);苯酚(分析纯,上海化学试剂厂);氯仿(分析纯,阿拉丁试剂有限公司);商用γ-PGA(四川拙诚日化科技有限公司)。
种子培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏5 g/L,蒸馏水1 L,pH 7.0;斜面培养基:成分同种子培养基,加琼脂条20 g/L,蒸馏水1 L,pH 7.0;初始固体发酵培养基:用3倍体积蒸馏水浸泡洗净的大豆12 h,蒸熟时间为30 min,后碾碎分装,盖上三层纱布,121 ℃灭菌15 min。
1.2 实验方法
(1)培养方法。
①种子培养。从斜面取一环菌种接于种子培养基中,37 ℃,200 r/min,震荡培养16 h,菌浓约为3×107个/mL(OD600 nm=6)。
②固体惰性基质选择。首先研究惰性载体对γ-PGA颜色的影响。30 g大豆浸泡、蒸煮后碾磨,分别与3 g稻壳和10 g分子筛(无固体介质为对照)混匀灭菌,接种量3 mL(10%)菌液,于37 ℃培养36 h,放置4℃冰箱后熟36 h。其次是惰性载体的选择。以完全碾碎的大豆为营养基质,按质量比1∶1添加不同类型的惰性载体(稻壳、分子筛、泡沫、硅胶珠和珍珠岩),在初始pH 7.0,接种量5%,37 ℃的条件下培养36 h,放置4 ℃冰箱后熟36 h。
③发酵液的预处理。用两倍体积的生理盐水溶解固体发酵基质,溶液200 r/min震荡1 h,用4层纱布过滤,获得浸提液;再将滤渣以同样方式处理,获得二次浸提液。将浸提液混合后10 000 r/min离心15 min,取上清液,放置于4 ℃冰箱备用。用4倍体积的蒸馏水稀释上清液,充分混匀后,10 000 r/min离心15 min,取上清液;用3倍体积的冰乙醇与上清液充分混匀,4 ℃冰箱中静置12 h后,10 000 r/min离心15 min,取沉淀,60 ℃烘干至恒重。
(2)γ-PGA的提取。
①丙酮沉降。用0.1 g γ-PGA粗品配制质量浓度为2 mg/mL的溶液。分别向其中加入1~5倍体积的丙酮,充分混匀后,4 ℃冰箱静置12 h,10 000 r/min离心10 min,取沉淀,60 ℃烘干至恒重,测量其提取率与纯度。
②电驱透析。由于微生物发酵产生的γ-PGA分子量一般在100~1 000 kD之间[14],故选用截留分子量在8~12 kD的透析袋透析丙酮沉降后的γ-PGA样品,以去除色素与小分子蛋白。由于γ-PGA和蛋白所带电性的差异,在透析袋的两端加上100 伏特的电压,透析时间分别为0~30 h,取透析液测量其纯度。
③苯酚处理。用0.1 g透析处理的γ-PGA样品配制2 mg/mL溶液。量取10 mL溶液,依次添加10 mL苯酚、10 mL氯仿和1 mL异戊醇,混匀后于30 ℃、120 r/min 震荡30 min,静置分层后,取上清,加入3倍体积乙醇沉降12 h,10 000 r/min离心10 min,取沉淀,60 ℃烘干至恒重,测量其纯度。
(3)测定方法。
①紫外-可见光谱分析。将不同处理的样品配制200 pg/mL后,应用北京普析TU-1810PC紫外可见分光光度计进行紫外扫描。
②茚三酮比色法[15]测定γ-PGA纯度。高温完全水解γ-PGA为谷氨酸后,测定显色液在570 nm的OD值,计算水解后谷氨酸的含量,进一步检测γ-PGA的纯度。谷氨酸标准曲线为:
Y=0.001X+0.047(R2=0.996)。
γ-PGA纯度计算如下所示:

式中,G为通过标准曲线计算的谷氨酸含量(ug);W为样品水解前的质量(ug)。
③HPLC含量测定。用0.05 M Na2HPO4溶液配制同浓度的样品,经0.45 um膜过滤,应用TOSOH TSK-GEL G6000PWXL色谱柱(日本岛津LC-2030高效液相色谱仪),流动相为磷酸氢二钠-磷酸二氢钾缓冲液(pH 7.0),流速为0.5 mL/min,在216 nm检测样品。
④纸层析法[15]测定γ-PGA的单体组成。将0.2 g γ-PGA样品用10 mL 6 mo1/L的盐酸110 ℃,水解17 h。调溶液pH至7.0,定容至100 mL,过滤后垂直点样3次。平衡反应空间15 min后,在展层剂(正丁醇∶80%甲酸∶水=15∶3∶20)中层析,烘干后用0.1%茚三酮-丙酮溶液显色。
⑤SDS-PAGE电泳[16]测定γ-PGA的分子量。配制6%的分离胶与5%的浓缩胶,点样后用80 V低压进行浓缩,至分离胶左右调至100 V电泳。将凝胶浸入考马斯亮蓝染色液染色0.5 h,脱色后用阿利新蓝染8-GX染液复染,脱色至条带清晰。
2 结果与讨论
2.1 惰性基质的筛选
以稻壳和分子筛为固体基质(大豆为对照)时,γ-PGA粗品的颜色变化显著,具体如图1所示。由图1可知,根据固体基质类型的不同,γ-PGA粗品的颜色深浅变化:稻壳>大豆>分子筛。这可能由于蒸煮过程中大豆和稻壳中的色素和可溶物溶出,导致发酵产品颜色变深,增加产物分离纯化的难度。分子筛作为固体支持基质时,γ-PGA粗品的颜色最浅,表明惰性载体一定程度上降低了发酵组分的复杂性,有利于后续产品的纯化。进一步研究不同惰性载体对γ-PGA产量的影响,结果如图2所示。由图2可知,固体支持物都能显著增加γ-PGA产量,其中珍珠岩对γ-PGA产量提升影响最大,达到了60g/Kgds(Dry Substance, DS),是对照的两倍。这是由于固体支持物增加了菌体的表面积,有利于传质扩散,增加通气量,促进微生物的增殖与代谢。但是,过大或过小尺寸的固体基质都不利于微生物发酵。珍珠岩可能因为粒径适中,既利于菌体分散,又不阻碍物质传输,进而促进了γ-PGA的生产。更重要的是,珍珠岩在提升γ-PGA产量的同时,γ-PGA粗品的颜色也较浅(见图5a),其纯度达到了72.62%,有效降低了γ-PGA分离纯化的成本。

图1 惰性基质对γ-PGA粗品颜色的影响

图2 不同惰性支持介质对γ-PGA产量的影响
2.2 γ-PGA的分离纯化
(1)丙酮处理。分析丙酮用量对γ-PGA的提取效率的影响。丙酮和透析对γ-PGA分离纯化的影响如图3所示。由图3a可知,γ-PGA的提取率随着丙酮添加量的增加而增加,当丙酮添加量为3倍体积(150 mL)时,γ-PGA提取率达到70.2%;继续增加丙酮用量,提取率增加不显著。为了减少有机溶剂使用量,丙酮使用比例确定为3倍体积。经过丙酮处理后,γ-PGA样品色泽变浅(见图5b)。不同处理的γ-PGA样品的紫外光谱图如图4所示。由图4可知,γ-PGA在210 nm处的特征吸收峰的峰面积比处理前的增大了。同时,260~280 nm区间内杂蛋白的吸收峰的峰面积变小,表明丙酮处理后的γ-PGA纯度有所提升,纯度测定显示丙酮处理后的γ-PGA样品纯度增加至80.2%,纯度提升10.4%。由于色素和蛋白易溶于丙酮,丙酮脱色效果较明显。且γ-PGA不溶于丙酮,故丙酮可以达到纯化γ-PGA的效果[17]。
(2)透析。透析不仅可以除去粗品中的小分子色素及杂质,还可以除去上一步丙酮纯化后残留的丙酮。由图3b可知,随着透析时间的增加,γ-PGA样品纯度逐渐增加,透析18 h后,样品颜色进一步变白(见图5c),样品纯度达到83.6%。表明透析过程中,小分子色素及蛋白不断渗出。由图4可以看出,经过透析处理后,γ-PGA透析样品的最大特征峰值及其峰面积都高于未处理对照。但是,杂蛋白所形成的吸收峰的峰面积也变大,可能是γ-PGA样品中随着小分子色泽及杂质的去除,导致截留下来的大分子蛋白浓度的相对提升。

图3 丙酮和透析对γ-PGA分离纯化的影响
(3)苯酚处理。因蛋白具有苯环结构,故应用苯酚去除透析所截留下来的大分子蛋白杂质。由图4可知,经过苯酚处理后,γ-PGA的特征吸收峰值及其面积进一步增大,非常接近γ-PGA标品的峰形;同时,260~280 nm处的杂蛋白吸收峰进一步降低,表明苯酚处理进一步提升了γ-PGA的纯度。纯度测定显示γ-PGA样品的纯度升高至89.12%,样品呈白色粉末状(见图5d)。由于γ-PGA是谷氨酸高聚物,其结构与蛋白质存在基团差异。故基于DNA提取过程中[18]利用苯酚与蛋白分子相似相溶的原理,实现除去大分子杂蛋白的目的。此外,应用氯仿除去水相中的残留少量酚,加速有机相与水相分层,有利于γ-PGA的分离。
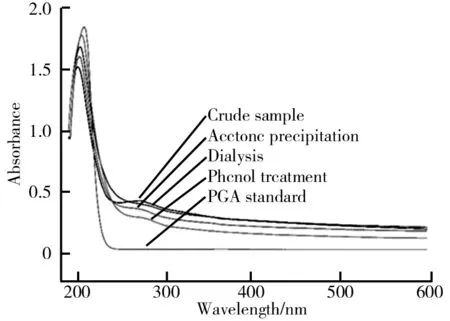
图4 不同处理的γ-PGA样品的紫外光谱图

图5 不同处理后γ-PGA样品的色泽变化
2.3 γ-PGA样品的鉴定
SDS-PAGE电泳分析发现γ-PGA粗品的条带较宽且有拖尾与前泳现象,表明粗品含有一定杂质,且分子量不是很均一(见图6);但是,其核心位置与纯化后样品的条带位置一致,说明粗品的纯度相对较高,表明以惰性固体基质发酵的γ-PGA粗品的杂质含量较低。纯化后的γ-PGA样品条带位置与γ-PGA的标品和商用品的基本一致,且样品带宽更窄,表明基于固体惰性基质发酵生产的γ-PGA的分子量约为700kD,且分子量比较均一,说明分离纯化的效率高。进一步应用纸层析分析γ-PGA的水解液,不同γ-PGA样品及其水解液的纸层析结果如图7所示。由图7可知,γ-PGA样品的水解液与γ-PGA标品的水解液和谷氨酸标品溶液的展层形貌完全一致,说明样品水解液中只含有谷氨酸,表明其纯度较高。进一步比较发现,γ-PGA标准品、γ-PGA样品未出现层析斑点,而γ-PGA粗品呈现放射状层析斑点,一方面说明γ-PGA粗品中含有杂蛋白和其他氨基酸,需要进一步纯化;另一方面说明γ-PGA粗品经纯化后不含其他杂质,表明分离纯化效率较高。

图6 不同γ-PGA样品的SDS-PAGE图7 不同γ-PGA样品及其水解液的纸层析
应用HPLC分析纯化后的γ-PGA样品与γ-PGA标准品,分析结果如图8所示。由图8可知,两者的HPLC图谱非常接近(Rt均为8 min),且与Zeng[19]报道一致,表明纯化后的γ-PGA样品质量很接近γ-PGA标准品。
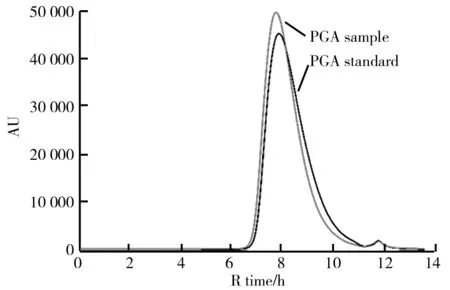
图8 γ-PGA样品与标品的HPLC图谱
3 结论
综上,基于惰性基质固体发酵生产的γ-PGA不仅产量提升了两倍,而且杂质含量少,便于后续分离纯化。这为统筹考虑γ-PGA生产与分离纯化,提出综合γ-PGA制备的策略提供了契机。进一步地,组合多种分离纯化方法,将γ-PGA粗品的纯度提升至89.12%,其分子量均一,样品质量接近γ-PGA标品。表明上述制备策略不仅效率高,而且节省了发酵液预处理的时间和有机溶剂的使用量,为γ-PGA分离纯化方面的研究提供有益参考。

