机械化学条件下AlCl3催化合成氧化吲哚螺二氢吡啶
徐 绘,蒋欢欢,胡 俊,翁明月,徐英茹,黄 洋
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
氧化吲哚螺环化合物广泛存在于天然产物和生物活性分子中,是一类非常重要的药物活性骨架。例如SpirotryprostatinA和B在哺乳动物乳腺癌细胞中表现出良好的抗G2/M细胞转移活性[1];NITD609具有较高的抗疟疾活性[2];从Horsfieldiasuperba植物叶中分离得到的Horsfiline可作为抗癌镇痛剂和细胞周期抑制剂[3]。氧化吲哚螺环化合物的化学结构如图1所示。鉴于氧化吲哚螺环化合物广谱的生物活性和潜在的药用价值,发展新颖的方法高效构建该螺环化合物一直是有机化学家们研究的热点[4-6]。目前的合成方法主要有环加成反应和串联反应[7-11]。尽管这些合成方法均有各自优点,但大多仍存有一定的缺陷,例如反应条件苛刻、反应需在有毒的有机溶剂中进行、使用昂贵的过渡金属催化剂或复杂的底物等,从而限制了方法的实用性。因此,探索更加高效、环境友好的方法合成螺环氧化吲哚是非常有必要的。

图1 具有生物活性的氧化吲哚螺环化合物
近些年来,无溶剂反应因具有环境污染小、成本低、操作简化等优势而受到越来越多的关注。在众多的无溶剂合成技术中,机械研磨是一种引人关注且实用的技术,并日益展现出较大的优势[12]。相较于传统液相反应,很多机械研磨条件下的反应都能够在较短时间内获得更高产率。机械研磨甚至能够改变反应的化学选择性,得到与液相反应不同的产物[13],因此在有机合成领域有着越来越广泛的应用。基于上述科学背景,研究了机械化学条件下AlCl3催化烷叉氧化吲哚与烯胺的环化反应,以优异的收率高效得到一系列氧化吲哚螺二氢吡啶衍生物。该反应无需使用有机溶剂,在节约成本的同时也减少对环境的污染,是一种较为绿色的螺环氧化吲哚合成法。
1 实验部分
1.1 试剂与仪器
吲哚-2,3-二酮,苯乙酮,对甲苯乙酮,对溴苯乙酮,乙酰乙酸甲酯,乙酰乙酸乙酯,乙酰乙酸叔丁酯,苄胺,苯胺,乙胺水溶液,二乙胺,浓盐酸,冰醋酸,氯化铝,氯化铜,氯化锌,无水三氯化铁,碘,无水乙酸镍,无水硫酸钠,溶剂(AR)。
德国Retsch MM400机械化学反应器;旋转蒸发仪RE-52C;手提式紫外分析仪;德国Bruker Advance 400 MHz核磁共振波谱仪;薄层层析硅胶。
1.2 烷叉氧化吲哚的制备
向100 mL圆底烧瓶中加入10 mmol吲哚-2,3-二酮和10 mmol取代苯乙酮,然后加入50 mL无水乙醇使其溶解,之后再加入5滴二乙胺,并于室温下搅拌反应18h。反应结束后,浓缩反应液并过滤得到白色的缩合产物,该粗产品无需进一步纯化即可进行下一步反应。向100 mL圆底烧瓶加入上述全部粗产品和50 mL乙醇,搅拌溶解之后加入1 mL浓盐酸和15 mL冰醋酸,回流条件下搅拌反应16 h(反应过程由薄层层析色谱监测)。反应结束后将反应液冷却至室温,然后将其倒入100 mL水中并用乙酸乙酯萃取,之后经过无水硫酸钠干燥,抽滤得到的粗产品用乙醇重结晶即可得到纯净的烷叉氧化吲哚。
1.3 烯胺的制备
向25 mL圆底烧瓶中依次加入10 mmol β-羰基酯、10 mmol胺和10 mol%无水乙酸镍,然后于室温下搅拌反应。通过薄层层析色谱法检测反应物,反应完全时停止反应,加入石油醚溶解并过滤得到烯胺粗产品,然后通过柱色谱(洗脱剂:乙酸乙酯/石油醚)分离纯化得到纯净的烯胺。
1.4 氧化吲哚螺二氢吡啶衍生物的合成(以合成3a为例)
分别称取烷叉氧化吲哚(1a,0.2 mmol,49.8 mg)、烯胺(2a,0.22 mmol,48.2 mg)和无水AlCl3(0.04 mmol,5.3 mg)于体积为5 mL的不锈钢研磨罐中(两个相同的研磨罐同时进行,各含有一直径为7.0 mm的不锈钢球),然后封闭反应罐并固定在机械化学反应仪的机械臂上,以30 Hz的频率研磨30 min。研磨结束后打开研磨罐,加入乙酸乙酯提取反应混合物,然后通过硅胶柱色谱(V/V∶乙酸乙酯/石油醚=2∶3)分离得到81.2 mg产物3a,产率为90%。合成过程如图2所示。

图2 烷叉氧化吲哚1a与烯胺2a的环化反应合成氧化吲哚螺环化合物3a
2 结果与讨论
2.1 反应条件的优化
选取烷叉氧化吲哚1a和烯胺2a作为模型底物来优化氧化吲哚螺环化合物3a的合成,系统考察了催化剂种类和研磨时间对反应的影响。反应条件的优化如表1所示。按照1a∶2a∶催化剂=1∶1.1∶0.2的反应投料摩尔比,在30 Hz的震荡研磨频率下反应20 min,尝试了几种常见路易斯酸催化剂I2、ZnCl2、FeCl3、CuCl2和AlCl3(如表1中1#~ 5#所示),通过薄层层析色谱法(TLC)跟踪反应发现,这些催化剂都有一定的催化效果,其中AlCl3的催化效果最佳,以81%的收率得到目标产物3a。为了探究该环化反应是否必须使用催化剂,还尝试了无催化剂对照试验,结果发现只有痕量的产物生成,因此表明催化剂在该反应中起到了至关重要的作用(如表1中6#所示)。为了进一步提高产率,尝试将研磨时间延长至30 min,结果产物收率顺利提高至90%(如表1中7#所示),而进一步延长反应时间至40 min产率几乎不变(如表1中8#所示),因此30 min为最佳反应时间。
综上所述,最终确定合成该氧化吲哚螺二氢吡啶的最佳反应条件为:烷叉氧化吲哚1a∶烯胺2a∶AlCl3=1∶1.1∶0.2,研磨时间为30 min。
2.2 底物的扩展
利用上述优化得到的最优反应条件,以不同取代的烷叉吲哚和烯胺为原料,共合成出7种不同的氧化吲哚螺二氢吡啶如表2所示。并经1H NMR和13C NMR对合成的每一种化合物的结构进行了确认。
首先对不同取代的烷叉氧化吲哚进行了考察,由表2可以看出,烷叉氧化吲哚中羰基相接的苯环上不论是连有供电子基团还是吸电子基团,反应都能以非常高的收率得到相应产物。接下来对烯胺进行了扩展,N-乙基取代的烯胺同样能够很好地兼容于该环化反应,并以92%的高收率得到目标产物3d。当N-苯基取代的烯胺参与反应时,螺环产物3e的收率略低,这可能与芳胺中的共轭效应使得氮原子的亲核反应活性降低有关。此外,当甲酯或正丙酯取代的烯胺参与反应时,仍然能够高效地得到相应目标产物。这些实验结果表明,反应具有很好的底物普适性。
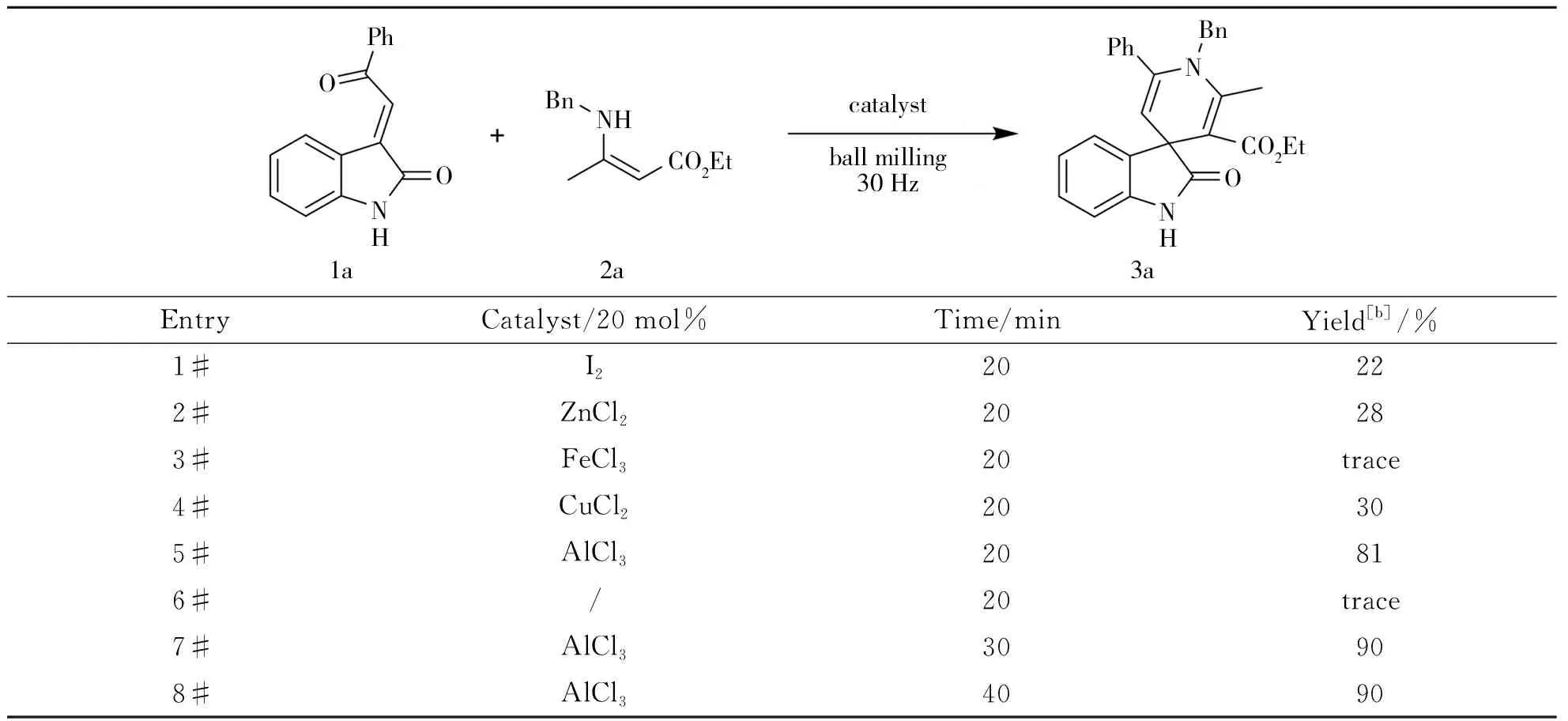
表1 反应条件的优化[a]
[a]:Reaction conditions:a mixture of1a (0.2 mmol),2a (0.22 mmol) and catalyst (0.04 mmol) was milled in a Retsch MM400 mixter mill.[b]:Isolated yield.

表2 底物的扩展
2.3 反应机理
根据前面的实验结果,提出了一个可能的反应机理,如图3所示。烷叉氧化吲哚1首先在AlCl3的诱导下与烯胺发生Michael加成反应,得到加成产物中间体A。然后A中氮原子对酮羰基发生亲核加成反应,得到中间体B。B紧接着发生消除反应,脱掉一分子水,最终得到产物3。

图3 可能的反应机理
2.4 氧化吲哚螺二氢吡啶衍生物的结构表征
3a:Ethyl 1′-benzyl-2′-methyl-2-oxo-6′-phenyl-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.44 (s,1H),7.41~7.20 (m,8H),7.17~7.12 (m,1H),6.96~6.91 (m,4H),6.88 (d,J=7.7 Hz,1H),5.04 (s,2H),4.52 (s,1H),3.96-3.84 (m,2H),2.44 (s,3H),0.95 (t,J=7.1 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.3,164.9,141.5,137.7,137.6,136.4,131.8,131.5,130.8,129.0 (2C),128.8 (4C),127.5,127.3,125.8 (2C),123.1,122.0,114.9,110.3,109.2,59.1,48.2,45.9,14.2,12.1.
3b:Ethyl 1′-benzyl-2′-methyl-2-oxo-6′-(p-tolyl)-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.79 (s,1H),7.33 (t,J=7.3 Hz,2H),7.29~7.04 (m,6H),6.97~6.91 (m,4H),6.88 (d,J=7.7 Hz,1H),5.03 (s,2H),4.52 (s,1H),3.95~3.83 (m,2H),2.43 (s,3H),2.32 (s,3H),0.93 (t,J=7.1 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.7,165.0,141.6,138.7,137.7,137.6,136.4,131.8,129.5 (2C),129.0 (2C),128.8 (2C),127.7,127.4,127.3,125.8 (2C),123.1,121.9,114.7,110.2,109.3,59.0,48.1,46.0,21.4,14.2,12.1.
3c:Ethyl 1′-benzyl-6′-(4-bromophenyl)-2′-methyl-2-oxo-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 7.54~7.38 (m,2H),7.34 (t,J=7.3 Hz,2H),7.30~7.20 (m,2H),7.18~7.10 (m,2H),6.96~6.86 (m,5H),5.02 (s,2H),4.48 (s,1H),3.96~3.80 (m,2H),2.45 (s,3H),0.93 (t,J=7.0 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.6,164.7,141.6,138.0,137.2,134.9,132.9,131.9 (4C),131.4,129.6,129.0 (2C),127.5,127.4,125.6 (2C),122.8,121.9,115.2,110.4,109.4,59.1,48.0,45.8,14.1,11.9.
3d:Ethyl 1′-ethyl-2′-methyl-2-oxo-6′-phenyl-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.64 (s,H),7.60~7.37 (m,5H),7.14~7.09 (m,1H),6.93~6.88 (m,2H),6.86 (d,J=7.7 Hz,1H),4.40 (s,1H),3.94~3.80 (m,4H),2.58 (s,3H),1.18 (t,J=7.2 Hz,3H),0.92 (t,J=7.1 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.6,164.9,141.5,136.9,135.4,131.8,131.6,131.3,131.2 (2C),128.7 (2C),127.2,123.1,121.9,114.6,109.6,109.2,58.9,45.9,39.4,16.1,14.2,11.8.
3e:Ethyl 2′-methyl-2-oxo-1′,6′-diphenyl-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.97 (s,1H),7.41~7.13 (m,11H),6.99 (d,J=7.3 Hz,1H),6.93 (t,J=7.5 Hz,2H),4.68 (s,1H),4.01~3.82 (m,2H),2.38 (s,3H),0.97 (t,J=7.1 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.8,165.0,141.7,138.4,137.8,136.4,131.7,131.1 (2C),130.9,129.0 (2C),128.6 (2C),128.3 (2C),128.2,127.8,127.4,123.2,122.0,114.9,110.7,109.4,59.2,45.9,14.2,13.1.
3f:Methyl 1′-benzyl-2′-methyl-2-oxo-6′-phenyl-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.30 (s,1H),7.40~7.20 (m,8H),7.18~7.11 (m,1H),6.93 (d,J=4.8 Hz,4H),6.88 (d,J=7.7 Hz,1H),5.05 (s,2H),4.52 (s,1H),3.35 (s,3H),2.43 (s,3H);13C NMR (101 MHz,CDCl3) δ 180.3,165.3,141.4,137.8,137.5,136.4,131.7,131.5,130.7,129.0 (2C),128.8 (4C),127.5,127.4,125.8 (2C),123.2,122.1,115.0,110.0,109.0,49.9,48.2,45.8,11.9.
3g:propyl 1′-benzyl-2′-methyl-2-oxo-6′-phenyl-1′H-spiro[indoline-3,4′-pyridine]-3′-carboxylate.White solid;1H NMR (400 MHz,CDCl3) δ 8.22 (s,1H),7.40~7.21 (m,8H),7.18~7.11 (m,1H),6.97~6.91 (m,4H),6.87 (d,J=7.7 Hz,1H),5.04 (s,2H),4.51 (s,1H),3.89~3.72 (m,2H),2.43 (s,3H),1.50~1.31 (m,2H),0.76 (t,J=7.4 Hz,3H);13C NMR (101 MHz,CDCl3) δ 180.1,165.0,141.5,137.6,137.5,136.4,131.6,131.5,130.8,129.0 (2C),128.8 (4C),127.5,127.3,125.8 (2C),123.1,122.0,115.1,110.3,109.2,64.9,48.2,45.8,22.1,12.2,10.5.
3 结论
研究了机械化学条件下AlCl3催化氧化吲哚与烯胺的无溶剂环化反应,发展出一种绿色高效合成螺环氧化吲哚化合物的新型方法。该方法具有产率高、反应快速、条件温和、官能团兼容好、反应过程无需使用有机溶剂等优点,为具有潜在应用价值的氧化吲哚螺二氢吡啶的合成提供了一条实用的新途径。

