小黑杨PsnHB22基因在烟草中的遗传转化研究
李 潺 张 翔 郑 兰 常成龙 刘彩霞 郑 密 由香玲*
(1.东北林业大学生命科学学院,哈尔滨 150040; 2.四平市国有林总场石岭子落叶松国家良种基地,四平 136000; 3.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
同源异型盒(Homeobox)基因编码是一个由60个(或61个)保守氨基酸构成的蛋白质域,即同源结构域(HD)[1]。Homeobox基因在植物中可以分为14个类群,分别是HD-ZipⅠ、HD-ZipⅡ、HD-ZipⅢ、HD-ZipⅣ、WOX、PLINC、BEL、KNOX、DDT、PINTOX、PHD、LD、NDX及SAWADEE[2]。Homeobox基因几乎参与了植物生命周期中的全部发育过程,特别是与激素反应有关的重要途径。它们决定了植物的形态结构并参与茎尖和根尖分生组织的发育过程,同时还调控花发育的启动并控制胚珠和果实的形成[3~5],如:KNOX基因的成员通常在茎尖分生组织(SAM)中表达,并在植物发育过程中调节细胞分裂和分化间的平衡[6];WOX类基因是胚胎形成的关键[7]。
HD-Zip转录因子是包含同源域(HD)和亮氨酸拉链(LZ)基序的一个植物特异性蛋白质的大家族[8~10]。根据编码基因的结构和DNA的结合特异性,HD-Zip转录因子分为4个亚家族[11],不同的亚家族成员具有不同的生物学功能。其中HD-ZipⅠ亚家族在光信号转导、非生物胁迫、叶片发育等方面发挥重要作用[12];HD-ZipⅡ亚家族响应光照条件及生长素的变化[13~14];HD-ZipⅢ亚家族成员调节顶端分生组织和维管束的发育,并影响生长素运输[15];HD-ZipⅣ亚家族基因于植物器官的外细胞层中特异性表达,在表皮细胞分化、根系发育和花青素积累等方面发挥作用[8]。
HB22蛋白是HD-ZipⅠ亚家族的成员之一,目前关于杨树HB22基因在烟草中异源表达的研究报道较少。本试验从小黑杨中克隆PsnHB22基因,构建植物表达载体,进行烟草遗传转化并分析获得的转基因植株相关生物学特性,为后续深入研究PsnHB22基因功能奠定基础。
1 材料与方法
1.1 实验材料
野生型烟草(Nicotianatabacum)种子,野生型小黑杨(Populussimonii×P.nigra)组培苗均为本实验室保存。
1.2 菌株及主要试剂
大肠杆菌Trans1-T1感受态、pEASY-T1 Cloning Vector购自北京全式金生物技术(TransGen Biotech)有限公司;根瘤农杆菌GV3101感受态购自上海唯地生物技术有限公司;植物表达载体pROKⅡ质粒,由山东师范大学张慧教授惠赠;RNA提取试剂盒购自北京百泰克生物技术(BioTeke)有限公司;质粒提取试剂盒、胶回收试剂盒购自杭州博日科技(Bioer)有限公司;PCR试剂、DNA Marker、限制性内切酶、DNA Ligation Kit、PrimeScriptTMRT reagent Kit、TB Green® Premix Ex TaqTMⅡ荧光定量试剂盒等购自TaKaRa公司;其他试剂均为进口或国产分析纯。
1.3 实验方法
1.3.1 小黑杨总RNA提取及PsnHB22基因的克隆
利用BioTeke通用植物总RNA提取试剂盒提取野生型小黑杨组培苗叶片总RNA,并使用PrimeScriptTMRT reagent Kit试剂盒进行反转录获得cDNA。以小黑杨cDNA为模板,利用特异性引物PsnHB22-F(5′-ATCTCTAGAATGGAAAGTGATAGCACAAATGATC-3′)/PsnHB22-R(5′-ATCGGTACCCTTACTGGGTGGTAAGAGAAGATG-3′)进行PCR扩增,PCR反应程序为:95℃预变性2 min;95℃变性20 s,56℃退火20 s,72℃延伸7 s,40个循环;72℃再延伸5 min,PCR反应结束后将所有PCR产物进行1%琼脂糖凝胶电泳检测,并使用胶回收试剂盒对目的条带进行切胶回收,将胶回收产物连接pEASY-T1载体后转化Trans1-T1大肠杆菌感受态细胞,涂布于(50 mg·L-1Kan)LB平板上,37℃培养12~16 h。挑取单克隆菌落进行菌液PCR检测,将阳性单克隆菌液送哈尔滨擎科生物公司测序,保存测序结果正确的菌液,并命名为pEASY-T1-PsnHB22。
1.3.2 植物表达载体构建
利用Bioer公司的质粒提取试剂盒提取pEASY-T1-PsnHB22大肠杆菌质粒和pROKⅡ质粒,利用限制性内切酶XbaⅠ、KpnⅠ双酶切pEASY-T1-PsnHB22质粒及pROKⅡ载体质粒,利用DNA Ligation Kit试剂盒连接PsnHB22和pROKⅡ片段并转化Trans1-T1大肠杆菌感受态细胞,涂布于(50 mg·L-1Kan)LB平板上,37℃过夜培养。挑取单克隆菌落进行菌液PCR检测,将PCR条带大小正确的菌液送哈尔滨擎科生物公司测序,保存测序结果正确的菌液,并命名为pROKⅡ-PsnHB22。提取pROKⅡ-PsnHB22菌液的质粒,进行GV3101农杆菌感受态细胞转化,并利用通用引物pROKⅡ-F(5′-AAGACCGGCAACAGGATTC-3′)/pROKⅡ-R(5′-CGCACAATCCCACTATCCTT-3′)进行PCR检测。
1.3.3 转基因株系的获得及分子检测
政府引导基金的发展模式方面,李洪江和鲍晓燕(2012)通过比较国外政府引导基金的经济绩效和投资结果,对我国政府引导基金的发展模式进行了评估并指出了国外经验的借鉴意义。萧端和熊婧(2014)以YOZMA基金为案例,从运行机制和运作效率等角度对以色列政府引导基金的制度设计进行了观测,在此基础上为国内政府引导基金的平稳发展提供了政策性建议。燕志雄等(2016)则从代理成本视角入手,指出政府引导基金可能会遭受合谋问题,良好的监管和治理机制成为政府引导基金健康发展的重要外部条件。
选取组培瓶内烟草已展开的绿色大叶片,用无菌手术刀切除叶片主叶脉,将叶片切成大小约1 cm×1 cm的形状,将切好的叶片浸入OD600值为0.2~0.4的农杆菌侵染液中10 min,侵染结束后取出叶片,均匀摆放到诱导培养基上共培养2 d。将共培养的烟草叶片脱菌后放入选择培养基(10 mg·L-1Kan、200 mg·L-1特美汀)培养,1个月后获得烟草抗性植株。用CTAB法提取烟草抗性植株DNA,利用pROKⅡ载体通用引物进行PCR,并通过1%琼脂糖凝胶检测。
1.3.4 实时荧光定量PCR检测
利用TB Green® Premix Ex TaqTMⅡ荧光定量试剂盒提取烟草转基因株系总RNA,并反转录为cDNA。取20 ng cDNA进行定量检测,定量PCR引物序列为:PsnHB22-RT-F(5′-TCACTTTCCACCCTCCAATG-3′)/PsnHB22-RT-R(5′-TCTTTCCACTCCTTTCACCTG-3′),以NtActin为内参基因,引物序列为:NtActin-RT-F(5′-TGTGTTGGACTCTGGTGATG-3′)/NtActin-RT-R(5′-CGCTCGGTAAGGATCTTCATC-3′)。实时定量反应程序如下:95℃ 30 s;95℃ 5 s,60℃ 35 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品重复3次,并通过2-ΔΔCt法进行计算。
1.3.5 转基因植株的株高和叶片观察
选取烟草表达量较高的4个转基因株系及野生型各6株移至温室,对营养生长旺盛的3月龄烟草测定其株高、叶长、叶宽等物理性状,并进行差异显著性分析。
1.3.6 转基因植株叶片细胞形态分析
为了比较转基因烟草和野生型烟草叶片表皮细胞的差异,分别取转基因及野生型烟草自下而上第七片叶进行显微观察,取叶片同部位不含叶脉的下表皮,制片并在光学显微镜下观察、拍照。
1.3.7 转基因植株的叶绿素含量的测定
分别取烟草转基因株系和野生型相同部位的叶片进行叶绿素含量的测定,采用购自柯尼卡美能达(中国)投资有限公司的SPAD-502 Plus叶绿素测定仪测定叶绿素SPAD值,每组进行3次生物学重复。
2 实验结果
2.1 小黑杨PsnHB22基因的克隆
利用RNA提取试剂盒提取小黑杨总RNA,浓度测定后反转录为cDNA,并进行PsnHB22基因扩增,PCR反应程序结束后将PCR产物进行1%琼脂糖凝胶电泳检测,结果显示:扩增条带大小和预期目标一致(见图1A)。胶回收目的条带后与pEASY-T1载体连接,转化大肠杆菌,进行菌液PCR验证(见图1B),比对测序结果,将基因序列正确的菌液命名为pEASY-T1-PsnHB22。

图1 PsnHB22基因的克隆及鉴定 A.PsnHB22基因的克隆(M. DNA marker DL5000;1. PsnHB22基因的PCR扩增产物); B.pEASY-T1-PsnHB22的菌液PCR检测(M. DNA marker DL5000;1~4. pEASY-T1-PsnHB22单菌落)Fig.1 The cloning and identification of PsnHB22 gene A.The cloning of PsnHB22 gene(M. DNA marker DL5000; PCR amplification product of PsnHB22 gene); B. PCR detection of pEASY-T1-PsnHB22(M. DNA marker DL5000; 1-4. The single colonies of pEASY-T1-PsnHB22)
2.2 植物表达载体的构建
利用限制性内切酶XbaⅠ、KpnⅠ双酶切pEASY-T1-PsnHB22质粒及pROKⅡ载体质粒,1%琼脂糖凝胶电泳检测(见图2A),并胶回收目的片段,使用DNA Ligation Kit连接目的片段后转化Trans1-T1感受态细胞并进行菌液PCR检测(见图2B),PCR扩增的特异性条带与目的条带大小一致。测序结果表明连接正确,基因未发生突变,pROKⅡ-PsnHB22植物表达载体构建成功。提取pROKⅡ-PsnHB22大肠杆菌的质粒转化GV3101农杆菌感受态细胞,并进行PCR检测(见图2C),结果表明pROKⅡ-PsnHB22植物表达载体成功导入GV3101农杆菌中。
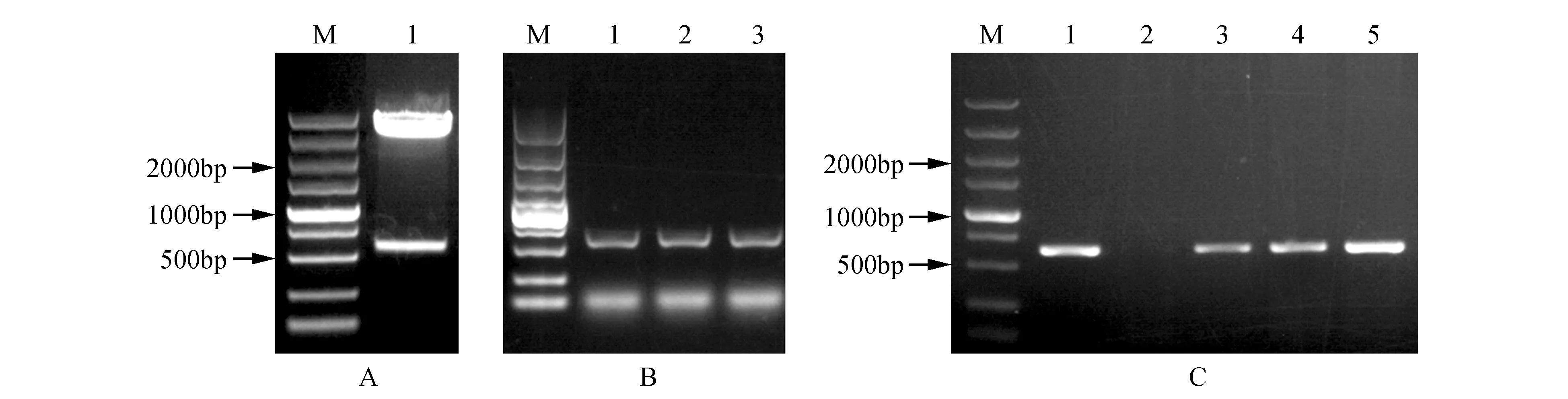
图2 植物表达载体pROKⅡ-PsnHB22的构建 A.限制性内切酶对pEASY-T1-PsnHB22质粒的双酶切电泳图(M. DNA marker DL5000;1. pEASY-T1-PsnHB22);B. pROKⅡ-PsnHB22菌液PCR检测(M. DNA marker DL5000;1~3. pROKⅡ-PsnHB22单菌落);C.农杆菌GV3101转化子的菌液PCR检测(M. DNA marker DL5000;1~5.GV3101农杆菌菌液PCR检测)Fig.2 Construction of plant expression vector pROKII-PsnHB22 A. Restriction enzyme digestion of pEASY-T1-PsnHB22 plasmid(M. DNA marker DL5000; 1. pEASY-T1-PsnHB22); B. pROKII-PsnHB22 bacterial solution PCR detection(M. DNA marker DL5000; 1-3. pROKII-PsnHB22 single colony); C. Bacterial PCR detection of Agrobacterium GV3101 transformant(M. DNA marker DL5000; 1-5. PCR detection of GV3101 Agrobacterium)
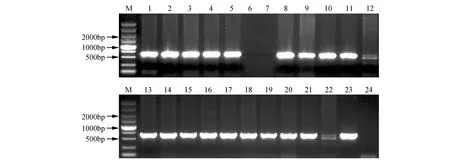
图3 转基因株系的DNA分子检测 M. DNA marker DL5000;1,13.阳性对照;2~12、14-23.PsnHB22转基因烟草验证;24.野生型对照Fig.3 DNA molecular detection of transgenic lines M. DNA marker DL5000; 1,13. Positive control; 2-12,14-23. Validation of PsnHB22 transgenic tobacco; 24. Wild type control

图5 转基因烟草表型观察 A.转基因烟草株高观察;B.转基因烟草叶片观察;C.转基因烟草第6片叶的表型观察Fig.5 Phenotypic observation of transgenic tobacco A.Plant height observation of transgenic tobacco; B.Leaf observation of transgenic tobacco; C.Phenotypic observation on the 6th leaf of transgenic tobacco
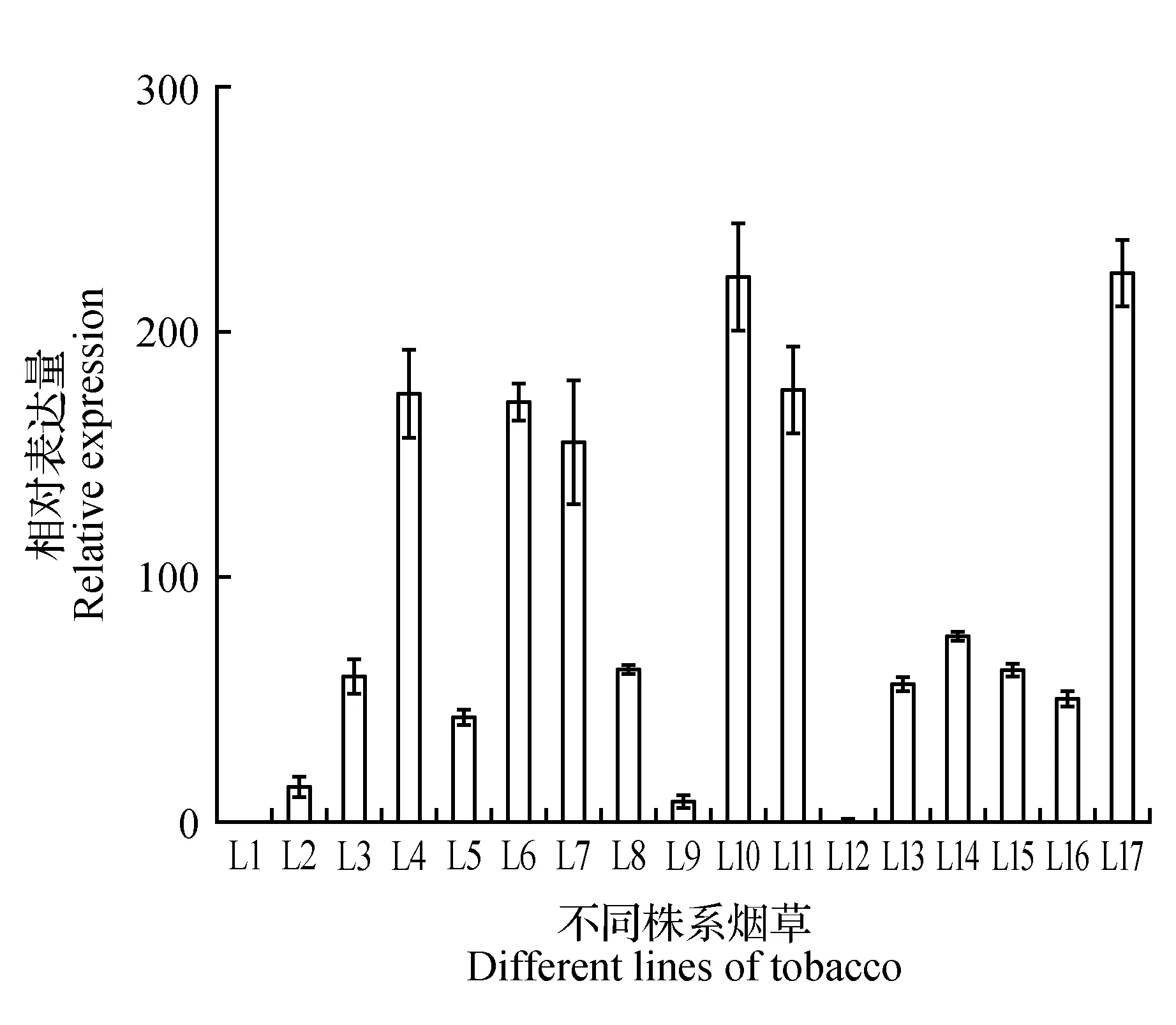
图4 转基因株系的qRT-PCR检测Fig.4 qRT-PCR detection of transgenic lines
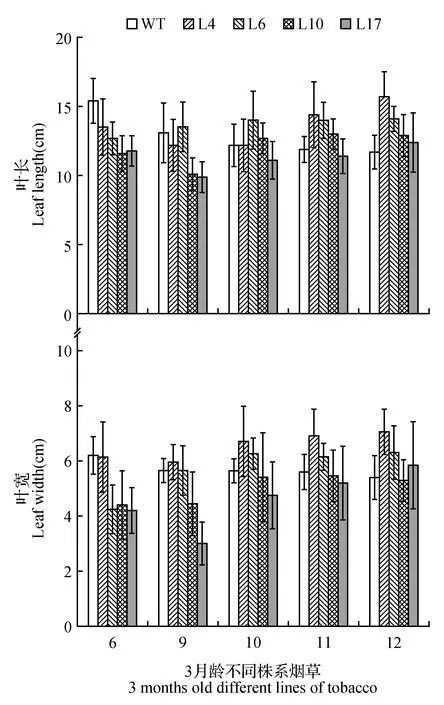
图6 转基因烟草叶长、叶宽的统计分析 *显著相关水平(P<0.05);***极显著相关水平(P<0.001)Fig.6 Statistical analysis of leaf length and leaf width of transgenic tobacco * means correlation is significant at the 0.05 level; *** means correlation is significant at the 0.001 level
2.3 转基因株系的获得及分子检测
利用已转化pROKⅡ-PsnHB22质粒的农杆菌GV3101菌液侵染烟草叶片,经4~6周的选择培养后获得抗性芽,并进行生根培养,共获得17个烟草转基因株系。提取转基因烟草及野生型基因组DNA,利用pROKⅡ通用引物进行PCR扩增(见图3),结果显示PsnHB22基因已经整合入烟草基因组中。
2.4 转基因植株的实时荧光定量PCR检测
提取转基因烟草总RNA反转录为cDNA后进行实时荧光定量PCR检测(见图4),以表达量最低的转基因株系L1为参照,各转基因株系相对表达量如图所示。其中L4、L6、L7、L10、L11、L17转基因株系表达量最高;L3、L5、L8、L13、L14、L15、L16表达量低于以上株系;L2、L9、L12转基因株系表达量最低。
2.5 转基因植株的株高和叶片观察
选取目的基因表达量高的4个转基因株系(L4、L6、L10、L17)及野生型烟草移至温室后观察3月龄烟草土培苗表型,结果显示,在营养生长旺盛的时期,转基因烟草株高明显低于野生型(见图5A),并且相较于野生型烟草,转基因烟草相同部位的叶片出现性状差异(见图5B,C),分别测量烟草不同株系第6、9、10、11、12片叶的叶长和叶宽,进行数据分析,结果如图6所示,转基因烟草株系叶长与野生型烟草相比无明显差异,L6、L10叶宽在第6片叶具有显著差异,L17叶宽在第9片叶具有显著差异。
2.6 转基因烟草叶片细胞形态分析
光学显微镜观察转基因烟草及野生型相同部位的叶片表皮细胞,结果如图7,相较野生型烟草叶片表皮细胞,转基因烟草L6、L10叶片表皮细胞变小,L4、L17表皮细胞与野生型植株差异不大。
2.7 转基因植株的叶绿素含量的测定
测定转基因烟草和野生型烟草相同部位叶片的叶绿素含量,结果显示:L4、L6、L10、L17等4个转基因烟草株系中叶绿素含量均高于野生型,如图8所示。
3 讨论
HD-Zip转录因子基于蛋白质结构和功能可分为4个亚家族,HD-ZipⅠ亚家族在光信号转导、 非
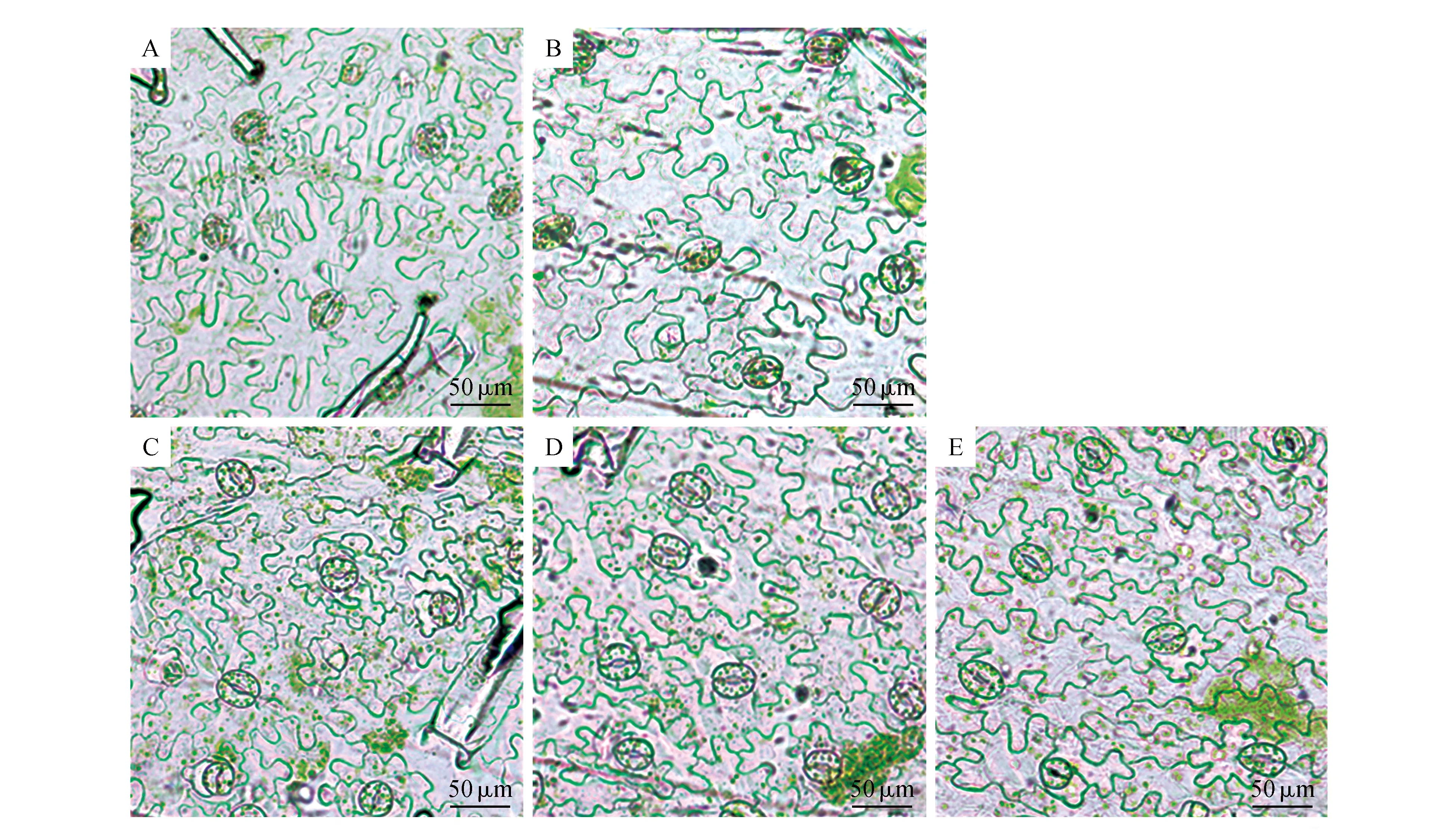
图7 转基因烟草叶片表皮细胞的观察 A.野生型烟草叶片表皮细胞;B~E.分别为转基因烟草L4、L6、L10、L17叶片表皮细胞Fig.7 Observation of epidermal cells in transgenic tobacco leaves A.Leaf epidermal cells of wild type tobacco; B-E.Leaf epidermal cells of transgenic tobacco L4,L6,L10 and L17

图8 转基因烟草叶绿素含量的测定Fig.8 Determination of chlorophyll content in transgenic tobacco
生物胁迫、叶片发育等方面具有重要作用。HB22转录因子作为HD-ZipⅠ家族的成员之一,具有重要作用。有研究表明,在拟南芥中,HB22基因可能通过赤霉素信号转导来延长种子寿命[22],也可能与CRY1基因互作介导蓝光响应[23]。
叶片是植物中的主要光合器官,具有很高的发育可塑性[24]。尽管叶片大小和形状的改变对于植物存活极其重要,但是植物调控叶片发育的分子机制尚未完全清楚。有报道指出,如I类KNOX家族蛋白、ASYMMETRIC LEAVES1(AS1)、AS2、III类同源域—亮氨酸拉链蛋白、AUXIN RESPONSE FACTOR3(ARF3)、ARF4,KANADI、YABBY家族蛋白及ANGUSTIFOLIA3蛋白等均参与调节了叶片发育的不同阶段[25]。
HD-ZipⅠ亚家族中,ATHB13在转基因植物中的组成型高水平表达导致子叶和叶片发育发生改变,与野生型相比,特别是在含有可代谢糖的培养基上,转基因植物的子叶和叶片更狭窄,提示ATHB13是蔗糖信号通路的组成部分[26];烟草中ATHB1异位表达的影响已被解释为ATHB1可能参与了叶片发育的控制过程[27];ATHB7在转基因拟南芥中组成型高水平表达时,会成为缺水条件下充当花序和叶细胞伸长的负调节剂,导致植物表型的改变[28]。关于HD-ZipⅠ类3个基因的已知功能注释表明,这些基因在生长过程中控制了特定细胞类型的发育。结合本试验数据显示,PsnHB22基因可能在植物发育中充当了伸长叶片的调节剂。
本试验为探究PsnHB22基因的功能,从小黑杨中克隆得到PsnHB22基因,遗传转化烟草并进行转基因植株的生物学特性研究。研究表明,在营养生长旺盛时期,转基因烟草长势较弱,株高明显低于野生型;部分转基因株系叶片狭窄,与野生型相比具有显著差异,且这些转基因株系叶片表皮细胞相较野生型表皮细胞变小;转基因烟草叶绿素含量显著高于野生型,这与前人研究结果相一致[29]。由此推测PsnHB22基因在植株株高生长、光合作用及叶片的形态建成等过程中起着重要的作用,我们将在后续实验中对PsnHB22基因行使功能的具体机制进行更加深入的研究。
——一道江苏高考题的奥秘解读和拓展

