快速制备鼻腔给予LPS诱导帕金森病动物模型及评价①
宋国斌 席国萍 李艳花 尉杰忠 刘春云 李凯军 柴 智 马媛媛 肖保国 张光先 马存根
(山西大同大学脑科学研究所,神经炎症变性疾病基础与应用研究山西省重点实验室,大同 037009)
帕金森病(Parkinson′s disease,PD)又名震颤麻痹,是仅次于阿尔茨海默病(Alzheimer′s disease,AD)的第二大神经系统变性疾病,主要病理特征为黑质多巴胺能神经元变性、缺失,黑质多巴胺能神经元胞质内以α-突触核蛋白为主要成分的嗜酸性路易小体(lewy body,LB)的形成及黑质-纹状体通路以多巴胺(dopamine,DA)为代表的单胺类神经递质的减少[1-4]。研究表明,炎症在PD的发病中起重要作用,脑内小胶质细胞(microglia,MG)介导的炎症反应与PD存在重要联系[5-8]。脂多糖(lipopolysa-ccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,可通过激活MG来刺激机体产生炎症反应[9,10]。研究显示,LPS可通过黑质内注射、苍白球注射、纹状体注射和腹腔注射等途经引起黑质多巴胺能神经元缺失,制备PD动物模型[11,12]。LPS经鼻腔途径给予可诱导PD动物模型,但需时5个月[13]。本研究通过LPS经鼻腔小剂量、多次给药的方式,以期加快PD动物模型的制备,缩短PD发病机制及治疗效果的研究周期。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级健康雄性C57BL/6小鼠18只,6~7月龄,体质量30~33 g,购自北京维通利华实验动物技术有限公司(动物实验遵照山西大同大学生物医学研究伦理审查委员会规定执行)。
1.1.2药物及试剂 LPS(Sigma公司);兔抗酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体(EMD Millipore公司);兔抗α-突触核蛋白抗体、二抗Anti-rabbit IgG Alexa Flour 488(Cell Signaling Technology公司);二抗HPR-goat anti-rabbit IgG(EARTH公司);显影液ECL(Life Sciences公司);辛基磺酸钠(octanesulfonic acid sodium salt,OSA)、去甲肾上腺素(norepinephrine,NE)、肾上腺素(epinephrine,E)标准品、DA标准品、3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)标准品、5-羟色胺(5-hydroxytryptamine,5-HT)标准品、5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)标准品、高香草酸(homovanillic acid,HVA)标准品(Sigma公司);OCT(Sakura Finetek公司),NaH2PO4、乙二胺四乙酸二钠(Na2·EDTA)、柠檬酸、磷酸和高氯酸均为市售分析纯。
1.1.3仪器 Agilent 1200型高效液相色谱仪(Agilent公司);色谱柱Acclaim C18 column(2.2 μmol/L,2.1 × 100 mm)、酶标仪(Thermo Fisher Scientific公司);正置荧光显微镜(Olympus公司);Bio-Rad凝胶成像分析仪(Bio-Rad公司);冰冻切片机(Leica公司)。
1.2方法
1.2.1动物处理与分组 小鼠单笼饲养,18~22℃自由饮食,并保持12 h/12 h昼夜循环,随机分为对照组和LPS模型组,每组9只。
1.2.2动物模型制备 LPS模型组小鼠鼻腔滴入LPS(3 mg/kg,生理盐水溶解)。滴入前先将小鼠用乙醚麻醉,保持小鼠头后仰,缓慢滴入LPS,保持后仰状态10~15 s,使LPS充分吸收。每侧鼻孔滴10 μl,1次/3 d,对照组鼻腔滴入等体积生理盐水,给药7周,共给药16次。
1.2.3行为学检测
1.2.3.1悬丝实验 参考文献[14-16],长100 cm的金属丝水平固定于距离地面50 cm,小鼠两前爪抓住金属丝中心位置,按以下标准评分,评分越低代表小鼠肢体协调能力越差。①小鼠后爪抓住金属丝的时间评分:0~4 s、5~9 s、10~19 s、20~39 s、≥40 s 分别记5分、4分、3分、2分、1分;②小鼠爬到金属丝任意一端的时间评分:0~39 s、40~59 s、60~99 s、100~129 s、≥130 s分别记5分、4分、3分、2分、1分;③小鼠从金属丝掉下的时间评分:没有掉下、≥120 s掉下、60~119 s掉下、20~59 s掉下、<20 s掉下分别记5分、4分、3分、2分、1分。实验前训练5次,测3次,统计累积临床评分。
1.2.3.2爬杆实验 直角三角形装置,斜边为直径2 cm、长80 cm的圆形木杆,缠双层纱布,在斜边顶端固定一方形木块(以刚好容纳小鼠为标准),斜边底端为平台。将小鼠置于斜边顶端,分别记录小鼠转头时间和小鼠爬到平台的时间。实验前训练5次,测3次,统计转头时间和爬到平台时间。
1.2.3.3步距实验 长50 cm、宽2.5 cm、高 20 cm的单向通道作为步距实验装置,通道底部铺白色硬纸,将小鼠的两后脚掌分别涂抹红蓝墨汁,放于通道入口,出口处设置暗室。实验前训练5次,测3次,统计通过通道的平均时间和平均步长。
1.2.3.4旷场实验 直径60 cm、高60 cm的圆形装置,设定外墙区、过渡区、内部中心区。通过电子成像系统记录并统计小鼠5 min内的运动距离、平均速度和休息时间[17]。
1.2.4标本采集 行为学实验之后,小鼠腹腔注射50 mg/L水合氯醛0.2 ml麻醉,生理盐水灌流。每组选6只小鼠左半脑黑质制备蛋白质匀浆,-80℃保存用于Western blot检测;右半脑黑质加入0.4 mol/L高氯酸溶液,超声匀浆、离心、制成单胺类神经递质样品液;每组剩余3只小鼠用4%多聚甲醛灌注固定,10%、20%、30%蔗糖溶液脱水,OCT包埋,小鼠黑质区冰冻切片140张(10 μm/片),用于免疫荧光染色。
1.2.5免疫荧光染色检测小鼠黑质区TH+多巴胺能神经元 取黑质区冰冻切片7张(编号分别为20、40、60、80、100、120、140),PBS洗3次,每次5 min,1% BSA-PBS溶液稀释抗TH一抗(1∶100),4℃孵育过夜;PBS洗3次,每次5 min,加入相应种属的二抗,室温避光孵育2 h,PBS洗3次,50%甘油封片。Olympus正置荧光显微镜观察抗体免疫染色活性并拍片。
1.2.6Western blot检测小鼠黑质区TH和α-突触核蛋白表达 黑质蛋白质匀浆浓度调成10 g/L,上样50 μg,SDS-PAGE垂直电泳1.5~2.0 h。 200 mA,1.5 h转PVDF膜,抗TH一抗、抗α-突触核蛋白一抗,4℃孵育过夜,TBST(含0.3%吐温的PBS溶液)洗 3次,每次5 min,辣根过氧化物酶标记的IgG二抗,室温孵育2 h,TBST洗3次,ECL显影,Bio-Rad化学发光仪采集信号,Image lab 5.2进行图像灰度分析。
1.2.7HPLC检测小鼠黑质区神经递质含量 称取标准品NE 1.25 mg,E 1.56 mg,DOPAC 1.78 mg,DA 1.03 mg,5-HT 1.34 mg,5-HIAA 1.46 mg和HVA 1.03 mg分别溶于0.1 mol/L高氯酸,制成标准品储备液,-20℃保存,使用时稀释,绘制标准曲线。色谱条件:流动相:NaH2PO4(90 mmol/L)、柠檬酸(50 mmol/L)、OSA(1.7 mmol/L)、Na2·EDTA(25 μmol/L)、5%乙腈(V/V)混合液,0.22 μmol/L微孔滤膜过滤;流速0.2 ml/min;进样量10 μl;柱温40℃;Antec电化学检测器,电压0.7 V,灵敏度为50 nA。
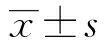
2 结果
2.1鼻腔给予LPS导致小鼠肢体协调能力降低 鼻腔给予LPS第3周开始,通过悬丝实验累积评分评估小鼠肢体协调能力。实验结果显示:3~7周,对照组小鼠悬丝实验累积评分处于相对稳定水平,LPS模型组随给药时间延长,累积评分逐渐降低,4~5周缓慢降低,6~7周急剧降低(P<0.001,图1)。给药7周后,LPS模型组累积评分(9.57±1.98)较对照组(12.38±1.53)显著降低。
2.2鼻腔给予LPS导致小鼠运动能力减弱 悬丝实验表明,给药7周后,与对照组相比,LPS模型组肢体协调能力明显减弱。爬杆实验中,LPS模型组小鼠转头时间较对照组明显延长(P<0.001),到达平台时间较对照组明显延长(P<0.001)。步距实验中,LPS模型组小鼠平均步长较对照组明显缩短(P<0.001),通过通道的时间较对照组明显增加(P<0.001)。旷场实验中,LPS模型组小鼠总运动距离较对照组明显减少(P<0.01),平均速度较对照组明显减慢(P<0.001),休息时间较对照组明显增加(P<0.01,图2)。
2.3鼻腔给予LPS诱导黑质区TH神经元变性缺失 黑质区TH免疫荧光染色结果表明,与对照组比较,LPS模型组小鼠黑质区TH阳性多巴胺能神经元数量较少(P<0.05,图3)。
2.4鼻腔给予LPS诱导黑质区TH表达减少及α-突触核蛋白表达增加 与对照组比较,LPS模型组小鼠黑质区酪氨酸羟化酶表达减少(P<0.05),与对照组比较,α-突触核蛋白表达增加(P<0.05,图4)。
2.5鼻腔给予LPS诱导黑质区神经递质及代谢产物减少 与对照组相比,LPS模型组小鼠黑质区神经递质DA浓度降低(P<0.05),DOPAC浓度降低(P<0.05),HVA浓度降低(P<0.05),NE浓度降低(P<0.05),5-HT浓度降低(P<0.05),5-HIAA浓度降低(P<0.05,图5)。
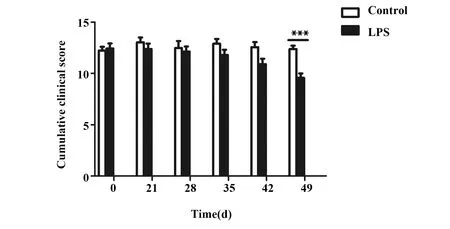
图1 小鼠肢体协调能力比较(0~7周) Fig.1 Comparison of body coordination ability of mice(0-7 weeks)Note: Compared with control group,***. P<0.001.
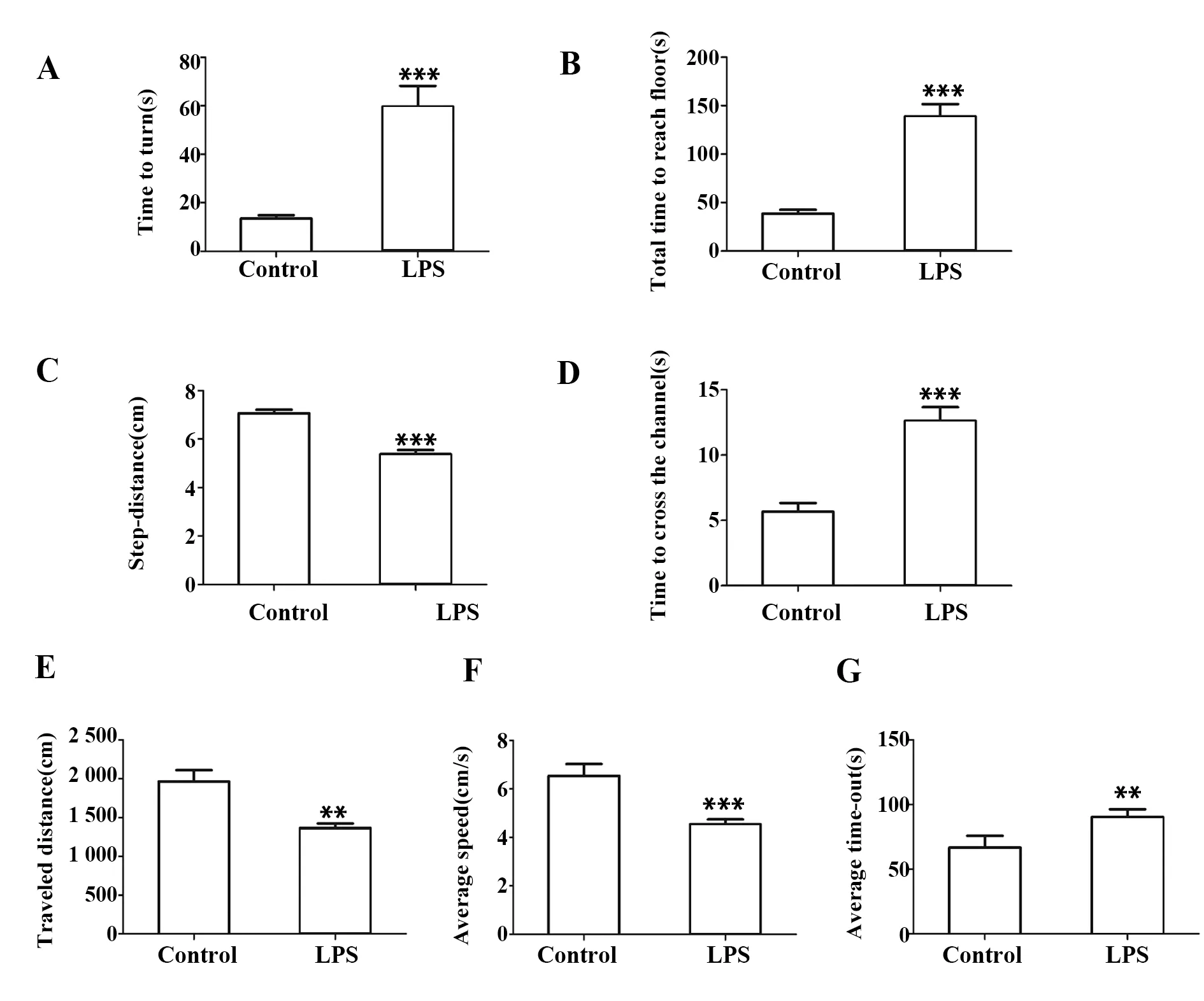
图2 小鼠运动功能比较Fig.2 Comparison of motor function of miceNote: Compared with control group,**.P<0.01,***.P<0.001.

图3 小鼠黑质区TH+多巴胺能神经元比较Fig.3 Comparison of TH+ dopaminergic neurons in substantia nigra of miceNote: Compared with control group,*.P<0.05.

图4 小鼠黑质区TH和α-突触核蛋白比较Fig.4 Comparison of TH and α-synuclein in substantia nigra of miceNote: Compared with control group,*.P<0.05.
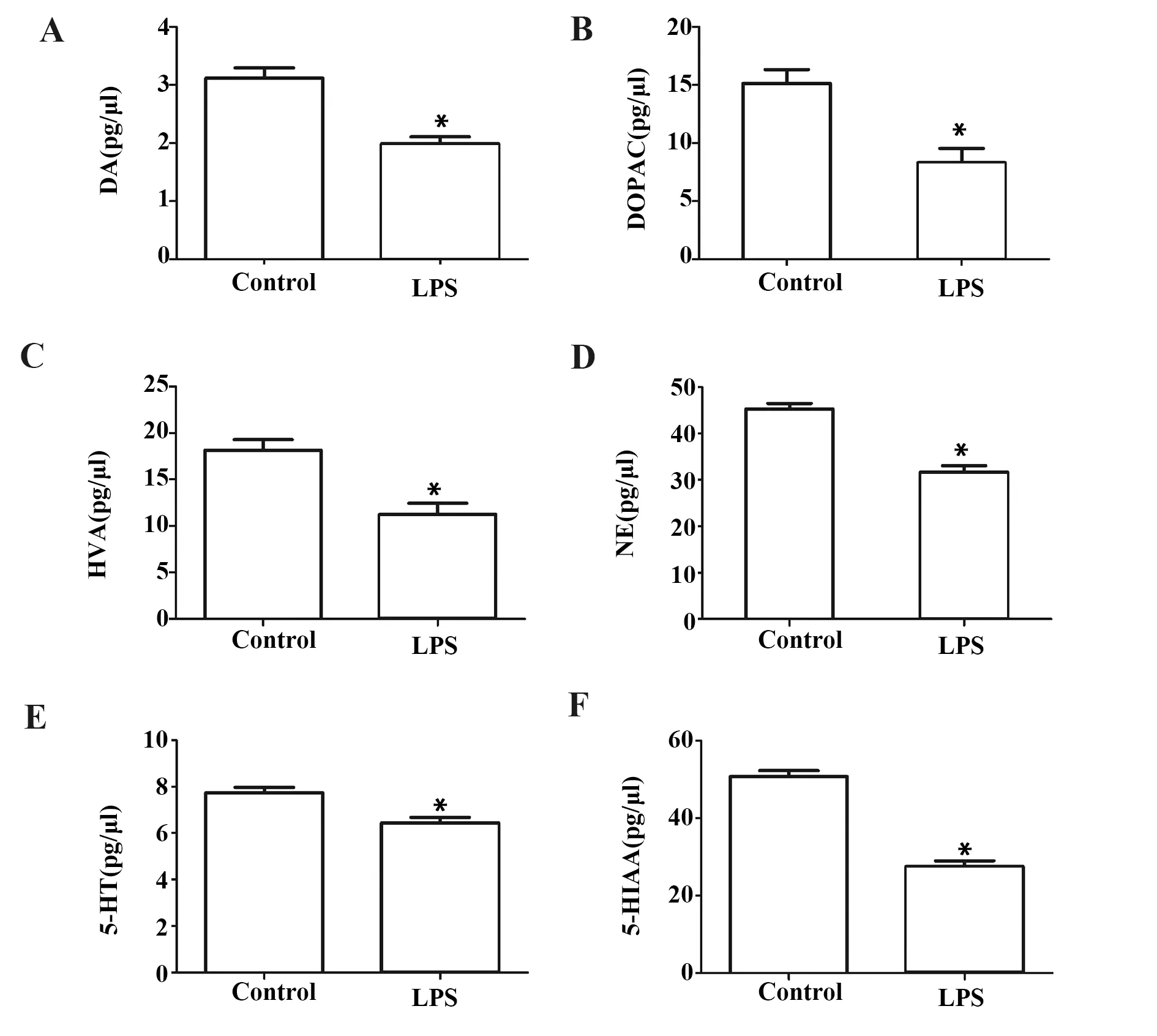
图5 小鼠黑质区神经递质比较Fig.5 Comparison of neurotransmitters in substantia nigra of miceNote: Compared with control group,*.P<0.05.
3 讨论
目前,常用的PD动物模型主要是通过神经毒素(如6-羟基多巴胺、MPTP、鱼藤酮等)诱导的神经毒素模型,给药方式通常为腹腔注射、皮下注射或脑内定点注射,但具有局限性,如6-羟多巴胺不能通过血脑屏障,脑内定点注射对脑部产生机械性损害,MPTP本身自然界不存在,且多为急性或亚急性模型,不能模拟PD渐进性发病特点,鱼藤酮模型对不同动物个体制备效果不一,重复性差。为深入研究PD的发病机制和治疗方法、改善PD患者的生活质量,构建能模拟PD渐进性发病过程、行为学特征、病理学特征的理想动物模型尤为重要[13,18-20]。
环境因素作为PD诱因之一,其机制可能是环境毒物通过口服或鼻腔暴露[13]。LPS在自然界广泛存在,可见于空气尘埃、大气污染源所含的细颗粒物,故人类经常暴露在LPS中,可经鼻直接进入脑内[21-23]。而作为内毒素的LPS,虽然对神经元无直接毒性,但可激活脑内MG,诱导免疫反应,释放大量的细胞炎症因子(TNF-α、IL-1β等)和神经毒性因子(ROS、RNS等),导致黑质-纹状体通路损坏,出现PD症状[24-27]。研究显示,脑内注射大剂量LPS,可迅速激活MG,通过炎症反应介导PD发生,但立体定向注射难度大且大剂量注射不符合PD发病的渐进性特征,通过腹腔注射LPS也能诱导PD模型,但会引起炎症反应和肝肾功能损害[11,28,29]。经鼻暴露LPS可导致嗅觉神经元缺失,与早期PD患者嗅觉减退现象相吻合,表明经鼻暴露LPS可能是制备PD动物模型的潜在途径[30]。
本研究通过小剂量、多次滴鼻给予LPS的方式,作用于C57BL/6小鼠诱导PD动物模型。给药7周后,行为学实验显示,LPS模型组小鼠肢体协调能力、步距、动作灵敏度等运动功能较对照组均明显下降,LPS滴鼻7周后,病理学显示黑质多巴胺能神经元数量明显减少、TH表达明显降低、α-突触核蛋白的表达显著增加、神经递质含量明显减少,成功建立了符合行为学及病理学特征的PD小鼠模型。这一研究结果与He等[13]采用LPS(0.5 mg/kg)隔天滴鼻,连续5个月造模的研究结果相似,但用时更短,实用性更强,可更加快捷地用于PD发病机制、病理学变化、神经递质变化及治疗方法、治疗效果的研究。

