莲雾果多糖的结构及抗氧化活性测定
汪彬慧, 陈寒青
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
莲雾(SyzygiumsamarangenseMerr.et Perry.)又名金山蒲桃、洋蒲桃、辈雾、琏雾、爪哇蒲桃、水蒲桃等,原产于马来半岛及安达曼群岛,17世纪最早由我国台湾引种栽培。由于其适应性强、经济效益佳,目前在我国台湾、广东、四川、广西和云南等省(区)均有种植。莲雾果实中含有丰富的矿物质、糖类、蛋白质、有机酸、维生素、花青素、黄酮类等多种成分,具有开胃、爽口、利尿、清热以及安神等食疗功能。同时,食用莲雾果实可以润肺、止咳、除痰、凉血、收敛,主治肺燥咳嗽、呃逆不止、痔疮出血、胃腹胀满、肠炎痢疾、糖尿病等病症[1-2]。
国内外研究也证明了莲雾具有抗菌、抗炎、免疫调节、抗氧化、降血糖、降血脂等多种生理活性[3-5], 但关于莲雾果多糖的研究甚少。因此,本文采用不同体积分数的乙醇溶液对水提莲雾果多糖进行分级醇沉,分别得到4种多糖组分,并对其进行初步化学结构表征,并通过DPPH自由基、羟基自由基清除能力和金属Fe2+离子螯合能力评价了4种多糖组分的体外抗氧化活性。
1 材料与方法
1.1 材料与试剂
新鲜的莲雾果实由中国海南省三亚市提供。
咔唑、半乳糖醛酸(北京索莱宝科技有限公司);1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picryl-hydrazyl, DPPH)、单糖标准品(Sigma Chemical Co.);抗坏血酸(上海阿拉丁生物化学技术有限公司);乙二胺四乙酸(西陇化工有限公司)。
1.2 仪器与设备
SU8020型场发射扫描电子显微镜(field emission scanning electron microscope,FESEM),日立(HITACHI);傅里叶红外光谱仪(Fourier transform infrared,FTIR),德国布鲁克;7890A气相色谱仪,安捷伦科技有限公司。
1.3 方法
1.3.1 分级醇沉多糖的制备
新鲜的莲雾果实经过清洗去皮、切片等处理后机械打浆,按1∶2比例添加蒸馏水于搅拌器中,在60 ℃条件下搅拌水提4 h,用240目尼龙滤布过滤,3 900 r/min离心10 min得提取液,滤渣再用蒸馏水在上述条件下反复提取3次,所得提取液在55 ℃旋蒸浓缩至原体积的1/4,添加无水乙醇至乙醇体积分数为30% (V乙醇/V混合溶液),在4 ℃条件下静置24 h醇沉,离心分离,沉淀物经冷冻干燥后即为30% 醇沉的莲雾果粗多糖组分WAP-30。上述所得上清液浓缩后再添加无水乙醇至乙醇体积分数为40%,4 ℃条件下静置24 h后离心,沉淀物经冷冻干燥后得到粗多糖组分WAP-40。同样地,根据以上处理方法可得到莲雾果粗多糖组分WAP-50和组分WAP-60。
1.3.2 总糖和糖醛酸质量分数的测定
采用苯酚-硫酸法[6]测定莲雾果粗多糖组分的总糖质量分数,以葡萄糖为标准,在490 nm处测定4种多糖组分的总糖质量分数;采用硫酸咔唑法[7]测定莲雾果粗多糖组分的糖醛酸质量分数,以半乳糖醛酸为标准,在523 nm处测定4种多糖组分的糖醛酸质量分数。
1.3.3 单糖组成的测定
参照文献[8]的方法,准确称取干燥至恒重的5 mg多糖样品于安培管中,加入4 mL 2 mol/L的三氟乙酸(TFA)后封口,在110 ℃条件下水解4 h。待水解液冷却后 60 ℃减压蒸干,然后加入4 mL甲醇蒸干,重复5~6次以完全除去TFA。将完全水解后的多糖样品溶解于3 mL的超纯水中,加入30 mg的NaBH4并在室温下还原3 h,通过滴加25% 乙酸来中和过量的NaBH4,直至不再有气泡产生 (pH=5~7)。然后加入4 mL甲醇继续蒸干,重复5~6次以除去水分及反应副产物,直至瓶底基本不附着固体颗粒为止,置于120 ℃烘箱中15 min,充分除去水分,迅速加入4 mL乙酸酐和3 mL吡啶,在110 ℃反应1 h。待反应液冷却至60 ℃,加入4 mL甲苯旋蒸以除去乙酸酐,重复5~6次直至蒸干。而后加入3 mL氯仿萃取乙酰化产物,再加入等体积蒸馏水洗涤氯仿层数次,取氯仿层,加入适量无水硫酸钠除去水分,离心,上清液用来进行气相色谱法(gas chromatography,GC)分析。同时对单糖标准品进行乙酰化和GC分析。
GC分析条件如下: HP-5 型石英毛细管柱(0.25 μm×320 μm×30 m);柱温采用升温程序,起始温度为50 ℃,以10 ℃/min 升至 250 ℃,进样口温度为260 ℃;He流速为1 mL/min;离子源为EI,70 eV,分子质量范围为35~650。
1.3.4 红外光谱测定
取多糖样品约3 mg,与适量干燥的KBr 粉末混匀,研磨后压片并置于Nicolet Nexus-670红外光谱仪内,在500~4 000 cm-1区间范围内进行扫描,观察谱峰情况。
1.3.5 表观形态特性
采用SU8020场发射扫描电子显微镜对4种多糖组分的表观形态进行观察[9]。
1.3.6 体外抗氧化活性的测定
(1) DPPH自由基清除能力测定。配制2 mmol/L的DPPH-无水乙醇溶液和质量浓度为0.25、0.50、1.00、2.00、3.00、4.00、5.00 g/L的多糖溶液。将2 mL多糖样品与2 mL DPPH-无水乙醇溶液混合均匀,避光处室温反应30 min。517 nm处测定吸光值,实验重复3次,以Vc为阳性对照[10]。消除率计算公式为:
清除率=[1-(A1-A2)/A0]×100%,
其中,A0为对照组吸光值(蒸馏水代替多糖溶液或Vc);A1为实验组吸光值(多糖溶液与DPPH-无水乙醇溶液混合物);A2为多糖本底比色吸光值(无水乙醇代替DPPH-无水乙醇溶液)。
(2) 羟基自由基清除能力测定。分别取0.25、0.50、1.00、2.00、3.00、4.00、5.00 g/L的多糖溶液1 mL,再向其中依次加入1 mL 9 mmol/L的FeSO4溶液、1 mL 9 mmol/L的水杨酸-乙醇溶液和1 mL 8.8 mmol/L的H2O2。摇匀后37 ℃水浴中反应1 h,510 nm处测定吸光值,实验重复3次,以Vc为阳性对照[11]。消除率计算公式为:
清除率=[1-(A1-A2)/A0]×100%,
其中,A0为对照组吸光值(蒸馏水代替多糖溶液或Vc);A1为实验组吸光值(多糖溶液与反应试剂混合物);A2为多糖本底比色吸光值(蒸馏水代替H2O2)。
(3) 金属Fe2+离子螯合能力测定。分别取0.25、0.50、1.00、2.00、3.00、4.00、5.00 g/L的多糖溶液1 mL,再向其中依次加入0.1 mL 2 mmol/L的FeCl2和3.7 mL的蒸馏水,摇匀后静置10 min,最后加入0.2 mL 5 mmol/L的菲洛嗪试剂启动反应。室温下反应10 min,562 nm处测定吸光值,实验重复3次,以EDTA为阳性对照[12]。Fe2+螯合能力计算公式为:
Fe2+螯合能力=[1-(A1-A2)/A0]×100%,
其中,A0为对照组吸光值(蒸馏水代替多糖溶液或EDTA);A1为实验组吸光值(多糖溶液与反应试剂混合物);A2为多糖本底比色吸光值(蒸馏水代替FeCl2溶液和菲洛嗪试剂)。
1.4 统计分析
所有数据经统计学分析后用(平均值±标准差)来表示,组间差异用SPSS19.0统计软件分析。
2 结果与讨论
2.1 莲雾果粗多糖中总糖和糖醛酸质量分数
根据标准曲线得到4种多糖组分WAP-30、WAP-40、WAP-50及WAP-60的总糖质量分数分别为(53.31±1.65)%、(62.49±4.89)%、(32.79±4.57)%、(44.48±1.12)%, 糖醛酸质量分数分别为(18.66±5.19)%、(6.16±2.03)%、(27.31±3.06)%、(10.87±4.06)%。
2.2 单糖组成分析
4种多糖组分经过衍生化后进行GC分析。根据单糖标准品的保留时间可以确定WAP-30、WAP-40、WAP-50及WAP-60均为杂多糖,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其摩尔比见表1所列。可以发现,组分WAP-30和WAP-40中含有大量的甘露糖,葡萄糖是组分WAP-50和WAP-60的主要单糖组成。
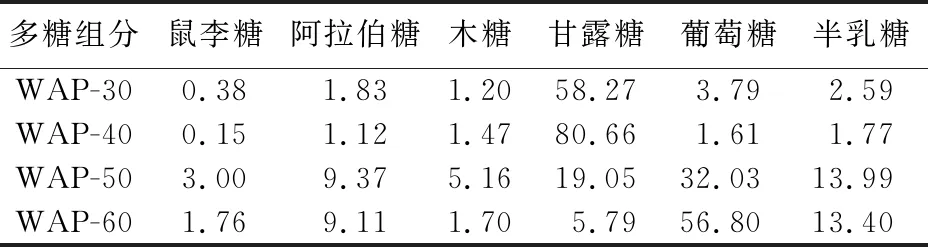
表1 4种多糖组分中的单糖摩尔比
2.3 红外光谱分析
4种多糖组分的FTIR图如图1所示。
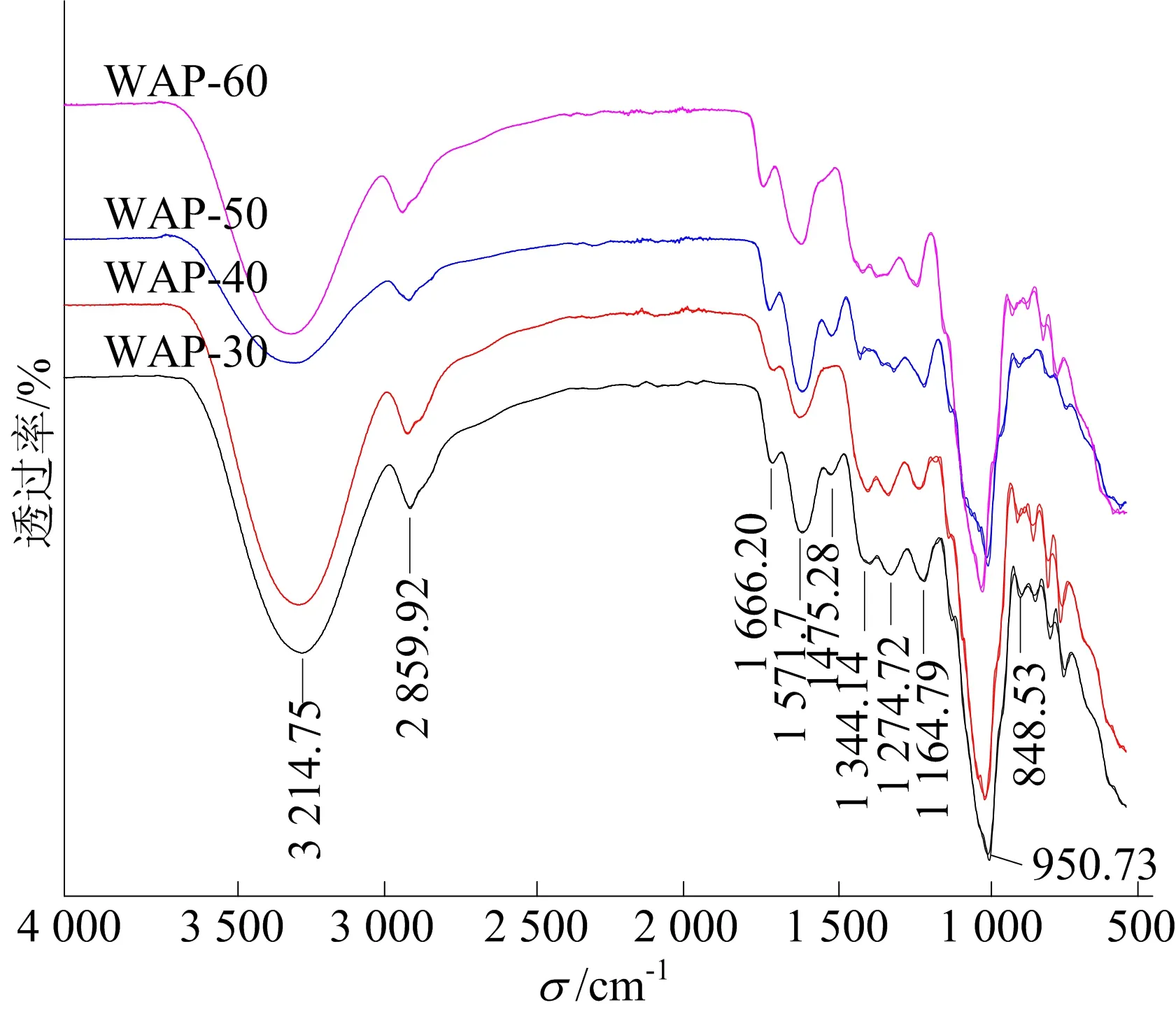
图1 4种多糖组分的FTIR图
除了频率带强度有细微的差别外,组分WAP-30、WAP-40、WAP-50及WAP-60之间基本无显著差异。在3 200~3 600 cm-1处的一个强且宽的吸收峰归因于O—H的伸缩振动。在2 860 cm-1附近出现吸收峰表明糖环上C—H键的伸缩振动。在1 666 cm-1处的吸收峰归因于C=O的伸缩振动。在1 475 cm-1处出现的吸收峰表明多糖的主链中可能含糖醛酸[13]。在1 344 cm-1和1 275 cm-1处的吸收峰分别归因于C—H和O—H的变形振动。此外,1 000~1 200 cm-1处有吸收峰表明多糖中含有吡喃C—O—C或者C—O—H的伸缩振动[14]。951 cm-1和849 cm-1处的吸收峰可能分别归因于多糖中含β-型糖苷键和α-型糖苷键[15-16]。
2.4 表观形态特性
4种多糖组分(WAP-30、WAP-40、WAP-50及WAP-60)的表观形态如图2所示。从图2可以看出,在放大倍数1 000下,4种组分均呈现出松散的薄片状,其中WAP-50组分的薄片状下方有粗糙的孔洞和裂隙。结果表明,不同体积分数的乙醇分级沉淀可能导致不同的物理变化。

图2 4种多糖组分的表观形态
2.5 体外抗氧化活性的测定
2.5.1 DPPH自由基清除能力
DPPH自由基通常被广泛应用于评估抗氧化剂清除自由基的能力,它是一种稳定的自由基,其乙醇溶液在517 nm处有最大吸收峰,呈紫色。当有自由基清除剂存在时,DPPH自由基的孤对电子被配对,紫色变浅,最大吸收波长处吸光度值也随之减小,且颜色变化与配对电子数呈剂量关系。4种多糖组分的DPPH自由基清除作用如图3所示。
从图3可以看出,质量浓度为0.25~5.00 g/L的范围内,4种多糖组分具有显著的剂量依赖效应。在质量浓度为5.00 g/L时,WAP-30、WAP-40、WAP-50及WAP-60对DPPH自由基的清除率分别达到97.09%、93.57%、92.92%、93.79%。
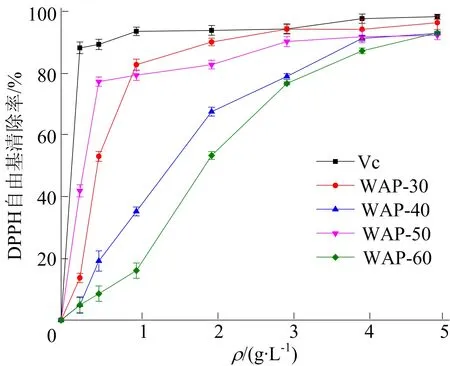
图3 4种多糖组分的DPPH自由基清除作用
2.5.2 羟基自由基清除能力
羟基自由基是生物体系内各种自由基中活性最强、危害最大的一种自由基,其可以与所有的生物大分子发生反应,从而引起生物有机体的氧化损伤。4种多糖组分的羟基自由基清除作用如图4所示。

图4 4种多糖组分的羟基自由基清除作用
由图4可知,4种多糖组分在质量浓度为0.25~3.00 g/L范围内呈现出剂量依赖效应。质量浓度为5.00 g/L时,WAP-30、WAP-40、WAP-50及WAP-60对羟基自由基的清除率分别为70.97%、80.48%、81.4%、67.35%。可以看出,在较高质量浓度时,WAP-50具有较强的羟基自由基清除活性,这可能是由于WAP-50中羧基含量较高,从而减少或消除Fenton反应中羟基自由基的生成[15]。
2.5.3 金属Fe2+离子螯合能力
金属螯合能力被认为是抗氧化机制之一,由于它降低了脂质过氧化中用于催化过渡金属的浓度。Fe2+由于其高反应性而被认为是金属离子中最强的助氧化剂,其通过Fenton反应将氢和脂质过氧化物分解成活性自由基从而加速脂质氧化[17]。本文对WAP-30、WAP-40、WAP-50及WAP-60的螯合能力进行测定并与EDTA比较,结果如图5所示。
由图5可知,4种多糖组分的金属Fe2+螯合能力随着其质量浓度的增加而增加,并呈现质量浓度依赖性。此外,WAP-40始终表现出相对较低的螯合能力。当质量浓度为5.00 g/L时,WAP-60达到最强的螯合能力(86.56%),但低于EDTA。研究表明,金属Fe2+离子螯合能力可能与其中的—OH、—SH、—COOH、—PO3H2、C=O、—NR2、—S—和—O—等官能团有关[18],因此WAP-60具有较强的螯合能力,在一定程度上可能与多糖结构中高含量的-COOH和C=O基团有关。
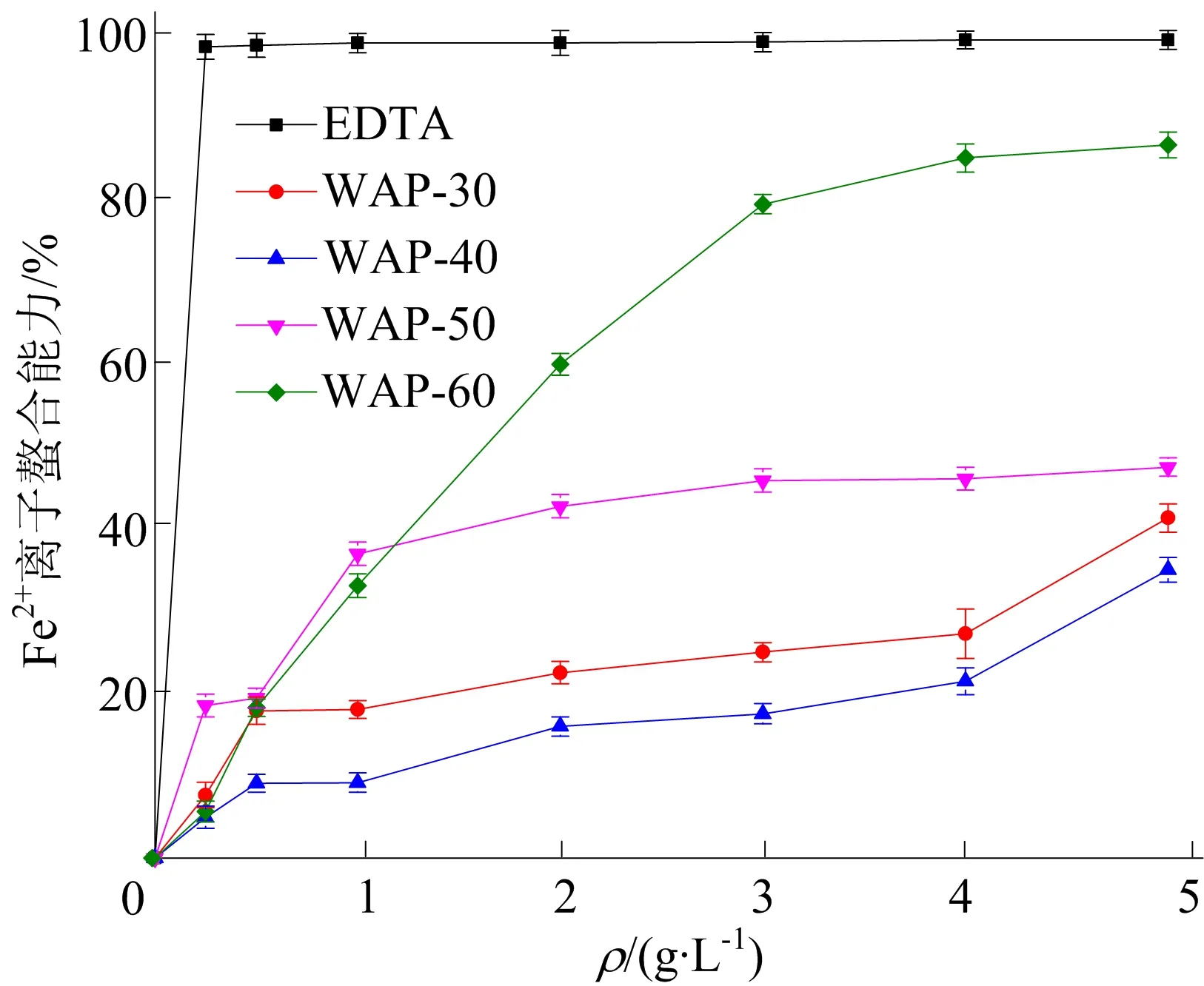
图5 4种多糖组分的金属Fe2+离子螯合能力
以上结果表明,WAP-30、WAP-40、WAP-50及WAP-60的金属Fe2+离子螯合能力可能对机体氧化损伤具有保护作用。此外,对于植物多糖来说,它们的抗氧化能力可能不是单一因素的作用,而是多种因素的相互作用或反作用,如单糖组成、糖醛酸质量分数、分子量、取代基、糖残基和链构象等[19]。因此,阐明其抗氧化活性的精确分子机制还需要进一步研究。
3 结 论
本文采用乙醇分级沉淀莲雾果多糖,并对所得4种组分(WAP-30、WAP-40、WAP-50及WAP-60)的基本结构及抗氧化活性进行了研究。结果表明,4种多糖组分的总糖质量分数分别为(53.31±1.65)%、(62.49±4.89)%、(32.79±4.57)%、(44.48±1.12)%,糖醛酸质量分数分别为(18.66±5.19)%、(6.16±2.03)%、(27.31±3.06)%、(10.87±4.06)%。4种多糖组分均由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,但它们之间的摩尔比不同。4种组分均呈现出松散的薄片状,其中WAP-50组分的薄片状下方有粗糙的孔洞和裂隙。4种组分对DPPH自由基、羟基自由基具有较强的清除能力,当质量浓度为5.00 g/L时,WAP-60对金属Fe2+离子螯合能力达到最大(86.56%),表明4种多糖组分WAP-30、WAP-40、WAP-50及WAP-60具有一定的抗氧化活性。

