纳米Pt修饰电极碱性条件下甲醇电化学氧化研究
周雨晨,金葆康
(安徽大学 化学化工学院,安徽 合肥 230601)
甲醇是一种有望改变传统能源形式的新型绿色能源[1],因此如何更有效地催化氧化甲醇并掌握其在不同介质中的机理,是一直以来的研究热点.Zhou等[2]利用红外显微镜与红外光谱仪结合的快扫时间分辨显微镜红外反射光谱(RS-TR-MFTIRS)与制备的玻微电极研究了在碱性介质中甲醇的氧化过程,其中包括中间体COL与甲酸盐离子.林珩等[3]利用原位FTIR检测到甲醇在碱性介质中氧化的最终产物是CO2和CO32-,中间体是HCOO-.Housmans等[4]报道了甲醇在酸性体系中分解产生可溶性中间体与CO的过程与Pt的晶体结构有很大关联.Zhu等[5]利用衰减全反射技术研究了在溅射Pt膜电极上的甲醇氧化反应,在酸性溶液中,提出了在低电位区甲醇氧化为甲酰类物质、线型CO与桥联CO,而在高电位区甲醇氧化的机理则为CO与HCOOH平行路线.
纳米Pt良好的导电能力以及优异的催化活性使它成为一种被广泛用于甲醇催化氧化的贵金属纳米材料[6].迄今为止,纳米Pt的制备方法层出不穷,如浸渍、微乳液[7-9],其中电沉积Pt是一种高效且便捷的制备纳米Pt的方式[10-14],而大部分Pt的电沉积都是在含有铂盐的酸性电解液中进行的[15-16], Hartini等[17]研究了铂盐中Pt的沉积过程和沉积机理.
在应用方面,Pei等[18]用纳米Pt修饰多孔金电极制备出了高灵敏度的电化学传感器,用于对水合肼的检测.Amin等[19]利用纳米Pt与CuO复合物在酸性体系中电催化氧化甲醇,观察到很高的催化活性与很低程度的表面中毒.Kim等[20]利用Pt纳米粒子与多孔金电极制备了达到9.6 mA·mmol-1·cm-2高灵敏度的甲醇微型传感器,响应时间低于10 s.Zhao等[21]利用石墨化的纳米金刚石与纳米Pt、二氧化钛合成了具有高甲醇催化氧化活性的稳定催化剂.
现场红外光谱、循环伏吸法(CVA)与导数循环伏吸法(DCVA)[22-23]是研究界面物质反应机理的重要手段.能够捕获电化学过程中反应物与生成物的信息,并对复杂的反应过程有一定指示作用.
笔者通过电沉积法制备纳米Pt修饰电极,并利用循环伏安法(CV)、电化学阻抗(EIS)、现场红外光谱技术、CVA与DCVA对甲醇在碱性体系中的电催化氧化进行研究,并借助甲酸氧化机理的研究深入理解修饰电极上甲醇的电化学氧化机理.
1 实验部分
1.1 实验试剂与仪器
氮气(纯度≥99.9%)、二氧化碳(纯度≥99.99%),南京上元工业气体厂;无水甲醇、甲酸、高氯酸,均为分析纯,国药集团化学试剂有限公司;氢氧化钠颗粒(分析纯),天津市大茂化学试剂厂;氯化钾(纯度≥99.5%)、氯亚铂酸钾(纯度≥98%),上海麦克林生化科技有限公司;蒸馏水,实验室自制.
电化学工作站,CHI630E,上海辰华仪器有限公司;FTIR红外光谱仪,Nicolet is50,美国Nicolet公司;电子天平,FA2004B,上海精密科学仪器有限公司;超声波清洗器,KQ2200DE,昆山市超声仪器有限公司;扫描发射式扫描电镜,S-4800,Hitachi公司.
1.2 电极的制备
玻碳电极(GCE)和Pt电极分别在0.2 μmol与0.05 μmol氧化铝浆料的麂皮上抛光20 min,并用去离子水与乙醇清洗,之后用氮气吹干备用.修饰电极是用配置1 mol HClO4与0.005 mol K2PtCl4水溶液作为电镀液,在-0.2 V到+0.9 V电位区间用循环伏安法电沉积得到,制备出的修饰电极标记为PtNP/GCE.
1.3 电化学实验
电化学实验采用CHI630E电化学工作站循环伏安测试技术,采用三电极体系,用Pt丝作对电极,自制Ag/AgCl电极作参比电极.
1.4 红外光谱实验
现场红外光谱实验用Nicolet is50红外光谱仪,在自制的薄层池[24]中,以CaF2为红外光窗,分辨率16 cm-1,由32张干涉图叠加得到现场红外谱图,并用Grams/3D软件对其进行处理.
2 结果与讨论
2.1 修饰电极的优化与表征
采用循环伏安法制备PtNP/GCE电极,考察了电沉积纳米Pt时电位扫描速度及循环扫描圈数对PtNP/GCE电极的电化学氧化甲醇性能的影响,结果如图1所示.
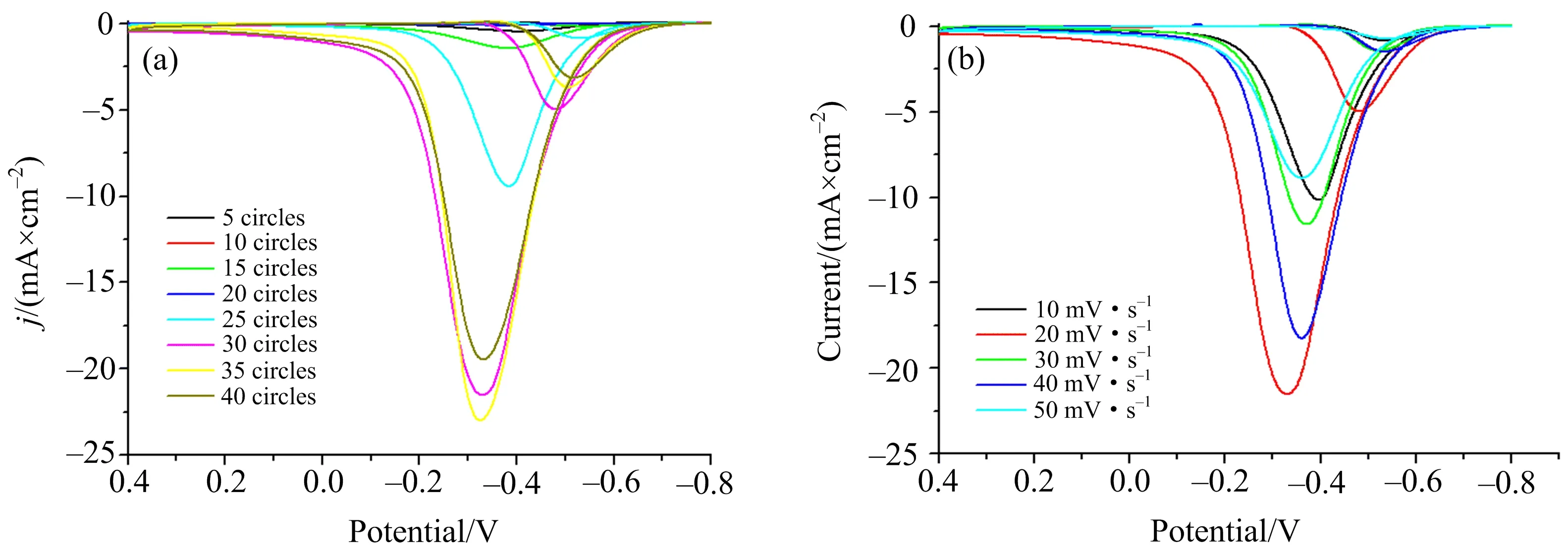
(a)沉积电位扫描速率20 mV·s-1下沉积不同圈数制备的PtNP/GCE,(b)不同扫数下电沉积制备的PtNP/GCE(35圈);CV扫速为10 mV·s-1. 图1 修饰电极在4 M CH3OH与0.5 M NaOH的水溶液中的电氧化CV
从图1(a)可以观察到沉积到35圈时,该PtNP/GCE对甲醇的氧化电流密度最大.由图1(b)可以观察到在扫速20 mV·s-1时,对甲醇氧化的电流密度最大.因此确定35圈、20 mV·s-1为最优电沉积条件,用该条件下电沉积的PtNP/GCE作为工作电极进行后续实验.
图2是Pt电极、GCE电极以及PtNP/GCE电极的阻抗,PtNP/GCE电极的SEM以及PtNP/GCE的EDS.
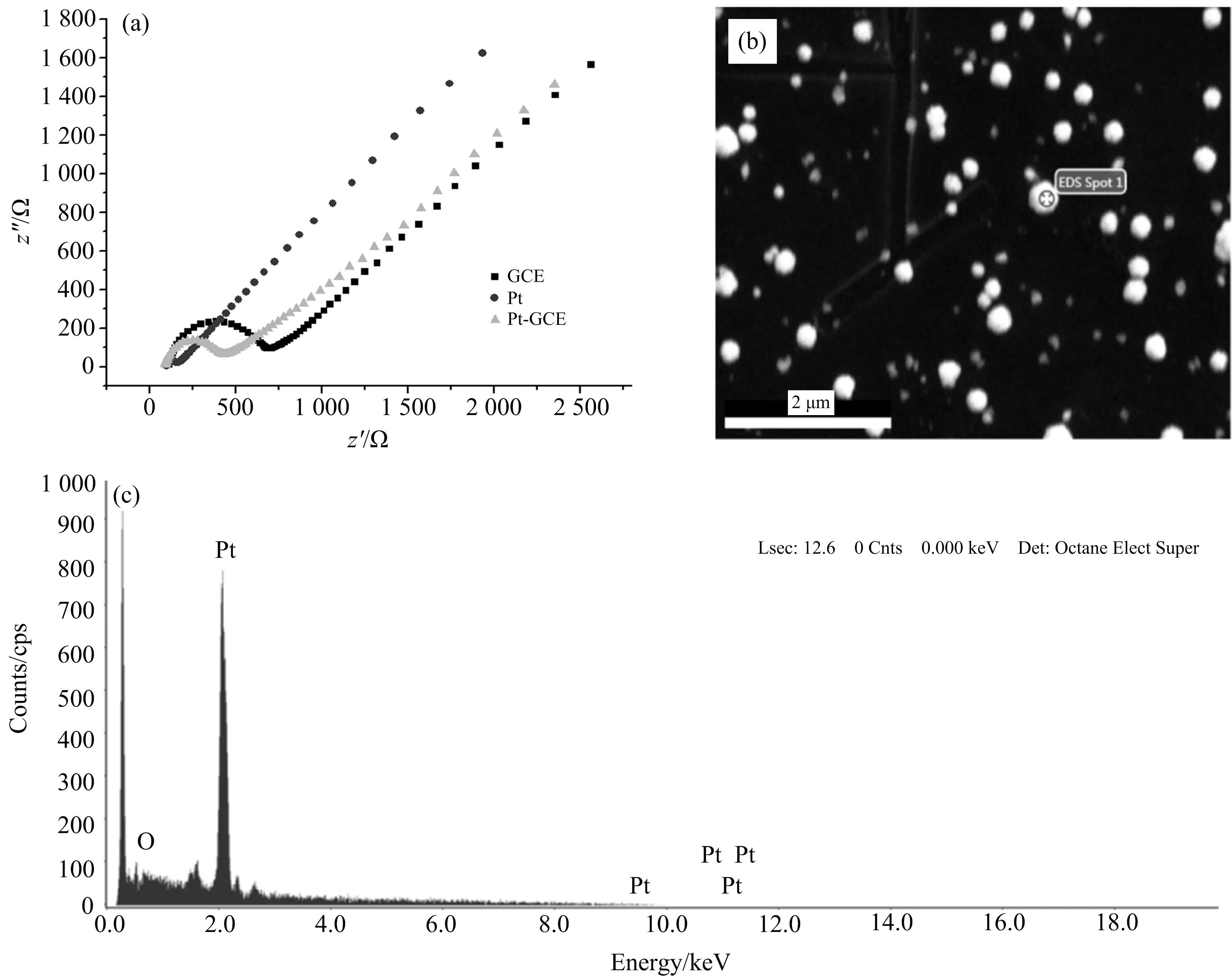
图2 Pt电极、GCE电极、PtNP/GCE电极的阻抗(a)以及PtNP/GCE电极的SEM(b)和EDS(c)
在图2(a)的阻抗谱图(EIS)中,半圆的直径表示电荷转移电阻的大小.从图2(a)中可以直观地看出,半圆直径从大到小依次为GCE,PtNP/GCE,Pt,表明Pt电极上电荷转移电阻最小,即拥有最高的电子传递速率,GCE的EIS半圆直径最大,电子传递速率最慢,但修饰了纳米Pt之后的PtNP/GCE则比GCE拥有更快的电子传递速率.由图2(b)可以看出,Pt均匀地沉积在玻碳电极表面,大小为200 nm左右.图2(c)表明在电极表面均匀分布的纳米颗粒是Pt单质.
2.2 甲醇的电化学氧化
图3是Pt电极、GCE电极及PtNP/GCE电极在0.5 mol NaOH碱性水溶液中对4 mol CH3OH的氧化CV图.

图3 Pt电极、GCE电极与PtNP/GCE电极上4 mol CH3OH在0.5 mol NaOH水溶液中的电氧化CV(扫速10 mV·s-1)
由图3可知,在GC电极上,几乎观察不到CH3OH的氧化峰电流;而在Pt电极与PtNP/GCE电极上可以观察到明显的甲醇氧化峰,其氧化峰电位基本一致.甲醇的第一个氧化峰出现在正向扫描过程中,从-0.6 V左右开始,到-0.34 V左右出现峰值.PtNP/GCE电极上第一个氧化峰的峰电流密度近50 mA·cm-2,而Pt电极上只有12 mA·cm-2左右.甲醇的第二个氧化峰出现在负向扫描中,起峰位置在-0.4 V,到-0.5 V左右达到峰值.在PtNP/GCE电极上,第二个氧化峰电流密度在12 mA·cm-2左右,而Pt电极上的只有3 mA·cm-2左右.PtNP/GCE上的电流密度明显较Pt电极上的大5倍多,表明纳米Pt修饰电极较Pt电极对甲醇具有更好的电催化氧化性能.
2.3 甲醇的现场红外光谱电化学实验
0.5 mol NaOH+4 mol CH3OH的水溶液中,Pt电极在薄层中的CV(扫速为10 mV·s-1)、3D红外图、CVA以及DCVA如图4所示.
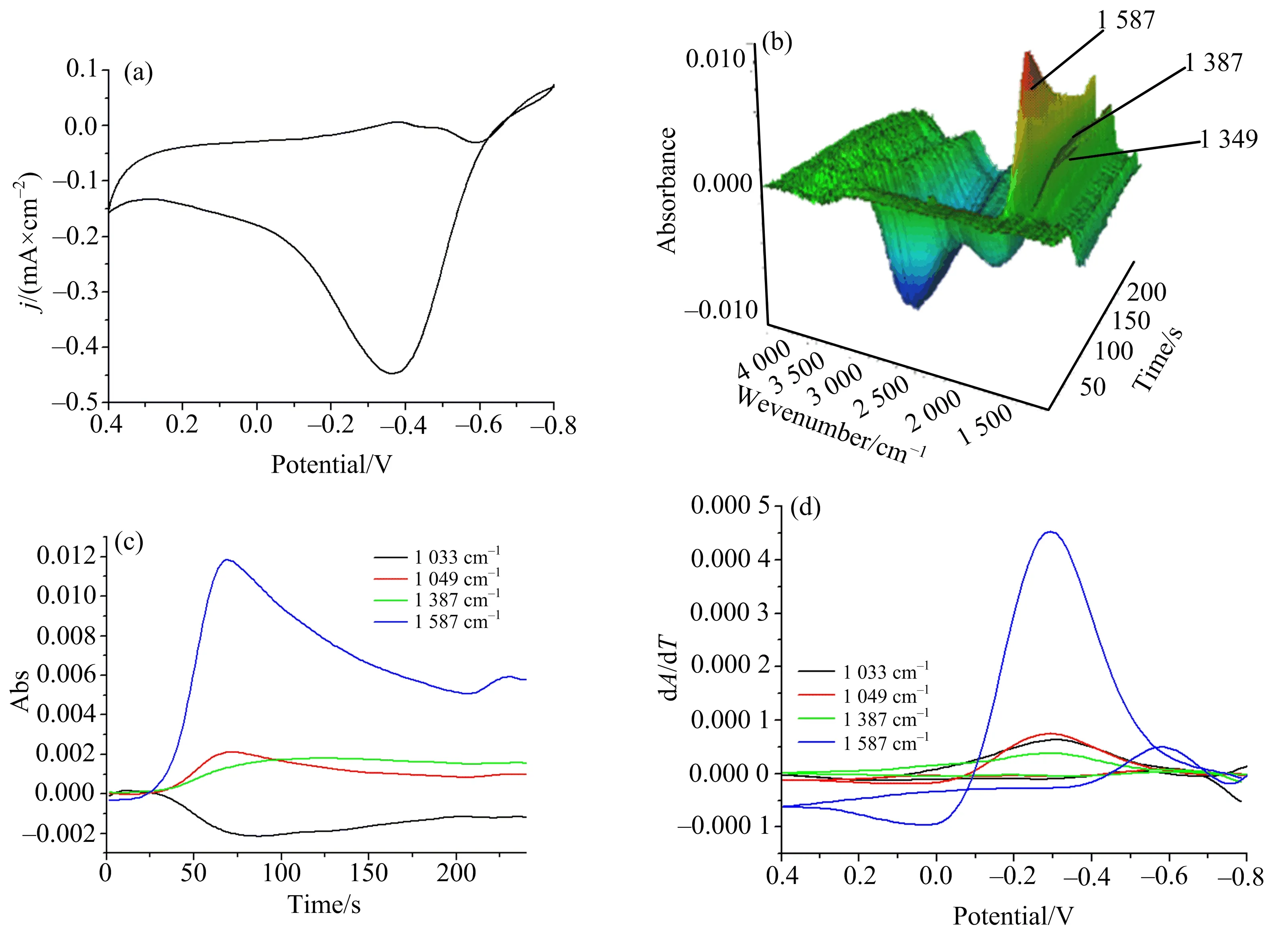
图4 0.5 mol NaOH+4 mol CH3OH的水溶液中,Pt电极在薄层中的CV(a)、3D红外图(b)、CVA(c)、DCVA(d)
图4(a)中的扫描范围为-0.8 V到0.4 V,第一个氧化峰从正扫的-0.7 V开始,峰值出现在-0.39 V左右.第二个氧化峰出现在负向扫描过程中,从-0.4 V左右开始,峰电位出现在-0.6 V.
由图4(b)的红外3D图中可以观察到典型的红外特征峰的生成(峰形向上)与消失(峰形向下).3处红外生成峰:1 349,1 387 ,1 587 cm-1,可归属于HCOO-与CO32-.还有一处小的消失峰,即1 033 cm-1,对应CH3OH中的C—O伸缩振动.1 700 cm-1到3 000 cm-1宽的消失峰,归属于水分子与甲醇分子形成氢键的O—H伸缩振动[25].具体红外特征峰归属如表1所示.甲醇的现场红外光谱电化学研究表明,甲醇在该条件下氧化生成HCOO-与CO32-.
图4(c)与(d)是图4(b)的红外3D图对应的CVA与DCVA.由图4(c)的CVA图可知,1 349 cm-1与1 587 cm-1几乎同时开始产生,但1 387 cm-1要略滞后于其他两处生成峰,可能的原因是甲醇首先被氧化生成HCOO-,随后进一步氧化为CO32-.在图4(d)的DCVA中,1 587,1 387 ,1 349 cm-13处生成峰与1 033 cm-1处的消失峰同时达到最大增速,且1 587 cm-1与1 349 cm-1在一段时间后出现负增长,进一步证实了在碱性体系中,Pt电极上电氧化甲醇的过程为CH3OH→HCOO-→CO32-.在该体系下,并没有观察到毒化的中间体CO.

表1 碱性体系甲醇的氧化过程中红外吸收峰归属
图5(a)是薄层中4 mol甲醇在PtNP/GCE电极上的CV图,图5(b)是在图5(a)所示的电化学过程中的红外3D图.

图5 0.5 mol NaOH水溶液中PtNP/GCE电极在薄层中对4 mol甲醇氧化的 CV(10 mV·s-1)(a)、3D红外图(b)、CVA(c)、DCVA(d)
由图5(a)对比图4(a)可以发现,修饰电极上甲醇的氧化电流密度增大约10倍,而氧化峰电位明显正移.电流密度增加,表明在修饰电极上,甲醇的氧化速度加快;而氧化电位正移,可能是由于薄层池中溶液阻抗较大的原因(半无限扩散条件下,修饰电极上的氧化峰电位与Pt电极上的无显著区别).
图5(b)的红外3D图,与Pt电极上的红外3D图不同,此处可以观察到非常强的2 341 cm-1处的红外生成峰,归属于CO2的不对称伸缩振动.表明在PtNP/GCE电极上生成了大量的CO2.由图5(c)的CVA图可以观察到,随着1 033 cm-1处峰的消失,1 349,1 379,1 587 cm-13处的峰率先生成,其中1 587 cm-1与1 349 cm-1处的峰要略快于1 379 cm-1处的生成峰,说明甲醇首先生成HCOO-,然后迅速转化为CO32-.一段时间后1 587,1 379,1 349 cm-13处的峰开始降低,而2 341,1 110,1 633 cm-1处的峰开始生成.1 633 cm-1对应HCO3-,2 341 cm-1对应CO2,说明甲醇转化为HCOO-与CO32-之后,HCOO-与CO32-又转化为CO2与HCO3-.图5(c)显示,2 341 cm-1处的红外吸收峰生成一段时间后又有略微减少,表明部分CO2又被转化,这可能是因为薄层外的OH-又扩散到电极表面然后与部分CO2发生了反应.由图5(d)的DCVA图可知,1 587 cm-1与1 379 cm-1首先达到最大生成速度,之后是1 633 cm-1,最后才是2 341 cm-1,证实了甲醇首先转化为HCOO-与CO32-,之后转化为CO2与HCO3-,最后少量CO2又被扩散到薄层内的OH-消耗.因此碱性体系中甲醇在PtNP/GCE电极上的电氧化过程为
CH3OH→HCOO-→CO32-→CO2→HCO3-.
相同体系下,Pt与PtNP/GCE电极上甲醇电化学氧化产物有明显的不同,在PtNP/GCE电极上能够观察到大量CO2的生成,而在相同的条件下Pt电极上却未能观察到.这可能是PtNP/GCE电极上电化学氧化甲醇生成CO2的速度要远高于Pt电极上的氧化速度.在Pt电极上的电化学氧化生成的CO2迅速被溶液中的OH-吸收生成CO32-;而在PtNP/GCE电极上生成的CO2先转化为CO32-,随后过量的CO2又生成HCO3-,最后观察到CO2自身的红外吸收峰.电化学氧化甲醇先生成甲酸,随后再进一步氧化生成CO32-(CO2),那么,修饰电极PtNP/GCE催化的是第一步氧化过程还是第二步氧化过程?或是对两步氧化过程均有催化作用?
2.4 甲酸的现场红外光谱实验
为了进一步探究修饰电极上甲醇的氧化过程,开展甲酸的电化学氧化研究.图6(a)为Pt电极在薄层池里0.5 mol NaOH水溶液中对4 mol甲酸的氧化CV(扫速为10 mV·s-1),图6(b)和(c)分别是图6(a)的电化学过程的红外3D图、部分红外特征峰对应的CVA图.
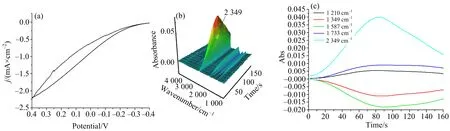
图6 0.5 mol NaOH水溶液中Pt电极在薄层中对4 mol甲酸氧化的CV(a)、3D红外图(b)、 CVA(c)
由图6(a)可知,在Pt电极上没有观察到明显的氧化峰,只有随着电位正移,氧化电流不断增大.在图6(b)可以观察到甲酸在该体系中,有2个明显的消失峰,即1 349,1 587 cm-1,对应HCOO-,表明随着电位正向扫描,HCOO-不断减少.在图6(b)中同时观察到CO2对应的2 349 cm-1处的生成峰,此外还有1 733 cm-1与1 210 cm-1处的生成峰,对应羰基的伸缩振动,可能是C2O42-和HCO3-的存在而致.从图6(c)的CVA可以看出,甲酸在反应中随着电位的正移生成了CO2,在0.4 V达到最大值,之后随着电位负移CO2又被转化.这与之前PtNP/GCE电极上得出的甲醇转化过程一致,即甲醇在转化为HCOO-之后,HCOO-又转化为CO2.
PtNP/GCE上甲酸的电化学氧化结果如图7所示,其中CV的扫速为10 mV·s-1.
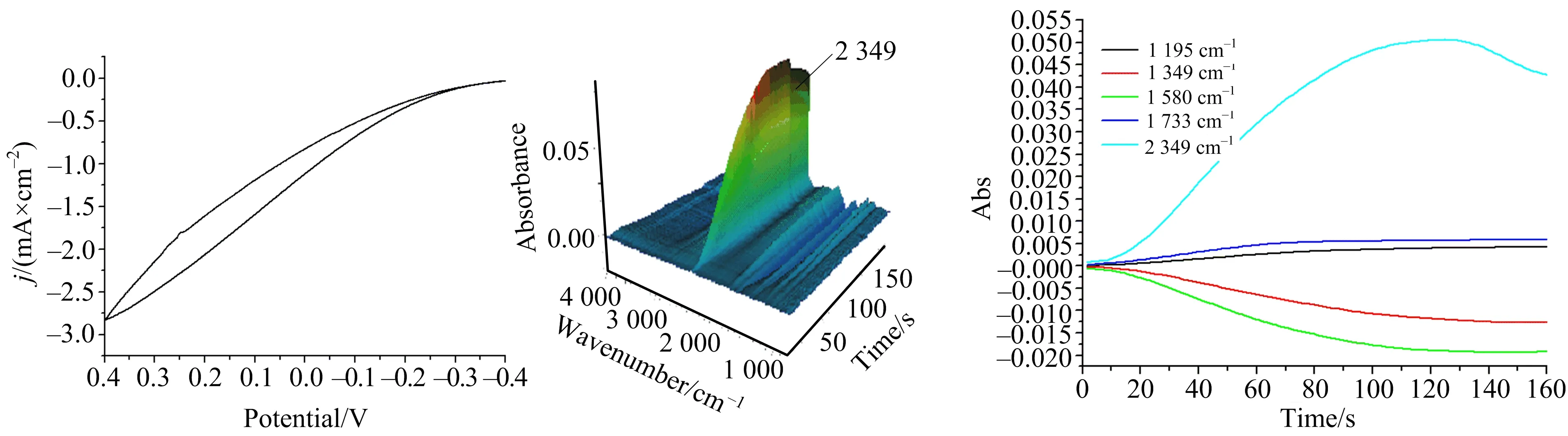
图7 0.5 mol NaOH水溶液中PtNP/GCE电极在薄层中对4 mol甲酸氧化的CV(a)、3D红外图(b)和CVA(c)
图7显示,PtNP/GCE电极上4 mol甲酸在0.5 mol NaOH水溶液中的氧化CV及现场红外3D图,与在Pt电极上的基本一致.
以上结果表明,与Pt电极相比,PtNP/GCE电极对甲醇具有更好的催化氧化性能,主要是在甲醇被氧化为甲酸的这一过程中呈现出更强的催化能力.甲醇转化为甲酸后,在Pt电极或PtNP/GCE电极上都被氧化为CO2,但由于PtNP/GCE对甲醇氧化为甲酸的催化能力更强,使得在体系中能够迅速生成大量甲酸,并进一步氧化为CO2,溶液中的OH-仅能消耗部分CO2.但在Pt电极上,由于氧化生成的甲酸速度较慢,导致再进一步氧化为CO2的量较少,来不及被红外检测就与溶液中的OH-反应而消耗掉.
3 结束语
笔者在电沉积法制备的PtNP/GCE电极上,通过电化学与现场红外光谱技术,研究了甲醇在碱性条件中的电氧化行为,并与Pt电极进行比较,发现在PtNP/GCE上甲醇的氧化峰电流密度比Pt电极显著增大,说明PtNP/GCE比Pt电极具有更优异的电氧化甲醇能力.
在碱性水体系中,Pt电极上的甲醇的电氧化过程为
CH3OH+OH-→HCOO-+H2O+e-,
HCOO-+OH-→CO32-+H2O+e-.
而在相同体系中,PtNP/GCE能够氧化甲醇生成大量CO2
CH3OH+OH-→HCOO-+H2O+e-,
HCOO-+OH-→CO32-+H2O+e-,
HCOO-+OH-→CO2+H2O+e-,
CO32-+ H2O+CO2→HCO3-.
在甲酸的氧化研究中,Pt电极与PtNP/GCE电极对甲酸的氧化能力相似,说明PtNP/GCE对甲醇的催化氧化过程中,主要是催化从甲醇到甲酸这一过程.

