生防细菌ML-3抗菌蛋白发酵条件的优化及其防治应用
李静舒 赵佳
(1. 山西广播电视大学,太原 030027;2. 山西省农业科学院生物技术研究中心,太原030031)
随着马铃薯成为继水稻、小麦、玉米之后的第四大粮食作物和精深加工产业的快速发展,其种植面积在我国乃至全世界均呈现扩增趋势,但各种植区由马铃薯早疫病引起的减产现象时有发生,发生严重时减产可达70%-80%[1-2]。马铃薯早疫病是一种由茄链格孢菌(Alternaria solani)引起的世界性病害,属气传、土传多循环流行性病害,发病严重时不仅导致叶片提前枯萎,严重阻碍光合作用造成减产,而且其分生孢子适应性较强,易形成二次为害,对各地马铃薯产业健康发展具有较大影响[3-5]。为有效防治马铃薯早疫病的发生,研究者已从病原鉴定[6]、种植区病原遗传结构[1-2,7]、qPCR 快速检测方法[8-9]、致病性[10]、抗药性[11]、抗性品种筛选[12-13]、拮抗微生物筛选[14-15]和化学防治药剂筛选[16-17]等方面进行了大量研究,使得人们在一定程度上明确了该病害的典型症状、发病规律、化学防治药剂、病原检测方法和部分地区抗药性水平;了解了生物防治在该病害防治中的应用潜力。然而,由于抗性品种选育和生物防治技术开发进程缓慢,目前该病害仍以化学防治为主,但由于病原抗药性产生和部分产区病害逐年严重[18],人们不得不加大防治药剂用量或施药次数,这些化学农药的大量和不合理使用导致化学防治的弊端(农田生态结构破坏、抗病抗药性增强和农药残留等)日益突出[18]。
生物防治作为一种以生物体或其活性产物为农药的防治措施,是缓解化学防治问题的重要途径之一[19]。近年来,为突破该病害生物防治技术,国外已在植物天然产物[20]、拮抗微生物筛选及制剂[21]和壳聚糖防病[22]上开展了大量研究工作,但我国有关马铃薯早疫病的生物防治研究还较为落后,虽然杨继业等[14]、杨登路等[15]和王聪[23]对该病原的拮抗微生物和植物天然抑菌产物室内活性进行了报道,但相关结果因缺乏田间药效试验环节而不能有效证实其田间应用价值,而田间防效良好又是其制剂化之前的必要条件。因此,本研究一方面对前期筛选出的拮抗细菌ML-3产抗菌蛋白发酵培养条件进行优化,旨在为其后期工业化发酵提供参考依据;另一方面,对该抗菌蛋白的抑菌稳定性和田间防效进行测定,旨在评价该菌株抗菌蛋白的田间应用潜力,并为其后期制剂化研究和田间应用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 拮抗细菌ML-3(分离自马铃薯植株茎部)和马铃薯早疫病病原(由山西省农业科学院农产品贮藏保鲜研究所采后病理室提供)。
1.1.2 供试培养基 NA固体培养基、NB发酵液和PDA培养基配制均参照高振峰[24]描述的方法。
1.2 方法
1.2.1 基于16S rRNA序列分析的菌株ML-3分子鉴定 参照Gao等[25]描述的方法进行菌株ML-3的基因组DNA提取、16S rDNA序列扩增测序和序列比对,随后选择近缘模式菌株16S rDNA序列使用MEGA 5.0构建NJ系统发育树。
1.2.2 菌株ML-3抗菌蛋白最佳硫酸铵盐析浓度测定 (1)无菌发酵液制备:菌株ML-3经NB发酵液于30℃、160 r/min振荡培养72 h后终止发酵,12 000 r/min离心10 min去除菌体收集上清液,用于抗菌蛋白提取。(2)最佳盐析浓度筛选:取无菌发酵液1 000 mL,参照张晓宇等[26]描述的方法,逐级加入不同饱和度硫酸铵,各级硫酸铵用量分别为114 g/L(20%)、243 g/L(40%)、390 g/L(60%)、561 g/L(80%)和767 g/L(100%),并对不同饱和度下的蛋白进行提取、透析、浓缩和冷冻干燥,获得抗菌蛋白干粉后于4℃保存备用。(3)各级沉淀蛋白抑菌活性测定:以马铃薯早疫病菌为靶标,采用琼脂扩散法[27]对各级沉淀蛋白的抑菌活性进行测定,从而筛选出菌株ML-3抗菌蛋白的最佳硫酸铵沉淀饱和度。
1.2.3 拮抗细菌ML-3胞外产抗菌蛋白培养液配方优化
1.2.3.1 种子发酵液制备 于超净工作台中,用接种环挑取一环使用NA平板活化培养24 h的菌株ML-3,并将其接种于装有100 mL的NB培养液的300 mL三角瓶中,于30℃、160 r/min培养24 h,获得种子发酵液。
1.2.3.2 碳源优化 以NB为基础培养液,分别用1%的可溶性淀粉、蔗糖、甘露醇、葡萄糖、玉米粉、马铃薯作为碳源制备新培养液,灭菌后按1%的接种量,将已制备的ML-3种子液接种于不同碳源培养液中,于30℃、160 r/min震荡培养72 h,重复3次。以NB培养液为对照,分别采用比浊法[28]和琼脂扩散法[27]对菌体生长量和抗菌蛋白抑菌活性进行测定。
1.2.3.3 氮源优化 以筛选出的较优碳源作为碳源,固定无机盐,分别用1.5%的硫酸铵、尿素、酵母浸粉、蛋白胨、花生粉和黄豆粉作为氮源制备新培养液,同样按1%的接种量,将菌株ML-3种子液接种于不同氮源培养液中,于30℃、160 r/min震荡培养72 h,3次重复。以NB培养液为对照,发酵中止后测定经各培养液培养后的菌体生长量和抗菌蛋白抑菌活性。测定方法同1.2.3.2。
1.2.3.4 无机盐优化 以筛选出的较优碳源和氮源作为碳、氮源,分别用0.02% CuSO4·5H2O、0.05% MgSO4、0.1% KH2PO4、0.5% NaCl、0.02%ZnSO4·7H2O和0.02% FeSO4·7H2O作为无机盐制备新培养液,同样按1%的接种量,将菌株ML-3种子液接种于不同氮源培养液中,于30℃,160 r/min下震荡培养72 h,3次重复。以NB培养液为对照,发酵中止后测定菌体生长量和抗菌蛋白抑菌活性。测定方法同1.2.3.2。
1.2.3.5 发酵液配方正交优化 采用正交试验对单因素试验筛选出的较优碳源(马铃薯)、氮源(蛋白胨)和无机盐(NaCl)的用量组合进行三因素三水平正交试验,筛选出较优配方(表1)。以抗菌蛋白抑菌活性为评价指标,测定方法同1.2.3.2。
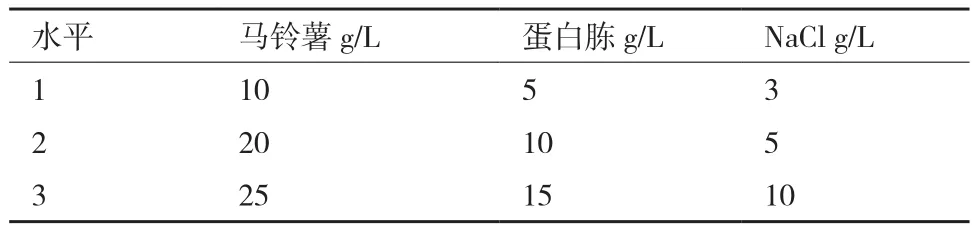
表1 发酵液配方正交试验因素和水平
1.2.4 发酵条件正交优化 采用正交试验L16(45)(表2)对菌株ML-3的发酵温度、pH、装液量和接种量进行优化。使用1 mol/L NaOH和1 mol/L HCl来调节培养液pH值,试验重复3次,发酵结束后测定抗菌蛋白抑菌活性。测定方法同碳源优化。
1.2.5 菌株ML-3抗菌蛋白抑菌稳定性测定 参照采俊香等[29]文献中描述的方法对菌株ML-3抗菌蛋白的热稳定性、紫外稳定性和酸碱稳定性进行测定。
1.2.6 菌株ML-3抗菌蛋白的马铃薯早疫病田间防效
1.2.6.1 药前准备 称取菌株ML-3抗菌蛋白干粉用水稀释后(药液浓度分别为:1 g/L、0.1 g/L、10mg/L和1 mg/L)于五台县茹村田间发病地块(马铃薯开花期)采用叶面喷施进行防效测定,以清水和80%代森锌可湿性粉剂作为对照。每处理重复3次,田间试验安排采用随机区组设计,各小区试验安排见图1。
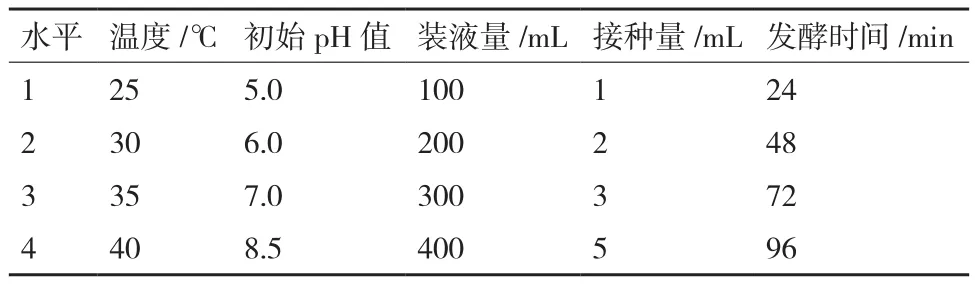
表2 发酵条件正交试验因素和水平

图1 不同浓度抗菌蛋白马铃薯早疫病田间防效小区排列图
1.2.6.2 田间试验 (1)每处理随机选择6株植株进行药前病情指数调查,分级标准参照农药田间药效试验准则GB/T 17980.28-2000;(2)于2019年7月18日首次喷药,随后每隔5 d用药1次,连续用药3次,并于最后一次用药后10 d统计药后病情指数,统计方法同药前;(3)病情指数和田间防效计算方法与赵新贝等[30]所述方法相同。
2 结果
2.1 拮抗细菌ML-3抗菌蛋白最佳硫酸铵盐析浓度
使用不同饱和度硫酸铵对菌株ML-3发酵液中的蛋白进行分级沉淀,并以马铃薯早疫病菌为靶标对各级沉淀蛋白的抑菌活性进行测定后发现,各级沉淀蛋白仅在硫酸铵质量浓度为60%-80%表现出较强抑菌活性,该级沉淀蛋白的抑菌带直径为14.5 mm,同对照粗提液抑菌活性(抑菌带为15.5 mm)相比差异较小(图2);当硫酸铵质量低于60%或高于80%所形成的蛋白沉淀均无抑菌活性;另外,对硫酸铵沉淀残留液抑菌活性进行检测后发现,其残留液无抑菌活性,再次说明菌株ML-3抗菌物质为蛋白类物质,且说明在硫酸铵饱和度为60%-80%可使菌株ML-3产生的抗菌蛋白完全沉淀,为该菌株抗菌蛋白提取的最佳硫酸铵饱和度(图2)。

图2 不同硫酸铵质量浓度下沉淀蛋白对马铃薯早疫病菌抑菌活性测定
2.2 拮抗细菌ML-3胞外产抗菌蛋白发酵液配方优化
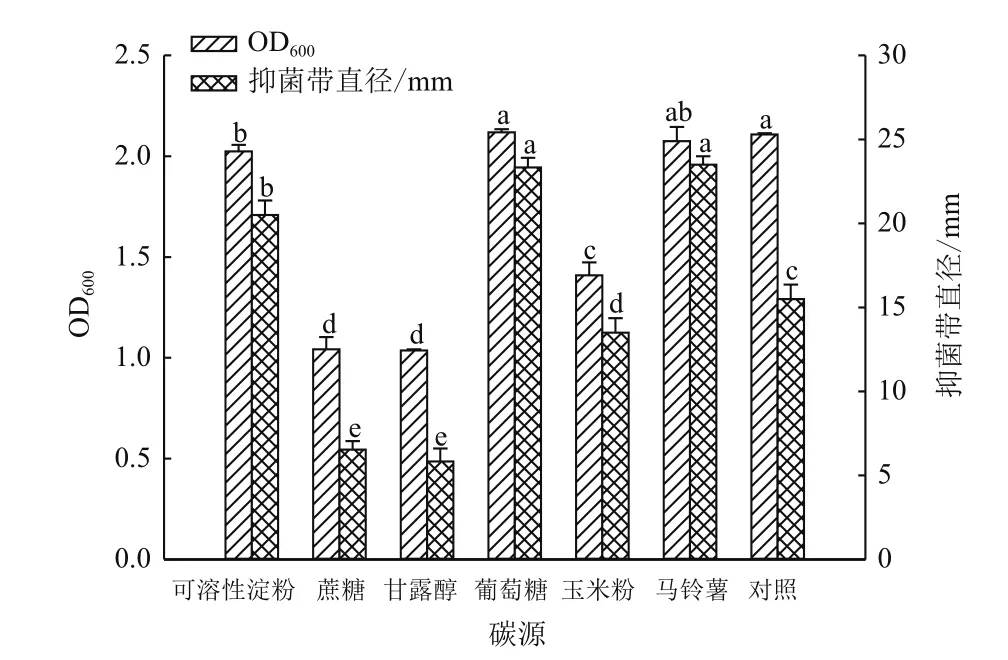
图3 不同碳源对菌株ML-3生长和抗菌物质产生的影响
2.2.1 碳源优化 对菌株ML-3产抗菌蛋白发酵液配方中的碳源进行单因素优化后发现,在抑菌效果方面,6种碳源中以马铃薯和葡萄糖效果较好,显著高于对照,且同对照NB发酵液相比,抑菌带直径分别增加了8.8 mm和7.8 mm;可溶性淀粉提高效果不明显,同对照相比差异不显著;添加蔗糖、玉米粉和甘露醇后抑菌活性反而出现一定程度下降(图3)。在菌株生长方面,6种碳源同样表现出不同效果,添加葡萄糖和马铃薯对菌株生长量无明显影响,同对照相比差异不显著,但添加其他碳源后菌株ML-3的生长则出现不同程度抑制。说明不同碳源对菌株ML-3抗菌蛋白生物合成存在不同程度影响。综合考虑成本、菌株生长量和抗菌蛋白抑菌活性后,选择低成本马铃薯作为菌株ML-3产抗菌蛋白较优碳源。
2.2.2 氮源优化 对NB发酵液中的氮源(牛肉浸膏+蛋白胨)使用其他氮源替换后发现:在碳源马铃薯介导下,单独添加氮源蛋白胨便可有效促进菌株ML-3抗菌蛋白产生,其抗菌蛋白抑菌带直径(24.2mm)显著高于对照(15.8 mm);使用其他无机或有机氮源替换NB中的氮源后抗菌蛋白抑菌活性则出现不同程度下降,其中以无机氮活性下降作为明显(图4)。在菌株生长量方面,单独添加有机氮源(蛋白胨、花生粉、黄豆粉和酵母浸粉)时对菌株ML-3生长无明显影响,但单独无机添加氮源(尿素和硫酸铵)时则对菌株ML-3生长表现出明显抑制,其OD600吸光值分别为0.509(尿素)和0.727(硫酸铵)(图3)。因此,在马铃薯介导下选择蛋白胨作为其较优氮源,同对照配方相比可提高菌株ML-3抗菌蛋白抑菌活性,而且可有效降低发酵成本。
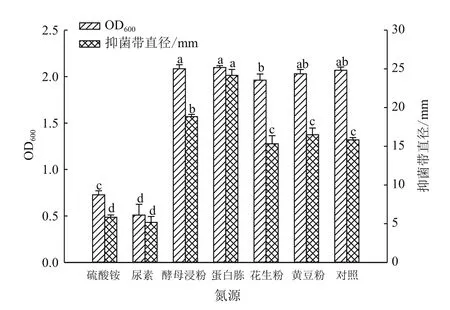
图4 不同氮源对菌株ML-3生长和抗菌物质产生的影响
2.2.3 无机盐优化 无机盐优化结果(图5)表明:虽然同对照相比无机盐0.5%NaCl、0.1%KH2PO、0.02% ZnSO4·7H2O 和 0.02% FeSO4·7H2O对菌株ML-3生长无明显影响,但在抑菌活性方面,则仅以0.5%NaCl为无机盐时菌株ML-3抗菌蛋白抑菌活性明显高于其他无机盐;菌株ML-3抑菌活性对K+、Fe2+和Zn2+稳定,而Cu2+和Mg2+则对菌株抑菌活性具有明显抑制作用。因此选择0.5%NaCl为较优无机盐。
2.2.4 正交优化 通过单因素试验明确马铃薯、蛋白胨和NaCl为菌株ML-3的最佳碳源、氮源和无机盐后,进一步使用正交试验对其进行了三因素三水平正交试验,正交试验结果(表3)显示:组合A2B1C2、A2B2C3、A1B3C3、A2B3C1、A3B2C1 以及A3B3C2之间抑菌活性差异不显著,说明单纯依靠各处理结果很难直接判断出哪个组合为最优组合,需进一步通过极差、方差以及因素间互作分析。
方差、极差和因素间互作分析结果(表4)显示:马铃薯、蛋白胨和氯化钠的F值均达极显著水平,可见该假设检验灵敏度高;从极差比较可以看出,碳源极差R值最大,是影响菌株ML-3抗菌蛋白产量的关键因子,其次为蛋白胨和NaCl(表3)。从因素各水平间差异显著性分析结果可以看出,菌株ML-3产抗菌蛋白的较优配方组合为A2B2C2(表5),且对该水平进行试验验证后发现在该配方下菌株ML-3抑菌带直径可达25.3 mm,明显高于对照,说明该配方为菌株ML-3产抗菌蛋白较优培养液制备配方。
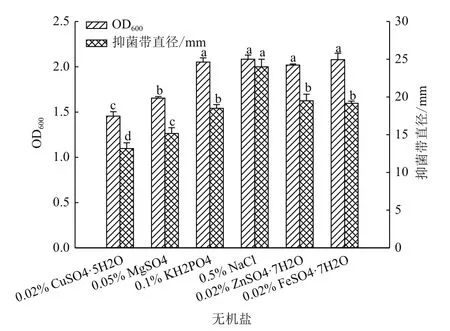
图5 不同无机盐对菌株ML-3生长和抗菌物质产生的影响
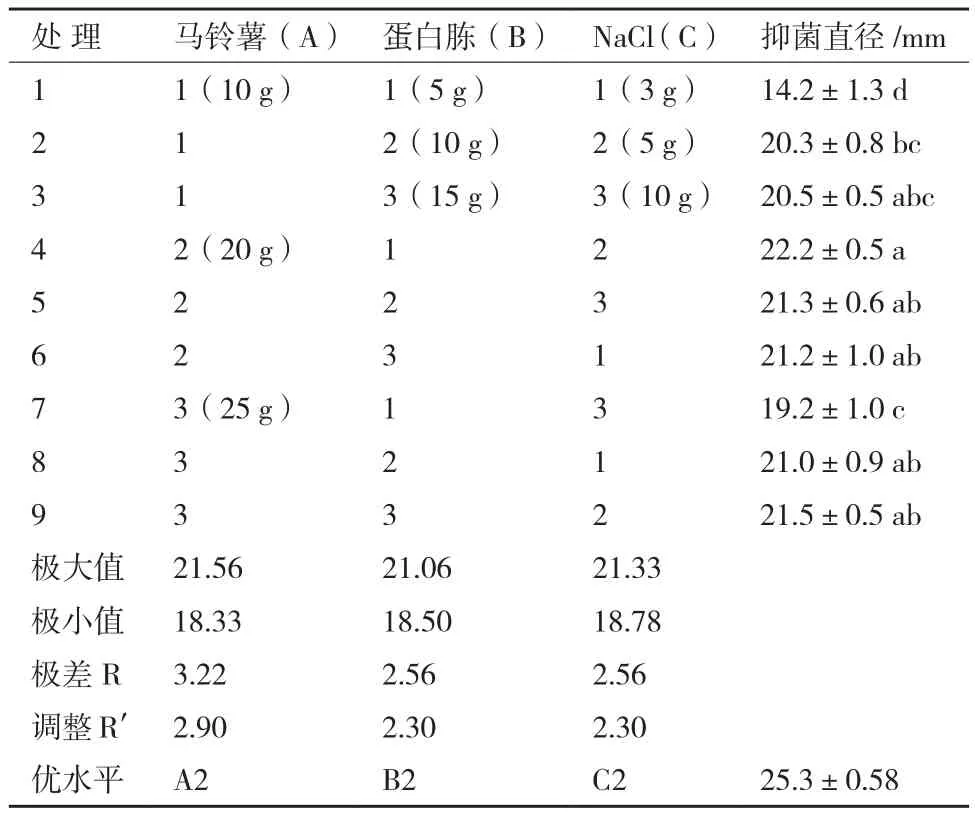
表3 发酵液配方正交试验结果
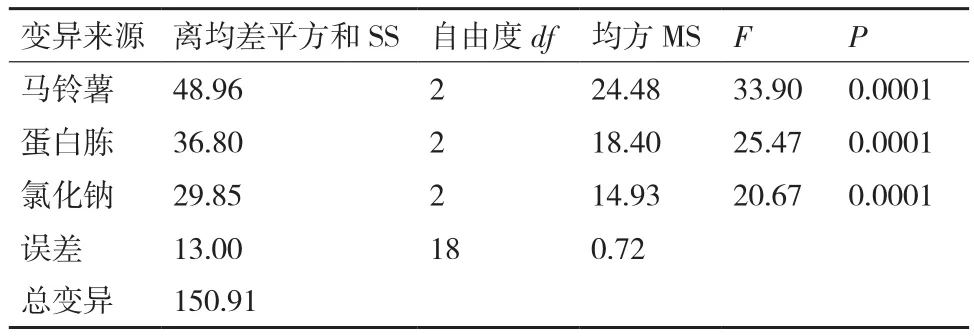
表4 三因素三水平方差分析

表5 试验因素各水平间差异显著性检验
2.3 拮抗细菌ML-3胞外产抗菌蛋白发酵条件正交优化
对菌株ML-3发酵条件进行正交试验后发现16个组合处理中以组合A2B3C4D1E2效果最好,其抑菌带直径为22.3 mm明显高于其他处理(表6)。对试验结果进行方差、极差和因素间互作分析后发现5各因素的F值均表现出差异极显著,说明该假设检验灵敏度高(表7);从极差比较可以看出,初始pH和温度极差R最大,说明初始pH和温度是影响菌株ML-3抗菌蛋白产量的关键因子,其次为发酵时间、装液量和接种量(表6)。从因素各水平间差异显著性分析结果可以看出,菌株ML-3产抗菌蛋白的较优配方组合为A2B3C4D4E2(表8),且对该水平进行试验验证后发现在该发酵条件下菌株ML-3抑菌带直径可达24.2 mm,明显高于对照,说明该条件为菌株ML-3产抗菌蛋白较优发酵条件。
2.4 抗菌蛋白稳定性测定
对菌株ML-3抗菌蛋白的热、酸碱和紫外稳定性进行分析后发现:菌株ML-3抗菌蛋白在25℃-60℃之间具有良好热稳定性,可使抑菌带直径保持在20 mm以上(图6-A);在pH范围5-8之间具有较好抑菌效果(图6-B);在紫外照射8 h内抗菌蛋白抑菌活性下降不明显,紫外照射36 h抑菌带直径仍可达19.2 mm(图6-C),说明菌株ML-3产生的抗菌蛋白具有较好的热稳定性、酸碱稳定性和紫外稳定性,有制成制剂应用于马铃薯早疫病生物防治的潜力。
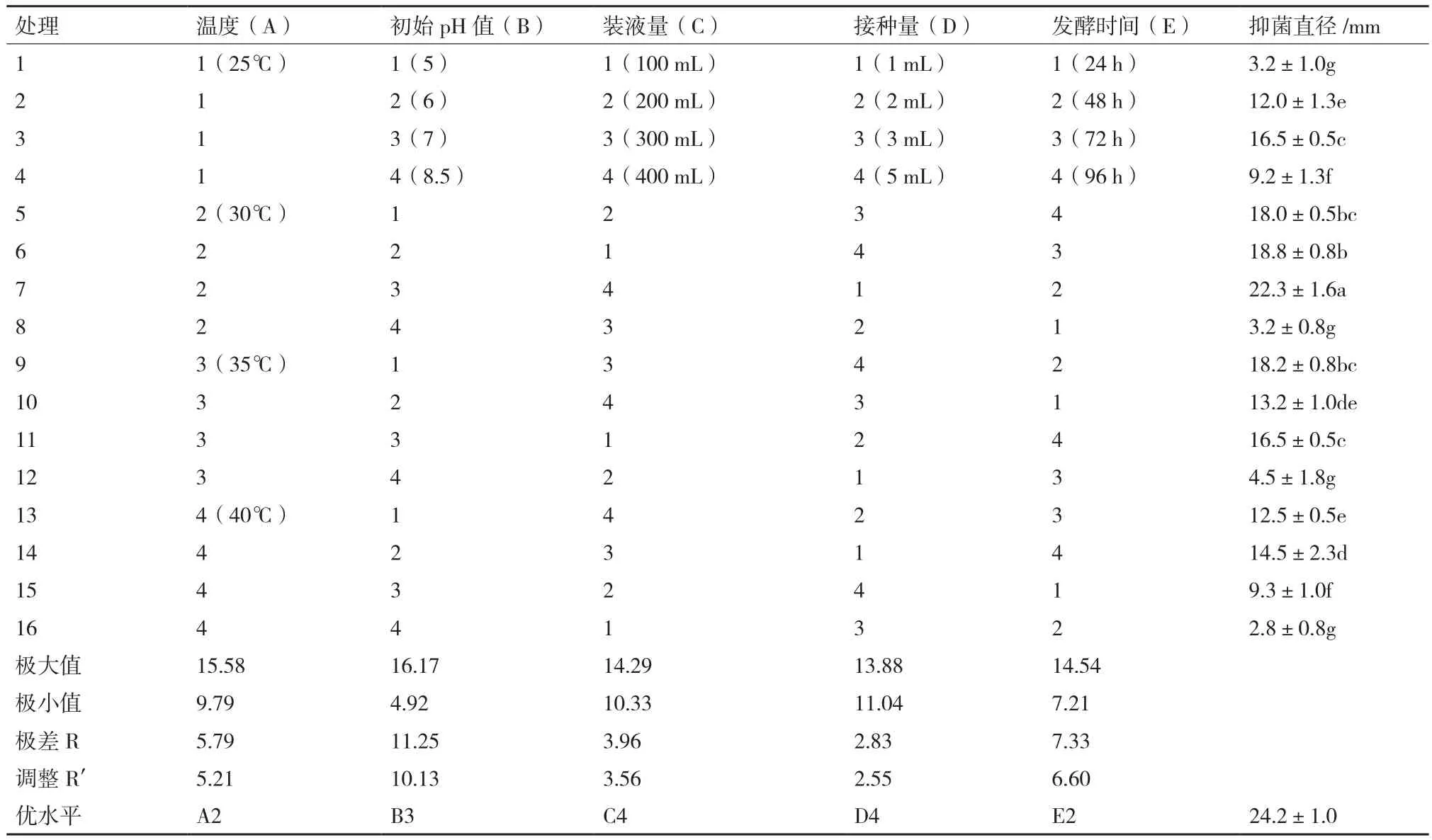
表6 发酵条件正交试验结果
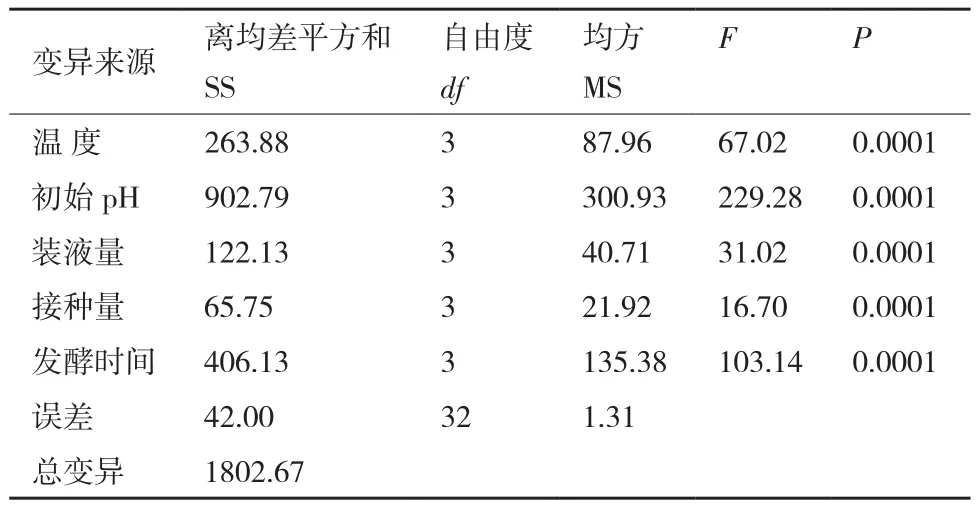
表7 三因素三水平方差分析
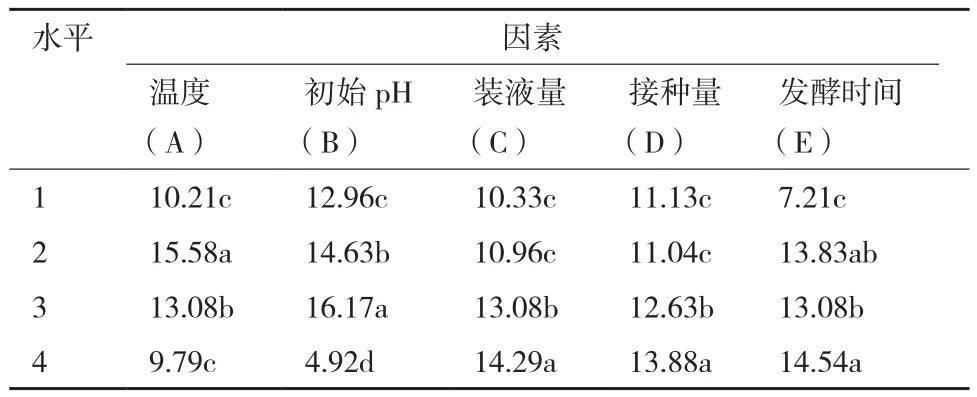
表8 试验处理因素各水平间差异显著性检验
2.5 拮抗细菌ML-3胞外抗菌蛋白对马铃薯早疫病的田间防效
对菌株ML-3抗菌蛋白马铃薯早疫病田间防效进行测定后发现:该菌株抗菌蛋白浓度为1 g/L和0.1 g/L时对马铃薯早疫病仍可保持较好防效,防效分别为76.56%和75.83%,同对照药剂相比防治效果差异显著(表9);当抗菌蛋白浓度为10 mg/L时田间防效出现一定程度下降,明显低于对照药剂,但仍可保持在70%左右;当抗菌蛋白浓度为1 mg/L时,防效下降幅度明显,仅有23.55%。说明该菌株抗菌蛋白在马铃薯早疫病生物防治方面具有较好应用潜力,且药液抗菌蛋白有效成分含量不低于10 mg/L。

图6 不同温度、pH值和紫外照射时间对菌株ML-3抗菌蛋白抑菌特性的影响
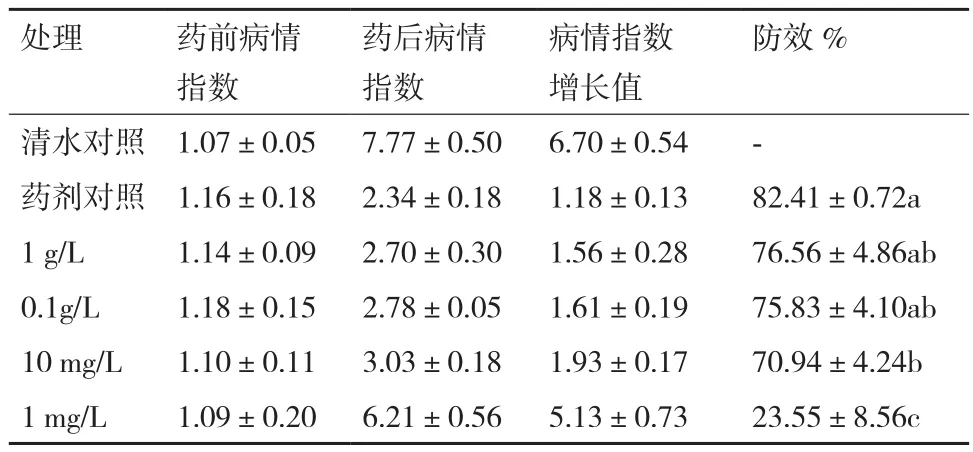
表9 菌株ML-3抗菌蛋白不同稀释倍数下的马铃薯早疫病田间防效
2.6 基于16S rRNA序列分析的拮抗细菌ML-3分类地位
菌株ML-3 16S rDNA序列经27F/1492R引物扩增和测序后获得该基因序列,长度为1 415 bp,NCBI数据库序列登录号MN539138。
基于菌株ML-3 16S rDNA序列使用Ezbiloud在线软件同数据库中的模式菌株16S rDNA序列进行比对后发现菌株ML-3同Bacillus tequilensisKCTC 13622T、Bacillus subtilissubsp.inaquosorumKCTC 13429T和Bacillus subtilissubsp.subtilisNCIB 3610T具有较高序列同源性,相似比分别为99.79%、99.79%和99.72%;使用MEGA 5.0基于菌株ML-3 16S rDNA和序列相似比大于96%的近缘模式菌株16S rDNA序列构建NJ系统发育树后发现菌株ML-3同模式菌株Bacillus subtilissubsp.inaquosorumKCTC 13429T聚在同一支(图7),说明菌株ML-3同该模式菌具有较高同源性,因此通过16S rDNA序列分析可将菌株ML-3鉴定为Bacillus subtilissubsp.inaquosorum。
3 讨论
抗病微生物及其天然产物作为植物病害生物防治药剂的一类重要开发源,对植物病害生物防治和我国化学农药减量使用具有重要意义,因此近年来成为植物病害防治的一个研究热点,且研究者已从多种来源分离和筛选出来了对植物病害具有拮抗作用的微生物[31]。然而,这些活性菌株筛选多数是以室内平板测定来完成,只有少量菌株经过田间试验验证,且目前有研究发现部分菌株虽然在室内具有良好活性,但其田间活性出现一定程度下降或丧失,而田间具有良好活性又是抗病微生物制剂化加工和走向市场的关键因素[32]。另外,虽然目前我国有关马铃薯早疫病拮抗微生物筛选也已有相关报道,但报道数量极少,仅有杨继业等[14]和杨登路等[15]做了相关报道,且相关研究都仅测定了拮抗菌株的室内抑菌活性,因此,基于上述现状,在筛选到马铃薯早疫病拮抗细菌菌株ML-3,并明确其抗菌物质为蛋白质后本研究从生产实际出发,重点对该菌株的抗菌蛋白硫酸铵沉淀饱和度、发酵液配方、发酵条件、抗菌蛋白稳定性以及田间防效进行了研究,旨在明确该菌株抗菌蛋白的制剂化加工和田间应用潜力,为马铃薯早疫病生物防治药剂开发提供新开发源。
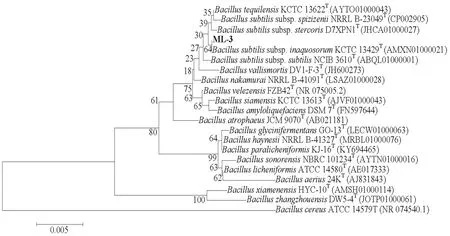
图7 基于菌株ML-3 16S rDNA序列分析的NJ系统发育树
通过研究发现菌株ML-3抗菌蛋白的最佳硫酸铵沉淀饱和度为80%,且该菌株产生的抗菌蛋白在温度低于60℃、pH值5-8以及紫外照射36 h等条件下均可保持良好抑菌活性。另外研究还发现菌株ML-3抑菌活性对K+、Fe2+和Zn2+稳定,而Cu2+和Mg2+则对菌株抑菌活性具有明显抑制作用。研究结果同枯草芽孢杆菌 Zl-2[33]、地衣芽孢杆菌 W10[34]、解淀粉芽孢杆菌HRH317[35]等菌株存在一定异同,说明不同菌株可产生不同抗菌蛋白,且不同抗菌蛋白的抑菌稳定性存在一定差异。
在明确菌株ML-3抗菌蛋白稳定性和最佳硫酸铵沉淀饱和度后,本研究还采用单因素和正交试验对影响其产量的培养液配方和发酵条件进行了探究,结果表明:马铃薯作碳源可有效提高菌株ML-3抗菌蛋白产量,使其抑菌带直径比对照增加了8.8 mm;在马铃薯介导下以蛋白胨作氮源时抑菌带直径可达24.2 mm,明显高于对照和其它氮源;正交试验优化后培养液配方为2%马铃薯、1%蛋白胨和0.5%NaCl,且在该配方下的较优发酵条件为初始pH值7.0、发酵温度30℃、500 mL三角瓶装液量400 mL、接种量5 mL、发酵时间48 h。该菌株产孢外抗菌蛋白培养液配方和发酵条件同枯草芽孢杆菌SH7[36]、枯草芽孢杆菌 G8[37]和枯草芽孢杆菌 B29[38]存在一定差异,造成这种差异的原因可能与菌株自身差异及来源不同关系密切,说明同种不同来源菌株在抗菌物质产生方面也存在一定差异。
随后为进一步确定该菌株抗菌蛋白的田间应用潜力,本研究以80%代森锌可湿性粉剂为对照药剂,采用完全随机区组设计,对不同稀释倍数后的菌株ML-3抗菌蛋白田间防效进行了测定,结果发现该菌株抗菌蛋白对马铃薯早疫病具有良好防效,且用药浓度不低于10 mg/L时防效可达70%。另外,选择药前病情指数相近报道中的化学药剂马铃薯早疫病防效同菌株ML-3抗菌蛋白防效进行对比后,发现该菌株抗菌蛋白田间防效同报道中的25%嘧菌酯悬浮剂[16]、42.4%唑醚·氟酰胺悬浮剂[39]和50%多菌灵可湿性粉剂[40]等多种化学药剂防效相近,说明该菌株抗菌蛋白在制剂化加工和田间应用方面具有良好潜力。
最后,虽然本研究对菌株ML-3胞外抗菌蛋白的稳定性、发酵液配方、发酵条件、田间防效以及分类地位进行了探究,为该菌株后期大规模发酵、制剂化加工以及田间应用奠定了基础,但有关该菌株抗菌蛋白的种类鉴定、制剂加工、制剂剂型以及多点、多年田间药效试验还需进一步加强研究,旨在为马铃薯早疫病生物防治提供新型绿色药剂。
4 结论
生防细菌ML-3产抗菌蛋白的较优培养液组成成分为2%马铃薯、1%蛋白胨和0.5%NaCl;较优发酵条件为初始pH值7.0、温度30℃、装液量400 mL/500 mL、接种量5 mL和发酵48 h。菌株ML-3抗菌蛋白不仅在温度≤60℃、pH值5-8和紫外照射36 h内具有良好稳定性,而且对K+、Fe2+、Zn2+、Na+稳定性较好。该抗菌蛋白的马铃薯早疫病田间防治用药浓度为≥10 mg/L。

