高密度脂蛋白改善胶原诱导性关节炎模型小鼠的症状
王 昕,董庆喆,张 娟,李 冬,艾 迪,王云龙*
(1.青岛大学附属医院 生物标本库, 山东 青岛 266000; 2.青岛大学 药学院, 山东 青岛 266021;3.青岛大学附属医院 小儿外科, 山东 青岛 266000; 4.青岛大学附属医院 泌尿外科, 山东 青岛 266000)
类风湿性关节炎(rheumatoid arthritis, RA)是一种比较常见的慢性自身免疫性疾病,发病率约为0.5%~1%,发病人群以老年人居多。RA病理表现为持续性的关节疼痛、肿胀、僵硬,滑膜增生,血管翳的生成,关节和骨组织破坏,甚至造成残疾并引起多种并发症[1-3],给患者造成了极大地经济负担,严重影响其生活质量。
高密度脂蛋白(high-density lipoprotein,HDL)是由物理化学性质与功能性质不同的脂质和脂蛋白所构成的复合体[4],它的蛋白组分包含载脂蛋白、酶、脂质转移蛋白、急性期反应蛋白等[5]。除具有抗动脉粥样硬化作用,HDL还发挥抑制血栓形成、抑制低密度脂蛋白的氧化、改善内皮细胞功能障碍、中和机体内毒素、免疫调节、抗感染及脏器保护等作用[6-8]。有证据表明,HDL的数量、结构组成和功能在RA患者中都发生了改变[9]。而且治疗RA的药物甲氨蝶呤和英夫利昔单抗在缓解RA患者关节炎症状的同时,对于HDL的功能也有所改善[10]。因此,HDL极有可能对于RA有积极的作用,因此本研究应用胶原蛋白诱导建立类风湿性关节炎小鼠模型,探讨HDL对于类风湿性关节炎的作用。
1 材料与方法
1.1 材料
1.1.1 试剂:冰醋酸(国药集团化学试剂有限公司);牛Ⅱ型胶原(Chondrex公司);弗氏完全佐剂、弗氏不完全佐剂(Sigma-Aldrich公司);HDL(ProSpec公司);福尔马林固定液、EDTA(北京索莱宝科技有限公司);ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)。
1.1.2 实验动物:SPF级雄性 DBA/1小鼠,6周龄,由上海斯莱克实验动物有限责任公司提供,饲养于青岛大学附属医院医学动物实验室。动物中心许可证编号:SYXK(鲁)-20150003。
1.2 方法
1.2.1 胶原诱导性关节炎(collagen induced arthritis,CIA)小鼠模型的建立及实验分组:使用2.5 mL 0.01 mol/L无菌醋酸稀释10 mg牛Ⅱ型胶原,终浓度为4 g/L,将稀释好的牛Ⅱ型胶原避光置于4 ℃旋转过夜直至胶原完全溶解。造模前取等量浓度为2 g/L牛Ⅱ型胶原与弗氏完全佐剂或弗氏不完全佐剂于冰上充分乳化制成胶原乳剂。
将DBA/1小鼠随机分为对照组、CIA组和CIA+HDL组,每组6只,CIA组与CIA+HDL组均需建立CIA模型。第0天,在小鼠尾根部皮内注射100 μL牛Ⅱ型胶原与弗氏完全佐剂制成的胶原乳剂。为了加强免疫效果,CIA组与CIA+HDL组在第21天注射牛Ⅱ型胶原与弗氏不完全佐剂制成的胶原乳剂100 μL,对照组注射0.9%氯化钠溶液。
1.2.2 小鼠体质量测量与关节炎评分标准:实验期间定期测定小鼠体质量并进行关节炎评分。关节炎评分标准如下:对于单只爪子,以0~3的评分标准测定关节炎严重性。0为正常状态,没有炎性反应或发红;1为1个手指或足趾发红和肿胀;2为>1个手指或足趾的红肿,或者1个手指或足趾、踝关节、腕关节发红和肿胀;3为所有手指或足趾和关节发红和肿胀[单只小鼠评分:(0~3)分×4(爪)=(0~12)分]。
1.2.3 HDL给药方案:CIA + HDL组在小鼠发病后通过尾静脉注射HDL(10 mg/kg体质量),每3 d给药1次,共注射5次。对照组静脉注射与CIA组相同体积的0.9%氯化钠溶液。
1.2.4 ELISA检测TNF-α和IgG2α水平:在第75天麻醉后处死小鼠,摘取小鼠眼球收集血液,室温静置2 h,3 000 r/min离心10 min,收集血清。按照ELISA试剂盒说明测定TNF-α和IgG2α的水平。
1.2.5 小鼠踝关节病理分析:在第75天麻醉后处死小鼠,将各组小鼠后足在10%中性甲醛缓冲液中固定,10% EDTA溶液中浸泡1个月进行脱钙,石蜡包埋,组织切片用HE染色。使用Nikon TE2000-S进行图像分析。
1.3 统计学分析
2 结果
2.1 HDL对CIA小鼠体质量及临床评分的影响
3组小鼠的体质量在第60天之前较为接近,第60天后,CIA组小鼠体质量明显轻于对照组与CIA+HDL组小鼠(图1)。
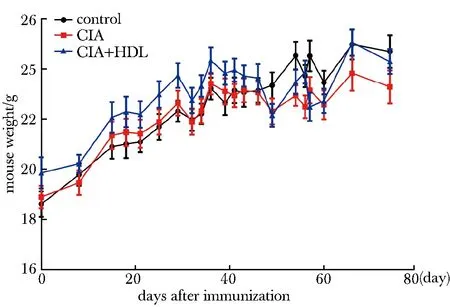
图1 小鼠体质量变化趋势图
造模第40天,小鼠陆续开始发病,实验组小鼠发病后静脉注射HDL进行治疗,自加强免疫后记录每只小鼠关节炎评分,对照组小鼠关节炎评分始终为零,CIA组与CIA+HDL组小鼠关节炎评分都显著高于对照组(P<0.05),说明模型建立成功。第50天开始,CIA+HDL组小鼠关节炎评分开始下降,并显著低于CIA组(P<0.05)(图2)。注射HDL治疗的小鼠足爪肿胀程度明显低于CIA组(图3)。

*P<0.05 compared with CIA group

图3 不同组小鼠足爪红肿情况
2.2 HDL对小鼠血清炎性因子水平的影响
CIA组小鼠TNF-α水平(92.62±11.56)pg/mL明显高于对照组(37.58±8.84)pg/mL(P<0.05)。与CIA组小鼠相比,CIA+HDL组小鼠的TNF-α水平(40.56±7.02)pg/mL显著降低(P<0.05)(图4)。

*P<0.05 compared with control group;#P<0.05 compared with CIA group
2.3 HDL对小鼠血清IgG2α水平的影响
CIA+HDL组小鼠血清中IgG2α水平显著低于CIA组(P<0.05)(图5)。
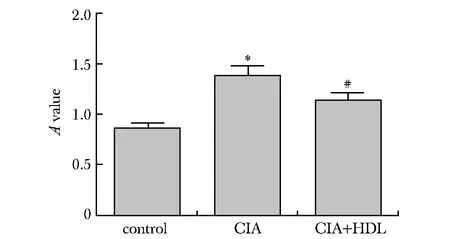
*P<0.05 compared with control group; #P<0.05 compared with CIA group
2.4 HDL对小鼠踝关节组织病理的影响
对照组小鼠踝关节组织结构完整,关节软骨面较为光滑,关节腔内无炎性细胞因子浸润。与对照组相比,CIA组小鼠踝关节关节面粗糙,滑膜组织增生,关节腔内可见大量的炎性细胞浸润;有血管翳生成,关节软骨以及髓质也受到明显的侵蚀。HDL治疗的CIA+HDL组小鼠与CIA组相比较,关节面变光滑平整,滑膜增生、炎性细胞浸润与骨侵蚀等病理变化明显减轻(图6)。
3 讨论
本研究选用最为经典的CIA小鼠模型模拟人类RA,因为它们在病理表现、免疫等方面极为相似,模型小鼠的遗传背景与人类相似,成本低廉,是研究人类RA早期、中期和晚期的发病机制以及治疗方案极为有用的工具[11]。使用DBA/1小鼠造模后28 d观察到小鼠陆续开始出现爪子肿胀现象,第40天小鼠全部发病,精神状态不佳,小鼠外观出现了不同程度的关节炎症状,例如关节肿胀、僵硬畸形,说明造模全部成功。静脉注射剂量为10 mg/kg HDL 5次后,小鼠关节炎临床评分明显降低。
在RA患者以及RA动物模型中证实了TNF-α是RA的致病机制中的关键细胞因子,由滑膜巨噬细胞产生。TNF-α作为主要的炎性因子参与炎性反应过程并引起系统性的炎性反应,因此对类风湿性关节炎的疾病发展以及严重程度具有重要影响。应用TNF-α阻断剂可以降低RA患者中滑膜组织中TNF-α的表达,从而改善RA患者的症状[12]。目前抑制TNF-α是治疗RA疾病的有效手段。CIA小鼠注射HDL治疗后,血清中TNF-α的水平比CIA组降低了56.21%。极有可能是因为HDL及其清道夫受体BI(scavenger receptor class B type I,SR-BI)抑制了巨噬细胞上的免疫识别受体TLR4的表达,从而抑制巨噬细胞分泌炎性细胞因子[13]。同时,HDL的胆固醇逆转运作用也会影响TLR向脂筏上的转移,下调细胞表面表达量并对TLR介导的信号通路活性产生影响[14]。血清中特异性抗体IgG2α水平也与RA的病程与严重程度相关,CIA+HDL组比CIA组降低了21.76%。HE结果显示HDL可以使CIA小鼠踝关节关节面变光滑平整,滑膜增生,炎性细胞浸润与骨侵蚀等病理变化明显减轻。

A.the ankle joint of control group; B.the ankle joint of CIA group; C.the ankle joint of CIA+HDL group
本研究结果表明HDL对于CIA小鼠有显著的改善作用,为类风湿性关节炎的临床治疗以及新药研发提供了新的思路及方向。其中涉及的多种免疫细胞的相互作用以及与炎性反应相关的信号通路还需进一步应用转基因动物来验证,从而最终明确高密度脂蛋白改善类风湿性关节炎的相关机制。

