miR-338-3p通过负性调节cPKCγ表达减轻小鼠神经元缺血损伤
魏海萍,郭 佳,葛朝明,邵康梅,王浩泰,卢 妮,王 欢*
(兰州大学 1.第二医院 神经内科; 2.第二临床医学院,甘肃 兰州 730030)
缺血性卒中(ischemic stroke)发病率高,危害大,但治疗措施有限[1]。缺血后神经元的恢复与脑梗死的愈后相关[2]。微小RNAs(microRNAs, miRNAs)与靶信使RNA(mRNA)结合,在转录后水平对靶蛋白进行负性调节[3]。有报道miR-338-3p可通过靶蛋白调控细胞增殖、调亡[4]。但miR-338-3p与神经元缺血方面的研究尚未见报道。
蛋白激酶C(protein kinase C, PKC)属于苏氨酸/丝氨酸蛋白激酶家族,参与各类细胞内生物事件,如细胞自噬[5]。其中cPKCγ只存在于脑和脊髓神经元[6]。前期利用小鼠脑中动脉阻塞(middle cerebral artery occlusion,MCAO)小鼠和氧-糖剥夺(oxygen glucose deprivation,OGD)/复糖复氧(reoxgenation, R)神经元,发现cPKCγ的激活发挥神经保护作用[7]。已报道cPKCγ通过Akt-mTOR通路调节神经元自噬减轻缺血性卒中鼠脑损伤[8]。基于此,本研究探讨cPKCγ在脑缺血中与miR-338-3p的相关性,以及miR-338-3p对缺血神经元存活率及死亡率的影响。
1 材料与方法
1.1 材料
雄性SFP级C57BL/6J小鼠(体质量为22~24 g)及C57BL/6J乳鼠[兰州大学实验动物中心,SCXK(甘)2018-0002号];miR-338-3p慢病毒(negative control, NC)(上海吉凯基因化学技术有限公司);兔源性cPKCγ多克隆抗体(Santa Cruze公司);抗actin鼠源性单克隆抗体(Sigma-Aldrich公司);MTT(噻唑兰)试剂盒(Applichem公司);ECL发光试剂盒(北京威格拉斯生物技术有限公司);辣根过氧化物酶标记的山羊抗兔 IgG抗体(北京中山金桥生物技术有限公司);miRNA反转录以及荧光定量试剂盒(北京天根生化有限公司)。
1.2 方法
1.2.1 小鼠及神经元的分组及处理:将小鼠分为:对照组、假手术组、1 h MCAO/R 24、48和72 h组。MCAO/R用线栓阻塞大脑中动脉1 h,拔出线栓恢复血流,整个手术过程平均80 min内完成。将神经元分为:常氧组(normoxia group)、1 h OGD/R 0、6、12和24 h组。OGD/R方法:取24 h内出生的乳鼠皮质组织,制备好后种植,置37 ℃、通以5% CO2/95% O2混合气体、饱和湿度的CO2孵箱内培养。将饲养液更换为无糖 DMEM 培养基,置于37 ℃、通有混合气体(5% CO2,1% O2和 94% N2)的低氧箱内,OGD 1 h,然后将无糖培养基更换为饲养液,置于5% CO2、95% O237 ℃培养箱内培养24 h。
将病毒感染神经元分为:非转染对照组(non-transfection)、转染miR-338-3p前体组(pri-miR-338)、前体对照组(pri-miR-control)、转染miR-338-3p抑制剂组(anti-miR-338)、抑制剂对照组(anti-miR-control)。神经元培养至第3天,将构建的病毒(MOI=20)按照分组加入饲养液中侵染72 h。
1.2.2 RT-qPCR)检测cPKCγ及miR-338-3p mRNA水平:检测各组的miR-338-3p和cPKCγ mRNA表达水平。cPKCγ mRNA的检测方法如下:提取总RNA后反转录合成cDNA。引物序列如下:miR-338-3p: 5′-UUUGCGGAAUUUUAAAUGCUGGA-3′,3′-GUUG UUUUAGUGACUACGACCU-3′;cPKCγ上游引物:5′-GGAATTGTATGAGGTAATGCTGGC-3′,下游引物:5′-AATCGCCCCCAGTGACATAC-3′。
检测方法如下:提取总RNA,反转录合成cDNA,以U6为内参照。进行PCR扩增。独立重复实验3次,每次3个复孔。
1.2.3 Western blot检测蛋白:MCAO小鼠脑组织和OGD神经元制备成电泳样品,制备好的蛋白样品进行凝胶电泳,转膜封闭,抗cPKCγ(1∶2 000)和actin(1∶5 000)抗体4 ℃孵育,辣根过氧化物酶(HRP)标记Ⅱ抗(1∶10 000)中孵育,ECL发光法显影曝光。
1.2.4 噻唑兰(MTT)比色法和乳酸脱氢酶(LDH)测定神经元活性:MTT:酶标仪来测定490 nm波长的吸光度值(A490)。正常对照组的细胞存活率为100%作为对比,OGD组细胞存活度(%)=OGD组吸光度值(A)值/对照组A值×100%。LDH:采用CytoTox96非放射性细胞毒性检测试剂盒进行LDH的测定。使用酶标仪在490 nm测量吸光度值。
1.2.5 免疫荧光和高内涵检测神经元凋亡情况: 将培养成功神经元(或经OGD处理),加入含有incuCyte caspase-3 reagents的常规饲养液体,置于高内涵仪器活细胞模块5% CO2/21% O2/74% N2条件下复氧并实时成像,每隔2 h拍照1次,每个孔拍10个视野,计数绿色荧光细胞个数与培养板孔底面积的比例并绘制曲线。
1.3 统计学分析
2 结果
2.1 cPKCγ蛋白水平在MCAO致小鼠脑梗死区周围皮质和OGD致神经元中表达均显著上调
1 h MCAO/R 24、48和72 h小鼠脑梗死区周围皮质cPKCγ蛋白水平较对照组显著升高(P<0.001) (图1A,C);1 h OGD/R 0、6、12和24 h神经元cPKCγ蛋白水平较对照组显著升高(P<0.001)(图1B,D)。
2.2 cPKCγ mRNA水平在MCAO致小鼠脑梗死区周围皮质和OGD致神经元中表达均显著上调,且miR-338-3p可能调控cPKCγ的表达
1 h MCAO/R 24、48和72 h小鼠脑梗死区周围皮质cPKCγ mRNA水平明显增高(P<0.001)(图2A), 在1 h OGD/R 0、6、12和24 h神经元内cPKCγ mRNA水平也明显增高(P<0.001)(图2B)。生物信息学网站TargetScanHuman预测发现,cPKCγ(PRKCG)3′UTR存在1个miR-338-3p结合位点,且该结合位点在多个物种中是保守的(图3)。这提示,miR-338-3p可能参与调控cPKCγ的合成。

A,B.typical results of Western blot showed cPKCγ protein levels in MCAO-treated peri-infarct cortex of mice and OGD-treated neurons; C.quantitative analysis demonstrated that cPKCγ protein level significantly increased in peri-infarct cortex of mice for 1 hour MCAO/R 24, 48 and 72 hours; D.quantitative analysis demonstrated that cPKCγ protein level significantly increased in neurons for 1 hour OGD/R 0, 6, 12 and 72 hours;*P<0.001 compared with sham or normoxia group
图1 MCAO处理小鼠脑梗死区周围皮层和OGD处理神经元中cPKCγ蛋白表达量变化

2.3 miR-338-3p在MCAO处理小鼠脑梗死区周围皮质和OGD处理神经元中显著下调,且miR-338-3p与cPKCγ mRNA表达水平呈负相关
1 h MCAO/R 24、48和72 h小鼠脑梗死区周围皮质miR-338-3p mRNA水平明显下降(P<0.001) (图4A),在1 h OGD/R 0、6、12和24 h神经元内miR-338-3p mRNA水平也明显下降(P<0.001) (图4B)。miR-338-3p与cPKCγmRNA水平表达呈负相关。

A.RT-qPCR results showed that cPKCγ mRNA level significantly increased inperi-infarct cortex of mice for 1 hour MCAO/R 24, 48 and 72 hours; B.RT-qPCR results showed that cPKCγ mRNA level significantly increased in neurons for 1 hour OGD/R 0, 6, 12 and 72 hours;*P<0.001 compared with sham or normoxia group
图2 MCAO处理小鼠脑梗死区周围皮质和OGD处理神经元中cPKCγ mRNA水平变化
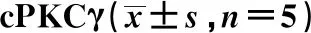

图3 miR-338-3p与cPKCγ 3′UTR结合序列

A.RT-qPCR results showed that miR-338-3p mRNA level significantly increased in peri-infarct cortex of mice for 1 hour MCAO/R 24, 48 and 72 hours; B.RT-qPCR resultsshowed that miR-338-3p mRNA level significantly increased in neurons for 1 hour OGD/R 0, 6, 12 and 72 hours;*P<0.001 compared with sham or normoxia group
图4 miR-338-3p mRNA水平在MCAO处理小鼠脑梗死区周围皮质和OGD处理神经元中变化
2.4 miR-338-3p对OGD致缺血神经元损伤程度的影响
过表达miR-338-3p可使1 h OGD/R 24 h神经元存活率下降(P<0.001)(图5A),凋亡率上升(P<0.001)(图5B),caspase-3蛋白平均荧光强度值显著增高(P<0.001)(图5D),而抑制miR-338-3p表达会使1 h OGD/R 24 h神经元存活率上升(P<0.001) (图5A),调亡率下降(P<0.001) (图5B),caspase-3蛋白平均荧光强度值显著降低(P<0.001)(图5C,D)。
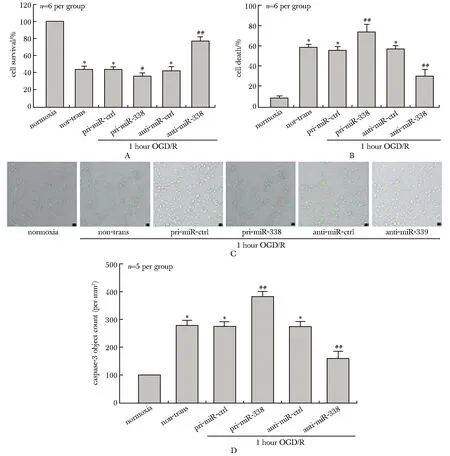
A.RT-qPCR results showed that the neuronal survival rate decreased in pri-miR 338 group, and the neuronal survival rate increased in anti-miR-338 group; B.RT-qPCR results showed that the neuronal death rate increased in pri-miR-338 group, and the neuronal death rate decreased in anti-miR-338 group;C.typical results of immunofluorecence and HCA results showed the mean fluorescence intensity of caspase-3(×40); D.quantitative analysis demonstrated that the mean fluorescence intensity of caspase-3 increased in pri-miR-338 group and decreased in anti-miR-338 group;*P<0.001 compared with normoxia group;#P<0.01,##P<0.001 compared with non-trans group
图5 过表达或抑制miR338-3p后神经元存活率和凋亡率
3 讨论
cPKCγ是神经元特有蛋白,在脑缺血病理生理机制中发挥重要的作用。PKC磷酸化水平与缺血再灌注损伤程度相关,通过抑制PKC磷酸化水平减轻缺血/再灌注损伤[8],说明PKC磷酸化水平决定了它的活性和功能。对于PKC的激活,也有不同的报道, PKC激活与其发生膜转位程度有关。报道cPKCγ通过Akt-mTOR通路调节神经元自噬减轻脑缺血损伤[9],但其调控机制不详。本研究结果显示,cPKCγ蛋白水平及mRNA水平在MCAO小鼠脑梗死区周围皮质和OGD致神经元中显著表达上调。
miRNA 做为一类非编码RNA,可调控机体许多生理和病理过程,调控大约30%的编码蛋白基因[10]。miR-338-3p在多种疾病中表达下调,miR-338-3p下调促进骨关节炎患者滑膜组织纤维化[11]。对于miR-338-3p表达上调的报道多见于对肿瘤研究。有报道miR-338-3p表达上调发挥抑癌基因作用,其表达下调可能会使前列腺癌患者临床预后不良[12]。miR-338-3p表达上调,通过下调低氧诱导因子抑制鼻咽癌瘤细胞的迁移和扩散[13]。本研究结果显示,miR-338-3p可能参与调控cPKCγ的合成。为了验证miR-338-3p可能负调控cPKCγ的合成,在离体细胞水平,得出miR-338-3p在MCAO小鼠脑梗死区周围皮质和OGD致神经元中显著下调表达,且miR-338-3p与cPKCγ mRNA水平表达呈负相关。另外,在离体细胞实验得出,过表达miR-338-3p会加重OGD致缺血神经元损伤程度,而抑制miR-338-3p表达会减轻OGD致缺血神经元损伤程度。miR-338-3p通过负调节cPKCγ而减轻缺血性卒中脑损伤。以上结果说明脑缺血后miR-338-3p表达下调起到保护神经元免受缺血损伤作用,其机制可能与miR-338-3p致cPKCγ蛋白水平上调有关。
总之,本研究表明,miR-338-3p与cPKCγ mRNA水平表达呈负相关,miR-338-3p通过负调节cPKCγ而减轻缺血性卒中脑损伤。

