利用经典的Zbed3敲除鼠探索ZBED3在小鼠大脑皮质发育过程中的作用
孙长杰,舒鹏程,彭小忠,2*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室 医学灵长类研究中心 神经科学中心, 北京 100005;2.中国医学科学院 医学生物学研究所, 云南 昆明 650118)
哺乳动物大脑新皮质由6层细胞形态、分子特征和轴突投射位置各不相同的神经元组成,负责处理情感、记忆和社交行为等复杂生理功能[1-2]。以小鼠为例,其新皮质发育过程受转录因子、信号分子、表观调控等多种因素的调节[3]。
在调节新皮质发育的诸多信号分子中,经典Wnt信号通路(Wnt/β-catenin信号通路)是一种在各物种间极为保守的信号通路,其进化的保守性体现了其功能的重要性[4]。在哺乳动物中,经典Wnt信号通路参与胚胎早期体轴的形成[5]。在神经系统中,经典Wnt信号通路参与大脑背腹轴、前脑分区和新皮质发育的调节[6]。并且,经典Wnt信号通路的异常与神经发育缺陷和神经系统疾病密切相关[7]。
ZBED3(zine finger BED domain-containing protein 3)作为锌指BED结构域蛋白超家族成员,可通过PPPPSPT模序与Axin1结合,抑制GSK3β对β-环连蛋白(β-catenin)的磷酸化,进而激活经典的Wnt信号通路[8]。目前,有证据表明ZBED3参与小鼠卵母细胞发育调节,但其在大脑发育过程中的作用尚不清楚[9]。作为经典Wnt信号通路的调节分子,本研究旨在利用敲除鼠探索ZBED3在小鼠大脑皮质发育过程中的作用,提高人们对于大脑皮质发育调控的认识水平。
1 材料与方法
1.1 材料
1.1.1Zbed3敲除鼠:引自中科院动物所李磊研究员实验室,打靶方案和鉴定方案见文献[9]。
1.1.2 主要试剂:ZBED3抗体(兔)李磊研究员实验室惠赠;β-actin抗体(Sigma-Aldrich公司);pGEM-3zf质粒(Promega公司);原位杂交实验相关试剂见文献[10]。 EdU检测试剂盒(Invitrogen公司); anti-Sox5(ab94396)、anti-Pax6(ab5790) (Abcam公司); anti-Cux1(sc13024, Santa Cruz公司); β-catenin检测试剂盒(T2951, Cell Signaling Technology公司); SYBR(TaKaRa公司);反转录试剂盒(Vazyme公司)。
1.2 方法
1.2.1 原位杂交实验:为确定Zbed3敲除鼠大脑中是否表达ZBED3 mRNA,参考文献[10]进行原位杂交。
1.2.2 EdU(5-ethynyl-2’-deoxyuridine,5-乙炔基-2’脱氧尿嘧啶核苷)标记实验:EdU是一种胸腺嘧啶核苷类似物,在DNA复制时期能够代替胸腺嘧啶掺入到正在合成的DNA分子中。为分析Zbed3敲除对投射神经元迁移的影响,在孕鼠E12.5和E14.5时向腹腔注射EdU溶液,剂量为50 mg/kg,P3时处死幼鼠取脑。
1.2.3 30 min EdU标记实验:为分析Zbed3敲除对神经前体细胞的影响,在E12.5、E14.5和E16.5三个时间点给孕鼠腹腔注射EdU,剂量为50 mg/kg,30 min后处死孕鼠取脑。
1.2.4 EdU检测实验:检测方法按试剂盒说明书。
1.3 统计学分析
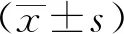
2 结果
2.1 Zbed3敲除鼠中检测不到ZBED3蛋白和mRNA
引进的Zbed3敲除鼠根据敲除策略通过PCR技术进行鉴定,在胚胎14.5 d时(E14.5),利用原位杂交和免疫荧光技术检测ZBED3 mRNA和蛋白。对E14.5胚胎进行取脑切片,利用原位杂交技术检测ZBED3 mRNA的表达。在野生型小鼠中,ZBED3 mRNA主要表达于室周区,在Zbed3敲除鼠中检测不到ZBED3 mRNA的表达(图1A)。在野生型小鼠中,ZBED3蛋白正常表达,而在Zbed3敲除小鼠中检测不到ZBED3蛋白(图1B)。由此验证了该小鼠为ZBED3敲除鼠。
2.2 Zbed3敲除不影响小鼠神经前体细胞增殖
在E12.5、E14.5和E16.5时向孕鼠腹腔注射EdU, EdU可以标记处于S期的正在增殖的神经前体细胞。在免疫荧光结果中,神经前体细胞标志物Pax6+细胞代表具有神经前体细胞命运的细胞,EdU+细胞代表处于S期的细胞,对Pax6+细胞、EdU+细胞和EdU和Pax双阳性细胞(EdU+Pax6+)进行计数(图2A)。统计分析后发现在对照组和Zbed3敲除组间,3类细胞数目没有显著差异(图2B~D)。说明在神经前体细胞增殖的早中晚3个阶段,Zbed3敲除对于神经前体细胞的增殖无明显影响。
2.3 Zbed3敲除不影响小鼠皮质层次形成
在小鼠深层神经元产生的E12.5和浅层神经元产生的E14.5时分别对孕鼠通过腹腔注射EdU标记深层和浅层神经元。在P3小鼠新皮质层次基本形成时,采用免疫荧光技术检测浅层神经元(Cux1,Ⅱ-Ⅳ层神经元标志物)和下层神经元数目(Sox5,Ⅴ-Ⅵ层神经元标志物);神经元标志物和EdU共标代表EdU掺入过程中生成的神经元数目(图3A~D)。结果表明,在E12.5时主要生成的是下层神经元。统计对照组和Zbed3敲除组间下层神经元(Sox5+)数目及EdU阳性和Sox5阳性的细胞(EdU+/Sox5+)数目,两个组间差异没有统计学意义(图3E)。在E14.5时主要生成的是浅层神经元,统计对照组和Zbed3敲除组间浅层神经元(Cux1+)数目及EdU阳性和Cux1阳性的细胞(EdU+/Cux1+)数目,两个组间差异没有统计学意义(图3E~G)。因此,在Zbed3敲除鼠中,Zbed3敲除不能影响神经元层次命运的形成。通过EdU标记的神经元在皮质的分布来判断Zbed3敲除对神经元迁移的影响。将皮质由上到下分为10个分区(bin),对每个分区内EdU+的细胞进行计数,统计在对照组和Zbed3敲除组中EdU+细胞的分布是否存在差异。对E12.5处理时EdU标记的细胞在不同的分区进行计数,发现EdU+细胞主要位于深层,分析对照组和Zbed3敲除组EdU+细胞在不同分区的分布,发现EdU+细胞在新皮质的分布没有明显差异(图3H)。对E14.5时EdU+细胞在不同的分区进行计数,发现EdU+细胞主要位于浅层,对对照组和Zbed3敲除组EdU+细胞在不同分区的分布进行分析,EdU标记的细胞在新皮层的分布没有统计学意义(图3I)。因此,在Zbed3敲除鼠中,Zbed3敲除不能影响新皮质发育过程中神经元的迁移过程。
A.Zbed3 mRNA was detected by in situ hybridization at E14.5 slices(×10); B.ZBED3 protein was detected by immunofluorescence at E14.5 slices(×40)
图1 敲除鼠中检测不到ZBED3 mRNA和蛋白
Fig 1 mRNA and protein of ZBED3 could not be detected inZbed3 knockout mice
2.4 Zbed3敲除使β-catenin表达水平上调
为了解Zbed3敲除小鼠中其他基因的表达变化,采用RT-qPCR检测Wnt/β-catenin信号通路传导相关基因β-catenin、Wnt3a、Wnt8b和Axin2的mRNA表达。结果显示,与对照组相比,Zbed3敲除小鼠中Ctnnb1(即β-catenin)mRNA表达水平升高(P<0.001)。使用E14.5全脑蛋白样品通过Western blot检测β-catenin蛋白,发现β-catenin的上调与RT-qPCR的结果一致。进一步通过Western blot检测3种磷酸化形式β-catenin的表达水平,结果显示3种磷酸化形式β-catenin的表达水平也出现上调(图4)。
3 讨论
经典Wnt信号通路参与从胚胎发育到成年后机体稳态维持等多个生理过程的调节,其功能与发育和疾病密切相关[11]。ZBED3可激活经典的Wnt信号通路,是经典Wnt信号通路的调节分子[8]。但ZBED3在小鼠大脑皮质发育过程中的作用尚未见报道。

A.brain sections (E12.5, E14.5 and E16.5) were immunostained for neural progenitor cell marker (Pax6) and EdU(×10,×40); B.quantification of Pax6+cells was determined in A; C.quantification of EdU+cells was determined in A; D.quantification of Pax6+/EdU+cells was determined in A
图2Zbed3敲除不影响小鼠神经祖细胞增殖


A.images of P3 mouse cortices treated with EdU at E12.5, brain sections were immunostained for cortex layer markers (Sox5) and EdU(×10,×40); B.images of P3 mouse cortices treated with EdU at E14.5, brain sections were immunostained for cortex layer markers (Sox5) and EdU(×10,×40); C.images of P3 mouse cortices treated with EdU at E12.5, brain sections were immunostained for cortex layer markers (Cux1) and EdU(×10,×40); D.images of P3 mouse cortices treated with EdU at E14.5, brain sections were immunostained for cortex layer markers (Cux1) and EdU(×10,×40); E.quantification of Sox5+and Cux1+cells were determined in A, B and C, D; F.quantification of EdU+and Cux1+cells were determined in C and D; G.quantification of EdU+and Sox5+cells were determined in A and B; H.distribution of EdU+cells in dorsal-lateral neocortex (divided into 10 bins from pial to IZ) was determined in (A); I.distribution of EdU+cells in dorsal-lateral neocortex (divided into 10 bins from pial to IZ) was determined in (B)
图3Zbed3敲除不影响小鼠皮质层次形成
引进Zbed3敲除鼠研究ZBED3在小鼠大脑皮质发育过程中的作用。首先通过原位杂交和免疫荧光技术检测发现,在Zbed3敲除鼠中检测不到ZBED3的蛋白和mRNA,可以利用该小鼠研究ZBED3对大脑发育的作用。同时,ZBED3 mRNA和蛋白主要表达于室周区前体细胞,这提示ZBED3可能参与皮质发育的调节。采用胸腺核苷酸类似物EdU标记技术和免疫荧光技术分析发现,Zbed3敲除不影响神经祖细胞增殖。进一步分析Zbed3敲除对皮质层次命运和神经元迁移的影响,发现Zbed3敲除不影响皮质层次命运和神经元迁移。以上结果提示,Zbed3敲除不影响小鼠皮质发育过程。出现这一结果可能是由于同源基因的代偿或者经典Wnt信号通路相关分子的表达变化引起的。

A.relative mRNA expression level of Wnt associated genes were assessed by quantitative real-time PCR, the 2-ΔΔCtmethod was used for the quantitative analysis(student’sttest; Ctnnbl.β-catenin;*P<0.001 compared with WT); B.Western blot analysis of β-catenin; C.Western blot analysis of phospho-β-catenin (Ser33/37; Ser552; Ser675)
图4Zbed3敲除使β-catenin表达水平上调

有研究表明,基因敲除小鼠未见明显表型可能是由于遗传稳健性和遗传补偿引起的[17-18]。为了解Zbed3敲除引起的其他基因的表达变化,进一步分析了经典Wnt信号通路相关分子的表达变化,结果表明,在Zbed3敲除鼠中β-catenin的表达出现上调,这说明ZBED3不仅可以作为调节分子调节经典Wnt信号通路的活性,还有可能在β-catenin发挥作用的过程中起辅助作用。
综上所述,本研究利用Zbed3敲除鼠对经典Wnt信号通路调节分子ZBED3在小鼠大脑皮质发育过程中的作用进行探索。结果表明Zbed3敲除不影响小鼠皮质发育过程。虽然在Zbed3敲除鼠中未见明显的大脑形态结构异常和皮质层次发育异常,但进一步研究Zbed3敲除鼠中表达水平发生变化的基因可能有助于更深入地研究ZBED3的功能。

