斑马鱼cetp基因敲除模型的建立及其肝脏转录组学分析
冯冬萍,商汉桥,杨 航,4,张虎军,4,张 停,杨梦溪,屠 强,4,任景怡*
(1.北京大学中日友好临床医学院, 北京 100029; 2.中日友好医院 心内科,北京 100029;3.中国科学院 遗传与发育生物学研究所, 北京 100101;4.中国科学院大学, 北京 100049)
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease, ASCVD)是全球成人死亡的首要原因[1]。尽管强化他汀治疗已使心血管病患者明显获益,但心血管疾病仍存在较大剩留风险[2-5],且与高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)水平较低相关[6]。因此,升高HDL-C水平以降低ASCVD剩留风险的策略备受关注。目前正在研发的升高HDL-C的相关治疗方法中最受关注的是胆固醇酯转运蛋白(cholesteryl ester transfer protein, CETP)抑制剂[7]。CETP是主要由肝脏和脂肪组织合成的疏水性糖蛋白,在循环中CETP与HDL结合,将胆固醇酯从HDL转运至富含载脂蛋白B(apolipoprotein B,ApoB)的极低密度脂蛋白胆固醇(very low-density lipoprotein cholesterol, VLDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C),同时将ApoB脂蛋白中的三酰甘油(triglyceride,TG)逆向转运给HDL,加速了HDL的分解代谢,在胆固醇逆转运过程中起重要作用[8]。因此,从理论上讲,抑制CETP可能是升高HDL-C最有效的药理作用[9]。
然而,CETP抑制剂相关临床试验结果存在不确定性[10-14],并且CETP在动脉粥样硬化疾病中的作用机制尚有很多不明之处[15-16]。CETP抑制剂的动物实验目前困难重重。首先,缺乏合适的疾病动物模型。常用的啮齿类动物缺少cetp基因,与人类完全不同,无法直接用于CETP作用机制的研究。而将人类CETP引入小鼠,得出的结果又相互矛盾[17]。其次,在动脉粥样硬化疾病的条件下,CETP对HDL的影响以及胆固醇逆转运(reverse cholesterol transport,RCT)的作用仍未在体内被证实。迄今为止,尚无通过抑制CETP升高HDL水平详细机制的相关报告。基于此,寻找更合理的疾病模型对CETP的研究至关重要。斑马鱼体型小,易于大量繁殖,胚胎和幼鱼透明,全基因组测序完成,适用于很多种遗传学、发育生物学、生理学等技术手段,是一个理想的脊椎动物模型。更重要的是,斑马鱼拥有保守且与人类高度相似的脂类代谢相关基因,特别是具有cetp基因,且脂蛋白分布与人类相似,对高脂食物敏感[18]。因此,斑马鱼非常适合脂代谢及动脉粥样硬化研究,受到了广泛关注。
本研究应用CRISPR/Cas9技术敲除斑马鱼cetp基因,构建cetp-/-模型,并且通过转录组测序探讨cetp基因敲除后其他相关基因的变化及其相互作用,进而揭示CETP在动脉粥样硬化疾病过程中的作用机制。
1 材料与方法
1.1 材料
主要试剂:Trizol 试剂(Invitrogen公司);2×Es Taq MasterMix(北京康为世纪生物科技公司);RNeasy Mini kit(Qiagen公司);反转录试剂盒(Bio-rad公司);无水乙醇(北京化工厂);3-氨基苯甲酸乙酯甲基磺酸盐(3-aminobenzoic acid ethyl ester methanesulfonate,MS-222)(Sigma-Aldrich公司);T7核酸内切酶1(T7 endonuclease 1, T7E1)(BioLabs公司)。
1.2 方法
1.2.1 斑马鱼饲养:本实验所用斑马鱼为野生型Tu品系,其饲养条件为28.5 ℃,pH 7.2~7.6,光照周期为10 h黑暗、14 h光照。斑马鱼繁殖后代方法:即选用健康性成熟的雌、雄斑马鱼,按雄∶雌=1∶1~2的数量置于产卵盒中,并用透明隔板分离雌、雄斑马鱼,次日移去隔板,收集胚胎。斑马鱼胚胎放入培养液中,于28 ℃恒温培养箱中培养,受精后4~5 d(days post fertilization,dpf)转到鱼房并喂食草履虫,10~14 dpf转入北京爱生公司斑马鱼养殖系统中养殖喂食丰年虾,斑马鱼胚胎发育时期按照Kimmel等的标准[19]确定。
1.2.2 斑马鱼cetp基因敲除:在NCBI GenBank获得斑马鱼cetp的全长序列,应用CRISPR/Cas9靶位点设计网站SSC(http://crispr.dfci.harvard.edu/SSC/)设计sgRNA。在斑马鱼cetp第2个外显子区域设计基因编辑靶位点,其碱基序列为5′-GGG ACCATCAACTATGGATA-3′。此外,设计正向引物487f(5′-CTGAAGTCATACAAGCCGC-3′)和反向引物494r(5′-CATTATGCATTAACTTGACT-3′)用于检测靶位点是否发生基因编辑。体外合成sgRNA、Cas9核酸酶mRNA,将sgRNA、Cas9 mRNA及酚红(指示剂)共孵育配制显微注射液。收集斑马鱼一细胞期胚胎并注入上述显微注射液。对照组为同一批未注射的斑马鱼胚胎。斑马鱼胚胎显微注射操作参考John D.Mably等[20-21]的研究。将注射和未注射的斑马鱼胚胎均于28 ℃恒温培养箱中培养,定期更换培养液。
收集显微注射2 dpf胚胎和对照组胚胎各24枚,分别提取基因组DNA,并通过PCR反应及T7E1酶切确定注射胚胎是否发生基因编辑。酶切成功样品的PCR产物送北京擎科新业生物技术有限公司测序。基因编辑成功的F0胚胎饲养至性成熟,并与野生型成鱼杂交,所得胚胎提取基因组DNA后进行PCR扩增、T7E1酶切及测序,检测靶位点突变情况。将突变胚胎饲养至成鱼,通过剪尾提取F1基因组DNA并进行PCR扩增、T7E1酶切及测序,确定突变类型,从而获得cetp基因敲除的杂合突变体,即cetp+/-。同基因型F1雌雄斑马鱼自交后代饲养至成鱼,剪尾提取其基因组DNA并进行PCR扩增、T7E1酶切及测序,获得cetp基因敲除纯合突变体,即cetp-/-。
1.2.3 斑马鱼标本取样:使用麻醉剂MS-222麻醉成年斑马鱼后,在显微镜下分离斑马鱼肝脏,用无RNA酶的PBS溶液冲洗后置于1 mL Triol中,于-80 ℃冰箱储存。
1.2.4 RNA提取:取-80 ℃冻存的肝脏组织,于冰上匀浆。样品于室温下静置5 min后加入200 μL三氯甲烷,充分摇晃15 s后,室温静置5 min;4 ℃,15 000×g离心15 min;取400 μL上层液体于新的1.5 mL离心管中,并加入400 μL 70%乙醇吹打混匀。后续实验方法按照QIAGEN RNeasy Micro Kit使用说明进行。
1.2.5 转录组测序及分析:首先采用Nano Drop 2000微量分光光度计及Agilent 2100 Bioanalyzer,Agilent RNA 6000 Nano Kit对RNA进行纯度、浓度与完整系数(RNA integrity number, RIN)检测,RIN≥9.0、28S/18S<1.2的RNA用于建库、测序。文库构建及测序由北京安诺优达基因科技有限公司采用HiSeq Xten PE500测序平台完成。通过转录组测序技术获得基因表达谱变化,应用KEGG数据库进行差异表达基因功能富集,分析其可能影响的生物学过程及信号通路。
1.2.6 实时荧光定量PCR:采用实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)检测斑马鱼肝脏cetp基因表达情况。Trizol法提取野生型和cetp-/-斑马鱼肝脏总RNA,以RNA为反转录模板,应用反转录试剂盒合成cDNA,再以cDNA为模板进行RT-qPCR,其中,正向引物为q1-1f:5′-AGCATGCCAAATATCCCAGT-3′,反向引物q1-1r:5′-AGAAGCAAACATATCGTGTAA-3′。 RT-qPCR反应程序为第1个循环 95 ℃ 10 min;第2~41个循环95 ℃ 15 s,60 ℃ 1 min;第42循环熔解曲线。每个反应进行3次生物学重复,以β-actin为内参对照,对照组为外对照,采用2-ΔΔCt法计算cetp基因在野生型斑马鱼和cetp-/-斑马鱼肝脏相对表达量,应用GraphPad prism8绘制柱状图。
1.3 统计学分析
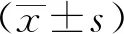
2 结果
2.1 应用CRISPR/Cas9技术构建cetp-/-斑马鱼模型
为获得斑马鱼cetp基因敲除纯合突变体,本研究应用CRISPR/Cas9技术对斑马鱼cetp基因第2个外显子进行基因编辑(图1A)。cetp基因敲除纯合突变体遗传学筛选流程(图1B)如下:通过显微注射技术将sgRNA、Cas9 mRNA及酚红组成的显微注射液注入野生型斑马鱼一细胞期胚胎,构建F0 founder;F0与野生型斑马鱼交配获得F1,提取F1基因组DNA,通过PCR扩增及T7E1酶切实验确定cetp+/-斑马鱼;根据孟德尔遗传定律,同基因型F1雌、雄斑马鱼交配即可获得cetp-/-斑马鱼。采用3对引物通过PCR扩增、T7E1酶切及琼脂糖凝胶电泳筛选野生型、杂合体、纯合体(图1C),其中野生型cetp(泳道3、4、6、15、16, +/+表示)及cetp-/-纯合突变体(泳道1、2、9, -/-表示)斑马鱼的PCR产物因不能被T7E1酶切,所以电泳结果呈现单1条带(约390 bp),而cetp+/-杂合突变体(泳道5、7、8、10、11、12、13、14,+/-表示)因杂合双链退火产生非配对DNA片段,T7E1可识别不完全配对DNA并进行酶切,酶切产物电泳后会形成2条带,因而出现约290 bp和360 bp的2条带。上述cetp基因敲除杂合体和纯合体PCR产物进行TA克隆测序(图1D),箭头所示为基因编辑起始位点,产生了增加5个碱基TCCCT的移码突变。由此,成功构建了cetp-/-斑马鱼模型。
2.2 验证cetp-/-斑马鱼模型
通过RT-qPCR验证野生型和cetp-/-斑马鱼的肝脏cetp转录水平。结果显示,cetp-/-斑马鱼肝脏中cetp基因表达量是野生型斑马鱼表达量的约1/5,cetp-/-斑马鱼肝脏cetp基因表达量显著降低(P<0.05)。
2.3 转录组测序数据分析
分别提取野生型和cetp-/-斑马鱼肝脏总RNA,利用转录组测序技术进行转录调控分析;根据测序数据分析上述样品之间的相关性。结果显示,野生型斑马鱼与cetp-/-斑马鱼肝脏样品分为截然不同的两类且组内相关性较好,该结果提示斑马鱼cetp基因敲除成功,与实验预期相符,测序数据可进行后续转录组学分析(图2)。

A.zebrafishcetpgene and knockout site; B.zebrafishcetp-/-model genetics screening process; C.T7E1 assay for detecting CRISPR/Cas9-mediatedcetpgene editing zebrafish; D.sequencing graphs of PCR product from zebrafish; +/+.wild type; +/-.heterozygote; -/-.homozygote
图1 CRISPR/Cas9介导的斑马鱼cetp基因敲除
Fig 1 CRISPR/Cas9-mediated zebrafishcetpknockout

图2 野生型和cetp-/-斑马鱼肝脏样品的相关性分析
2.4 差异基因表达分析
从野生型斑马鱼和cetp-/-斑马鱼(测序)文库中,通过P<0.05筛选表达量发生变化的差异表达基因(图3)。图中红色代表显著上调基因,蓝色代表显著下调基因。与野生型斑马鱼相比,cetp-/-斑马鱼共筛选到3 808个发生显著变化的基因,其中cetp基因敲除后发生显著上调的基因有1 918个,显著下调的基因有1 890个。该结果提示cetp-/-斑马鱼与野生型斑马鱼肝脏基因表达具有显著差异。

图3 野生型和cetp-/-斑马鱼肝脏差异表达基因
2.5 KEGG分析
将筛选得到的差异表达基因于KEGG数据库进行通路注释,通过显著性水平(P<0.05)筛选显著差异的KEGG通路(表1)。其中,上调基因富集的通路包括溶酶体通路、自噬调节通路等;而下调基因富集的通路包括DNA复制通路、核糖体通路及三羧酸循环通路等。

表1 差异表达基因通路富集列表
3 讨论
冠心病已成为全球死亡原因之首,严重威胁人类健康[1, 22],血脂异常是其主要危险因素之一[23]。尽管人类CETP突变后其功能缺失可升高血浆HDL-C、降低LDL-C水平、减少心血管事件[24],然而,CETP抑制剂临床试验显示,抑制CETP而升高HDL-C浓度的治疗策略并未显著降低心血管剩留风险[10]。目前,CETP在动脉粥样硬化中的作用机制仍未完全明确。因此,寻找理想动物模型深入研究CETP在动脉粥样硬化的具体作用机制可为治疗冠心病提供新的治疗策略,具有重要临床意义。斑马鱼以其独特的生理优势、清晰的遗传背景和丰富的数据库资源成为重要的脊椎动物模型。更为重要的是,斑马鱼具有cetp基因,其脂蛋白分布和人类相似,使其在脂质代谢及动脉粥样硬化疾病的研究中独具优势[18, 25-27]。第三代基因组编辑技术CRISPR/Cas9是在sgRNA引导下使cas9蛋白定位到DNA靶序列上,对DNA双链进行切割,实现基因编辑,具有设计简单、操作方便、切割效率高等优势[28]。
本研究通过CRISPR/Cas9和显微注射技术敲除斑马鱼cetp基因,构建斑马鱼cetp-/-模型,并且分别对野生型和cetp-/-斑马鱼肝脏进行转录组学测序。经转录组分析,本研究共筛选到3 808个差异表达基因,并对其进行KEGG富集分析,结果显示,敲除斑马鱼cetp基因后,abca1、abcg2a基因显著上调;lipg基因显著下调。Bochem等[29]研究显示,因三磷酸腺苷结合盒转运体A1(adenosine triphosphate-binding cassette transporter A1,ABCA1)突变导致ABCA1功能丧失后,颈动脉粥样硬化增加,CVD风险增加,上调ABCA1成为治疗CVD的有效治疗策略。内皮脂酶是由lipg基因编码产生的脂肪酶,主要参与脂蛋白代谢过程,是HDL代谢中的关键蛋白。Ishida等[30]将小鼠Lipg敲除后,血浆HDL颗粒直径变大,HDL水平升高,HDL清除延迟;而将Lipg转入小鼠体内后,血浆HDL水平降低。此外,人类中LIPG功能丢失,HDL水平显著升高[31]。本研究中敲除斑马鱼cetp基因后abca1、abcg2a基因显著上调;lipg基因显著下调,可能cetp-/-斑马鱼的Hdl水平升高,具有抗动脉粥样硬化作用。
此外,本研究还发现,与野生型斑马鱼相比,cetp-/-斑马鱼显著上调基因主要富集到自噬相关通路,提示敲除cetp后斑马鱼自噬作用明显增强。研究表明,自噬与炎性反应相互影响,二者均在动脉粥样硬化中具有重要作用,适度自噬反应对机体具有保护作用,而过度自噬会引发细胞死亡及促进炎性因子分泌,可能加速动脉粥样硬化斑块不稳定[32-36]。新近的CANTOS研究首次证实抑制炎性反应可降低不良心血管事件,为动脉粥样硬化的炎性反应假说提供直接证据[37]。因此,敲除cetp后斑马鱼的自噬作用显著增加,促进炎性反应,可能具有促动脉粥样硬化的作用。
综上所述,尽管敲除斑马鱼cetp可导致血浆Hdl升高,改变脂质代谢,降低动脉粥样硬化风险,但是敲除cetp后会激活自噬,增加炎性反应,具有促动脉粥样硬化作用。本研究结果表明,CETP在动脉粥样硬化中具有抗动脉粥样硬化和促动脉粥样硬化双向调节作用,CETP在炎性反应中的具体作用机制仍需进一步研究。

