二氢丹参酮Ⅰ促进人食管鳞癌细胞系EC9706凋亡
汪秀梅,王康康,陈晓燕,罗金键
(郑州大学附属郑州中心医院 消化内科, 河南 郑州 450007)
食管癌(esophageal cancer)是常见的一种恶性肿瘤,在中国,食管癌发生率以及病死率居于世界首位,其中以恶性程度高、易转移、预后差为特点的食管鳞状细胞癌(esophageal squamous cell carcinoma)是中国食管癌最主要的亚型[1]。Wnt/β-catenin信号通路是保守且古老的通路,在细胞增殖、迁移、凋亡等生物活动中具有调控作用[2]。研究表明,Wnt/β-catenin信号通路通过操纵该通路中的β-环连蛋白(β-catenin)、细胞周期蛋白D1(cyclin D1)等关键蛋白发挥其在肿瘤细胞中的生物学作用[3]。
药理学研究显示,中药丹参提取物二氢丹参酮Ⅰ具有抗肿瘤、抗感染和预防心血管疾病的作用[4]。但是其对食管癌的作用少有报道。本研究拟探讨二氢丹参酮Ⅰ能否抑制EC9706细胞的增殖和迁移及能否促进EC9706细胞凋亡,并探索可能通过的作用机制。
1 材料与方法
1.1 材料
人食管鳞癌细胞系(human esophageal squamous cell carcinoma cell line)EC9706(中国科学院上海细胞库);二氢丹参酮Ⅰ(纯度98%,百灵威科技有限公司);RPMI-1640培养基(Gibco公司);青链霉素和胎牛血清(Hyclone公司);细胞计数试剂盒-8(Beyotime公司);兔抗人β-catenin、cyclin D1和c-myc多克隆抗体(Santa Cruz公司);兔抗人β-actin多克隆抗体(北京中山金桥生物技术有限公司);Annexin V-FITC试剂盒(BD公司);碘化吡啶PI(Sigma-Aldrich公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:将EC9706细胞加入在含有10%胎牛血清以及含1%青霉素和链霉素的RPMI-1640培养基中,于37 ℃、5% CO2环境中培养。根据细胞培养液颜色的变化换液,待细胞贴壁增殖至培养瓶底部约80%时,用胰蛋白酶消化、然后传代培养,取对数期细胞进行后续实验。
1.2.2 CCK-8法检测细胞增殖:将处于对数期的EC9706细胞制成单细胞悬液,取500 μL于1.5 mL离心管中,在显微镜下细胞计数3次,算出每个孔里需要加的原液量,然后在96孔板中加200 μL细胞悬液于培养箱(5% CO2、37 ℃)中培养24 h。第2天,弃去旧培养基每个孔里加50 μL用培养基稀释的浓度分别为0、10和30 μmol/L二氢丹参酮 Ⅰ 混悬液,每一浓度组重复设3孔。培养24 h后弃去旧培养液,每个孔里加入100 μL新的培养基和10 μL CCK-8试剂。培养4 h后,在波长450 nm处用酶标仪检测吸光度(A)值,按如下公式计算,每个实验至少重复3次。细胞抑制率=(对照组平均A值-实验组平均A值)/对照组平均A值×100%。
1.2.3 划痕实验检测细胞迁移能力:细胞与药物共处理同1.2.2,将经处理的EC9706细胞接种在6孔板中,于培养箱中继续培养,待细胞达到80%以上汇合时,弃去培养液,用无菌PBS洗3次后于不含血清培养基中饥饿处理12 h,然后用10 μL无菌枪头垂直于培养板划痕,再用无菌PBS洗3次以去除细胞碎片,每4 h于倒置显微镜下观察1次细胞形态并拍照,将图片用Image-Pro Plus v.6.2软件处理,比较0、48 h划痕两侧的距离。每组重复3次实验。
1.2.4 流式细胞仪检测细胞凋亡:使用annexin V-FITC/PI双染法用流式细胞仪检测细胞凋亡。具体如下:细胞与药物共处理同1.2.2,将处理好的EC9706细胞接种在6孔板中,培养48 h,然后用不含EDTA的胰蛋白酶消化并且在冷PBS中洗涤2次,制成细胞悬液,然后加入5 μL annexin V-FITC/PI,避光孵育15 min,用流式细胞仪检测细胞凋亡率。
1.2.5 Western blot检测EC9706细胞内β-catenin、cyclin D1和c-myc蛋白的表达:将处理后的EC9706细胞裂解,然后用BCA蛋白定量试剂盒测定蛋白质浓度,取30 μg蛋白样品进行SDS-PAGE电泳,电泳完成后将分离开的蛋白质转到PVDF膜上,在摇床上用5%的脱脂牛奶室温封闭2 h,加入各蛋白条带相对应的一抗稀释液4 ℃孵育过夜,用TBST洗膜,然后加入二抗,在室温条件下孵育2 h,TBST洗膜,于暗室曝光显影。以β-actin为内参,用Image-Pro Plus v.6.2软件分析各组蛋白质的相对表达量。
1.3 统计学分析
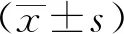
2 结果
2.1 二氢丹参酮Ⅰ对细胞增殖的影响
二氢丹参酮Ⅰ呈剂量依赖性抑制细胞增殖(P<0.001)(图1)。

*P<0.001 compared with the 0 μmol/L concentration group
2.2 二氢丹参酮Ⅰ可抑制EC9706细胞迁移
二氢丹参酮Ⅰ 10 μmol/L组划痕之间的宽度略大于对照组,30 μmol/L浓度组划痕间宽度明显大于对照组(图2)。
2.3 二氢丹参酮Ⅰ诱导EC9706细胞凋亡
与对照组相比,二氢丹参酮Ⅰ治疗组中细胞凋亡率明显增加,呈剂量依赖性(图3)。
2.4 二氢丹参酮Ⅰ对EC9706细胞内β-catenin、cyclin D1和c-myc蛋白表达的影响
二氢丹参酮 Ⅰ 治疗组细胞中β-catenin、cyclin D1及c-myc三者的蛋白表达量均有不同程度的下降(P<0.05),且呈剂量依赖性(P<0.05)(图4)。

A.migration distance of each group of cells (×200); B.degree of scratch closure of cells in each group;*P<0.001 compared with the 0 μmol/L concentration group
图2 划痕试验检测二氢丹参酮Ⅰ对EC9706细胞的迁移能力的影响


A.apoptosis was measured by flow cytometry in different concentrations of dihydrotanshinoneⅠ; B.the apoptosis rate of EC9706 cells after treatment with different concentrations of dihydrotanshinoneⅠ;*P<0.001 compared with the control group;#P<0.001 compared with the 10 μmol/L concentration group
图3 流式细胞仪检测各组细胞凋亡


*P<0.05 compared with the control group (0 μmol/L); #P<0.05 compared with the 10 μmol/L group
3 讨论
二氢丹参酮Ⅰ是丹参中主要的脂溶性成分,也是最重要的抗肿瘤成分[5]。实验证明,二氢丹参酮Ⅰ通过增大线粒体膜电位使乳腺癌细胞处于G1期阻滞,抑制细胞增殖[6]。但鲜有关二氢丹参酮Ⅰ对食管癌细胞影响的报道。本实验探索二氢丹参酮Ⅰ对EC9706细胞增殖、迁移和凋亡的影响,并深入研究其对Wnt/β-catenin信号通路上下游因子的影响。
Wnt通路是进化保守的传导途径,参与调控多种重要的生物活动,如细胞增殖、分化和凋亡等,调控因子缺失或者异常激活会造成肿瘤发生[7]。β-catenin是细胞内最重要的蛋白,其降解功能障碍会造成游离的β-catenin在胞质内蓄积,激活cyclin D1及c-myc等下游靶基因,使细胞增殖分化失去控制,从而造成肿瘤的发生[8]。当β-catenin功能异常时,与α-catenin/E-钙黏蛋白结合成的复合体分离,激活β-catenin的活性,E-钙黏蛋白的表达下降、波形蛋白等刺激细胞移动的蛋白表达上调,使细胞极性消失、黏附性下降,致肿瘤细胞迁移和侵袭[9]。该实验研究结果表明,二氢丹参酮Ⅰ处理后,EC9706细胞的迁移能力下降,且随着药物浓度增大,细胞的迁移能力更弱。二氢丹参酮Ⅰ处理组与对照组相比,可抑制β-catenin、cyclin D1及c-myc蛋白表达,同样也具有剂量依赖性。
原癌基因(c-myc)作为β-catenin通路中的一个下游靶基因,其在癌发生和转移的过程中起重要作用[10]。在多种类型的肿瘤中,c-myc都有较高的表达,其通过作用于BCL-2、c-ABL等增殖、凋亡关键蛋白,发挥出促癌作用[11]。cyclin D1是一种被公认的原癌基因,其过度的表达会导致细胞增殖失去控制而恶化[12]。该实验研究显示,二氢丹参酮Ⅰ治疗组细胞的增殖能力有所降低,凋亡率有所上升,且有剂量依赖性。该结果说明,二氢丹参酮Ⅰ可能是通过抑制cyclin D1和c-myc的蛋白表达发挥作用的。
综上所述,二氢丹参酮Ⅰ能够靶向调控食管癌肿瘤细胞增殖、迁移、凋亡等细胞生物学活性,该作用可能是通过调控Wnt/β-catenin信号通路中的某些关键因子来实现的。

