亚甲基四氢叶酸还原酶基因多态性与强直性脊柱炎基因组DNA甲基化水平的相关性
毛 妮,陈进伟,王 佳,谢 希,李 芬,刘一鸣
中南大学湘雅二医院风湿免疫科 中南大学临床免疫中心,长沙 410021
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性进行性自身免疫性疾病,主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节,并可伴发关节外表现,严重者可发生脊柱畸形和关节强直。AS的发病因素复杂,人类基因组学研究显示,AS是一种与遗传基因高度相关的疾病,并揭示了其特异的免疫通路,包括白细胞介素(interleukin,IL)-17/IL-23通路、核因子κB(nuclear factor kappa-B,NF-κB)激活、氨基酸修饰后的主要组织相容性复合体(magjor histocompatibility,MHC)提呈,以及其他基因控制的CD8+和CD4+T细胞亚群等。Höhler等[1]对单卵双胞胎AS患者免疫学参数的研究发现,虽然90%的AS患者携带人类白细胞抗原-B27(human leukocyte antigen-B27,HLA-B27)基因,但是HLA-B27Ⅰ类抗原对于AS发病风险的估计仅约20%~50%,提示在AS患者中可能存在基于非基因序列改变的基因表达调控功能紊乱。DNA甲基化是表观遗传学与自身免疫性疾病之间关系的研究重点,DNA甲基化使基因静默,而去甲基化使基因活化,成年后基因组甲基化状态的改变通常具有致病性[2-3]。由于DNA甲基化所需要的一碳单位通过叶酸代谢通路提供,作为叶酸代谢通路的一个重要代谢酶-亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)的活性与甲基基因供应存在紧密联系。目前已有研究表明,MTHFR基因多态与红细胞叶酸水平和基因组甲基化程度有关,而这种基因突变相关的表观遗传修饰改变介导了疾病的发生[4-5]。综合国内外文献发现,目前针对AS发病机制的表观遗传学研究尚少,主要集中在HLA-B27基因和CD4+T细胞。本研究评估了AS基因组DNA甲基化模式及其与MTHFR基因多态性之间的关系,探讨了MTHFR基因多态性和DNA去甲基化在AS发病中可能的作用机制,以期指导AS的诊疗和新药研制。
对象和方法
对象2011年9月1日至2013年12月31日在中南大学湘雅二医院风湿免疫科就诊的HLA-B27(+)AS患者200例(AS组),均符合1984年美国风湿病学会(American College of Rheumatology,ACR)修订的纽约标准,其中,男157例,女43例,平均年龄(23.5±9.0)岁(14~50岁),平均病程(9.6±5.0)个月(4~36个月)。2013年1月1日至2013年12月31日在中南大学湘雅二医院体检中心随机选取健康人120名(对照组),其中,男89人,女31人,平均年龄(26.0±6.6)岁(20~55岁);两组受试者在性别(χ2=0.079,P=0.750)和年龄(t=1.714,P=0.100)方面差异无统计学意义。本研究经中南大学湘雅二医院伦理委员会审核批准,所有患者均签署知情同意书。
主要试剂与仪器DPC Immulite全自动化学发光免疫分析仪购自德国Siemens公司,PCR反应扩增仪购自加拿大BBI公司,紫外光凝胶成像系统购自美国UVP公司;人血浆同型半胱氨酸(homocysteine,Hcy)试剂盒购自美国TPI公司,红细胞叶酸检测试剂盒购自美国Beckman公司,细胞基因组DNA提取试剂盒购自北京天根生化科技有限公司,Epitect Bisulfite Kit购自美国QIAGEN公司。
样本采集与处理所有受试者均于晨起空腹采肘正中静脉血6 ml,EDTA抗凝,立即置于4℃冰箱中,在1 h内4℃ 3500 r/min(r=10 cm)离心10 min,血浆置-20℃冰箱冷冻待测(实验时于37℃温浴并混匀后使用);余下抗凝血采用北京天根生物技术公司提供的DNA提取试剂盒,提取DNA-80℃保存备用。
基因组DNA甲基化水平检测采用胞嘧啶延伸法,取2 μg DNA,加入1 μl核酸内切酶HpaⅡ(TaKaRa Biotechnology公司),5 μl 10XNEB buffer,双蒸水补至总体积50 μl,37℃消化过夜;56℃延伸1 h,然后置于冰上;取双份10 μl反应液点于whatman DE-81离子交换滤纸上,用磷酸钠缓冲液(PH 7.0)室温下洗3次。干燥滤纸,液闪计数。相对[3H]-dCTP参入率/μg DNA为酶处理样本放射标记参入率或背景放射标记参入率。
血浆Hcy浓度检测按照血浆Hcy浓度检测试剂盒说明书操作(美国TPI公司)。
红细胞叶酸浓度检测按照红细胞叶酸浓度检测试剂盒说明书操作(美国Beckman公司)。
统计学处理采用SPSS 19.0统计软件,符合正态分布的计量资料以均数±标准差表示,两样本均数比较首先行方差齐性检验,方差齐使用t检验,方差不齐使用t’检验;多个样本均数比较采用方差分析(analysis of variance,ANOVA);叶酸浓度、血浆Hcy浓度和基因组DNA甲基化水平的比较采用M和95%CI表示,组内各基因型比较采用方差分析,两组各基因型比较采用t检验;P<0.05为差异有统计学意义。
结 果
MTHFR C677T多态性与AS的关系AS组患者MTHFR基因位点C677TT基因型的比例明显高于正常对照组(17.0% 比 5.0%;χ2=9.874,P=0.002),两组在677CC(χ2=3.017,P=0.082)和677CT基因型(χ2=0.714,P=0.714)比例方面差异无统计学意义(表1)。
MTHFR C677T各基因型血浆Hcy浓度的比较AS组的血浆Hcy浓度为(18.71±2.42)μmol/L,明显高于正常对照组的(10.97±2.93)μmol/L(t=24.402,P<0.001);AS组MTHFR基因位点C677CC(t=17.402,P<0.001)、C677CT(t=16.166,P<0.001)、C677TT基因型(t=10.686,P<0.001)的血浆Hcy浓度均明显高于相应正常对照组(表2)。以血浆样本实测OD值所对应浓度为纵坐标(Y轴),以标准品浓度为横坐标(X轴),绘制标准曲线,r=0.9975,两者相关性良好。AS组中MTHFR基因位点C677CC、C677CT和C677TT基因型组的血浆Hcy浓度分别为(18.31±1.94)、(17.80±2.18)和(21.70±1.80)μmol/L,差异有统计学意义(F=225.039,P=0.000),其中C677CC(q=12.088,P=0.01)和C677CT基因型组(q=6.496,P=0.01)的血浆Hcy浓度均明显低于C677TT基因型组。
MTHFR C677T多态性、血浆Hcy浓度、红细胞叶酸浓度与基因组DNA甲基化水平的关系AS组MTHFR 677位点各基因型DNA甲基化水平与正常对照组相比差异有统计学意义(F= 29.806,P<0.001);AS组MTHFR 677位点各基因型间DNA甲基化水平差异有统计学意义(F=71.088,P<0.001);AS组C677TT基因型基因组DNA甲基化水平明显低于正常对照组(t=5.655,P<0.001)和AS组的C677CC(t=11.514,P<0.001)及C677CT基因型(t=10.287,P<0.001)。AS组MTHFR 677位点各基因型红细胞叶酸浓度与正常对照组相比差异无统计学意义(F=0.699,P=0.404)。AS组C677CC(t=17.402,P<0.001)、C677CT(t=16.166,P<0.001)和C677TT基因型(t=10.686,P<0.001)的Hcy浓度均明显高于正常对照组(表3)。
讨 论
随着表观遗传学研究的飞速发展,目前已经证实各种不同类型的表观遗传学修饰机制都与自身免疫疾病发生有关,由环境等因素导致的免疫系统表观遗传稳态的紊乱,可引起基因异常表达,导致T细胞的分化及反应性发生改变,与免疫性疾病发病密切相关[6]。综合国内外文献发现,目前针对AS发病机制的表观遗传学研究尚少,主要集中在HLA-B27基因和CD4+T细胞。Appel等[7]对AS患者滑膜及外周血CD4+CD25+CD127-T 细胞的研究发现,CD4+CD25+CD127-T细胞处于去甲基化状态,这种甲基化修饰的改变增加了转录因子Foxp3的表达,而Foxp3的过度表达被认为与自身免疫性疾病的发病有关。另有研究表明,DNA甲基化与组蛋白去乙酰化可明显上调HLA-B27基因表达水平[8]。本课题组以往研究显示,AS患者MTHFR基因T/T型突变是高Hcy血症的重要影响机制,而高Hcy血症是AS发生的独立危险因素,提示MTHFR基因多态性与AS发病有关[9]。基于以上研究基础,我们认为MTHFR基因虽然不是AS的易感基因,但却在AS发病中起着重要的作用,其具体作用机制在本次研究中得以进一步揭示。本研究发现,MTHFR基因677位点多态性、DNA甲基化水平与AS的发病相关,MTHFR基因677位点T/T型突变可导致AS基因组DNA低甲基化,MTHFR基因677位点T/T型突变导致血浆Hcy浓度升高。由于MTHFR可以催化5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,5-甲基四氢叶酸作为一碳单位的供体参与Hcy甲基化生成甲硫氨酸,甲硫氨酸活化S-腺苷甲硫氨酸并作为甲基的供体参与许多代谢反应。如果MTHFR发生突变或者功能异常,就会导致合成的 5-甲基四氢叶酸相对于生成新的甲硫氨酸严重不足,使Hcy的转硫基和甲基化过程出现障碍,进而Hcy堆积、叶酸代谢障碍,最终导致基因组DNA 和一些特殊基因的低甲基化,这种改变和基因突变一样可以导致疾病的发生。综上,在AS患者中存在非基因序列改变导致的DNA表达调控功能的紊乱。MTHFR 677位点T/T型突变增加AS发病风险的机制与其引起DNA甲基化状态紊乱有关。MTHFR基因多态性通过降低MTHFR活性,减少甲基供体导致高Hcy血症和DNA低甲基化而与AS发病相关。高Hcy血症致AS的确切机制目前仍不十分清楚,但已有研究结果表明,高Hcy血症可增强对炎症因子的激活作用、触发自身免疫机制[10-11];Hcy还可以通过修饰T细胞的HLAⅠ类抗原,如HLA-B27分子及其他表面分子等,导致细胞毒性T细胞的功能发生异常,使CD4+T细胞具有自身反应性,导致自身免疫性疾病的发生[12]。

表1 MTHFR C677T基因多态性基因型频率在AS组和对照组间的比较[n(%)]Table 1 Genotype frequencies of MTHFR C677T polymorphism in AS group and normal control group [n(%)]
MTHFR:亚甲基四氢叶酸还原酶;AS:强直性脊柱炎
MTHFR:methylenetetrahydrofolate reductase;AS:ankylosing spondylitis
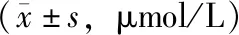
表2 AS组和正常对照组MTHFR C677T各基因型血浆同型半胱氨酸浓度的比较Table 2 Plasma homocysteine levels of MTHFR C677T genotypes in AS group and normal control
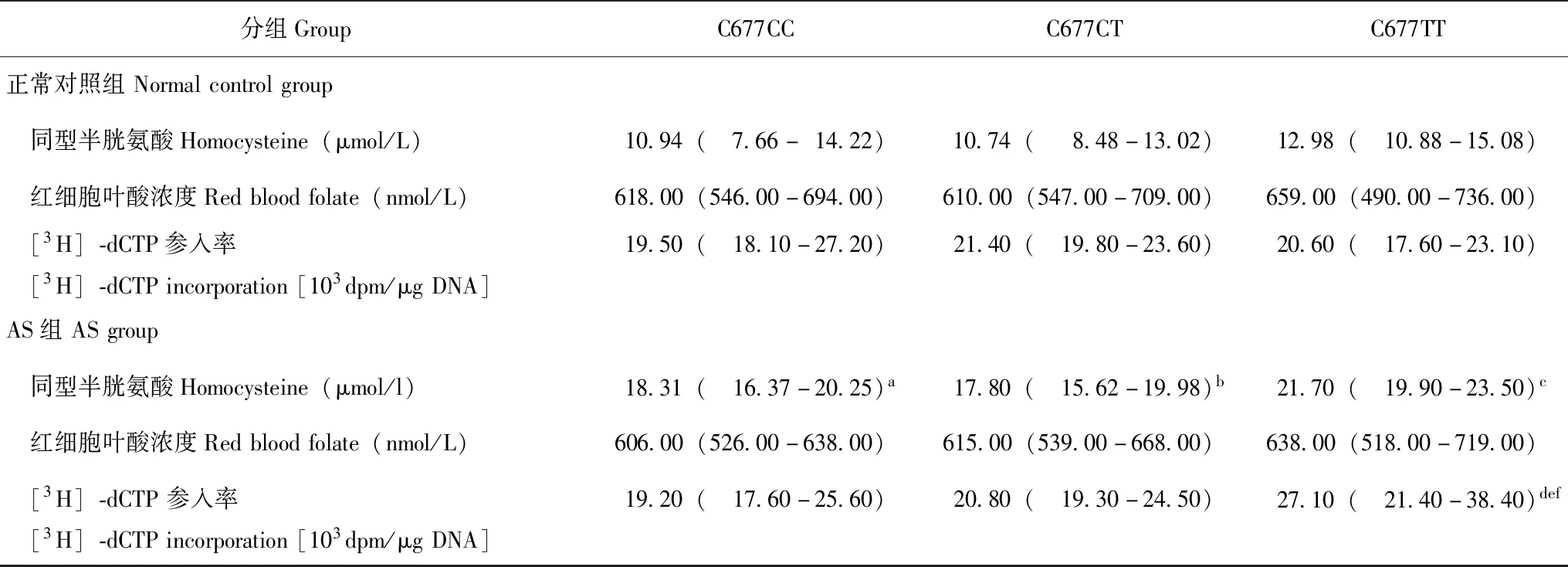
表3 MTHFR C677T基因多态性、血浆Hcy浓度、红细胞叶酸浓度与基因组DNA甲基化水平的关系[M(95%CI)]Table 3 Correlations of MTHFR C677T gene polymorphism,plasma Hcy concentration,and erythrocyte folic acid concentration with genomic DNA methylation level [M(95%CI)]
与正常对照组比较,at=17.402,P<0.001;bt=16.166,P<0.001;ct=10.686,P<0.001;dt=5.655,P<0.001;与C677CC基因组比较,et=11.514,P<0.001;与C677CT基因组比较,ft=10.287,P<0.001
at=17.402,P<0.001;bt=16.166,P<0.001;ct=10.686,P<0.001;dt=5.655,P<0.001 compared with normal control group;et=11.514,P<0.001 compared with C677CC genetype group;ft=10.287,P<0.001 compared with C677CT genetype group
此外,本研究结果发现,携带MTHFR 677位点T/T基因型AS患者基因组DNA出现低甲基化,而且这种联系与红细胞叶酸水平无明显相关。膳食叶酸来源、机体叶酸摄入量以及代谢过程均会影响DNA甲基化所需的甲基基团供应。充足的叶酸能提供足够的甲基基团用于DNA甲基化过程,如果叶酸摄入不足,则DNA合成与修复和甲基化过程均会受到影响,MTHFR基因多态导致酶活性下降,使得DNA甲基过程发生紊乱[13-15]。MTHFR基因多态对DNA甲基化的影响程度在不同叶酸和维生素B摄入量的情况下也有所不同。由于自身免疫性疾病的发生、发展是一个多基因、多因素共同参与的慢性过程,有关的研究有待进一步深入。

