蛋白磷酸酶2A催化亚基下调参与人tau蛋白所致线粒体分裂融合和功能失衡
柳秀平,郑 铮,喻丽玲,胡 娟,李夏春
1杭州市中医院检验科,杭州 310007 2三峡大学第一临床医学院肿瘤科,湖北宜昌 443002 3三峡大学医学院生理与病理生理学系,湖北宜昌 443002
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是广泛表达的丝苏氨酸蛋白激酶,由催化亚基PP2Ac和结构亚单位(脚手架蛋白)PP2Aa组成核心酶,再与各调节亚单位PP2Ab形成全酶。阿尔茨海默病(Alzheimer disease,AD)患者PP2A活性下降,其引起神经元tau蛋白过度磷酸化和记忆障碍,导致胶质细胞活化迁移受阻致Aβ清除障碍而聚集成老年斑[1-3]。线粒体是不断进行分裂融合的细胞器,其分裂融合动态不仅决定线粒体的形态、大小、分布和功能,也参与线粒体损伤修复。有研究报道PP2A调节亚基Bβ2的N端20-22位丝氨酸可使其定位于神经元线粒体外膜,形成的PP2A/Bβ2全酶可使线粒体分裂蛋白动力蛋白样蛋白1(dynamin-like protein 1,DLP1)去磷酸化激活,诱导线粒体分裂和神经元凋亡而抑制其生长[4-5]。也有研究发现,PP2A抑制剂冈田酸(Okadaic acid,OA)可导致神经元线粒体碎裂和氧自由基大量产生[6]。因此,PP2A的分布和活性对神经元线粒体分裂融合动态的调节尚存争议。
近年多项研究证实,AD患者早期存在线粒体分裂融合障碍[7]。作者前期研究发现人tau蛋白表达引起 HEK293细胞和原代神经元出现线粒体分裂融合动态失衡,早期并无细胞活力降低和突起缩短,晚期有神经元突起显著缩短和细胞活力降低[8]。人tau蛋白在细胞内积聚过程中,胞浆内的PP2A活性变化是否参与人tau蛋白引起的线粒体分布和功能异常尚未见研究报道。由于大鼠原代神经元线粒体偏小,共聚焦显微镜实时观察线粒体分裂融合动态困难;HEK293 细胞PP2A表达水平较高[9],线粒体较大,也可以合成神经细丝和α-丝联蛋白等典型的神经元内蛋白,具有部分神经细胞特征[10]。因此,本研究在大鼠原代海马神经元表达人tau蛋白,检测线粒体在突起的分布变化和线粒体分裂融合蛋白及PP2Ac和PP2Ab蛋白水平的变化,并进一步在大鼠原代海马神经元和HEK293细胞(293wt)转染siPP2Ac质粒48 h后检测了线粒体形态、分布及线粒体膜电位和细胞活力,还在稳定表达人tau的HEK293细胞(293htau)共转染PP2Ac-eGFP质粒和mito-dsRed质粒48 h后检测线粒体形态分布和功能,以期揭示PP2Ac是否参与人tau蛋白引起的线粒体分裂融合动态失衡和功能障碍。
材料和方法
材料DMEM培养基和胎牛血清购自美国Gbico公司,青霉素、链霉素和细胞计数试剂盒-8(cell counting kit-8,CCK8)购自美国Sigma公司,鼠源单克隆抗体DLP1抗体、线粒体融合蛋白1(mitofusin 1,MFN1)抗体、线粒体融合蛋白2(mitofusin 2,MFN2)抗体、视神经萎缩蛋白1(optic atrophy 1,OPA1)抗体、马达蛋白重链(kinesin heavy chain,KHC)抗体、细胞色素C氧化酶Ⅳ(cytochrome c oxidase Ⅳ,COXⅣ)抗体、微管相关蛋白2(microtubulin associated protein 2,MAP2)抗体、α-tubulin抗体购自英国Abcam 公司,兔源多克隆 Fis1 抗体购自美国Invitrogen公司。标记线粒体的mito-Dsred质粒和mito-Dendra2 质粒由美国祝雄伟教授赠予王建枝教授再转赠。人 pIRES-eGFP-tau40质粒由Dr.Khalid Iqbal教授赠予王建枝教授再转赠。siPP2AC为短发卡RNA编码质粒,设计4段序列靶向大鼠PP2Ac[NM017039,有效序列(CTGAGAAAG-TCAGGTTTGA)] 和假对照序列被克隆入U6 增强子后的pGCSIL-EGFP或pGCSIL。siPP2AC质粒、PP2Ac-EGFP质粒及对照质粒均由王建枝教授馈赠。
海马神经元线粒体形态分布分析大鼠胚胎18d(E18)的原代海马神经元培养9d(DIV9)后共转染mito-dsRed质粒和htau40或vector质粒48 h后,4%多聚甲醛-PBS 固定40 min,PBS洗2遍,再用含0.5%Triton X-100的PBS破膜10 min,DAPI染细胞核15 min,含0.05%Triton X-100的PBS洗涤3次后封片。大鼠原代海马神经元共转染siPP2Ac-EGFP和mito-dsRed质粒48 h后,4%多聚甲醛-PBS固定40 min,PBS洗2遍,含0.5%Triton X-100的PBS破膜10 min,3%BSA-PBS封闭40 min后,加入MAP2抗体4℃孵育过夜,再加入 AlexaFluor®594二抗孵育1 h后,用含0.05%Triton X-100的PBS洗涤3次后封片,再用激光共聚焦显微镜摄像,DAPI激发波长405 nm,GFP激发波长488 nm,mito-dsRed激发波长543 nm,Alexa Fluor激发波长594 nm。测量距胞体起始段300 μm的轴突段内线粒体分布密度,以轴突线粒体指数=总的线粒体长度/轴突长度表示线粒体分布密度。
HEK293细胞线粒体形态分布分析293wt和293htau细胞(王建枝教授赠予)采用 DMEM 培养基(Gbico)加10%胎牛血清、1%青霉素和1%链霉素,在5%CO2培养箱37℃培养,293htau 细胞加G418 筛选(200 μg/ml,美国Gibco公司)。细胞用24孔板按照105个/孔密度接种生长至90%丰度时,293wt细胞用共转染siPP2Ac-EGFP或ssiPP2Ac-EGFP质粒和mito-Dsred 质粒(siPP2Ac-EGFP质粒与mito-dsRed质粒比值为2∶1),293htau细胞共转染PP2Ac-EGFP 质粒和mito-dsRed质粒,48 h后用DAPI染细胞核后封片,Zeiss710共聚焦显微镜摄像,统计分析100个细胞内线粒体平均长度、线粒体形态分类比例及线粒体分布正常和异常细胞比例。正常细胞内的大多线粒体形态为短管状或腊肠状,少数碎裂的线粒体为球状,少数线粒体为长管状。线粒体分布正常:细胞内线粒体均匀分布于胞体和突起处,未被线粒体覆盖区域小于胞体面积10%。线粒体分布异常:细胞内线粒体聚集于核周围或偏侧分布,未被线粒体覆盖区域超过胞体面积10%。
HEK29细胞线粒体分裂融合动态实时观测293wt细胞共转染siPP2Ac或ssiPP2Ac质粒和mito-Dendra2质粒40 h后,置于5%CO2、37℃恒温恒湿的Zeiss510配套活细胞工作站内(Zeiss CTI-Controller 3700),用Zeiss510倒置激光共聚焦显微镜进行连续扫描采集图像,观测细胞线粒体分裂、融合动态。红色信号用543 nm激发光560 nm滤片采集,绿色信号用488nm激发光500~550 nm滤片采集。mito-Dendra2在低能量488 nm激发光(3%~5% power)照射下,只呈现绿色信号,无红色信号。当用高能量488 nm激发光(50% power)照射放大的感兴趣区(region of interested,ROI)20次总计50 s时,ROI区域绝大部分绿色信号消退而出现红色信号,临近ROI区的未照射线粒体仍呈绿色,再采用488 nm激发光(3%~5% power)照射(无明显光毒性和光漂白),以12 s每帧速度摄像1 h观测整个细胞内线粒体动态,记录照射区域红色完全转变为黄色所需时间作为线粒体融合时间。
线粒体膜电位分析293wt和293htau细胞以106个(100 μl)每孔接种于96孔板中,当细胞生长至90%丰度时,293wt细胞转染siPP2Ac或ssiPP2Ac质粒48 h,293htau 细胞转染PP2Ac-EGFP或vector-EGFP质粒48 h后,分别加入DMSO 10 μl或加入 CCCP(10 μmol/L),37℃孵育30 min,再加入5 mg/ml JC-1,37℃孵育20 min,用多功能酶标仪测定红色荧光(激发光585 nm/发射光600 nm,线粒体膜电位较高时,JC-1聚集在线粒体基质中形成聚合物呈红色荧光),绿色荧光(激发光485 nm/发射光535 nm,JC-1在膜电位低下的线粒体内呈单体形式产生绿色荧光),计算红色荧光/绿色荧光的比值反映细胞内相对线粒体膜电位水平。
线粒体分裂融合蛋白定量分析大鼠原代海马神经元培养9 d后转染vector质粒或 htau40质粒48 h后收集蛋白,293wt细胞生长至90%丰度时转染ssiPP2Ac质粒或siPP2Ac 质粒48 h后收集蛋白,加入1/3体积4×样品缓冲液煮沸10 min后BCA法测蛋白浓度。采用 10%或12%聚丙烯酰胺凝胶电泳分离蛋白后电转移至醋酸纤维膜(NC膜)1 h。NC膜用5%脱脂牛奶/TTBS室温振荡封闭1 h,取出NC膜,加入适当稀释的一抗于4℃孵育过夜。TTBS缓冲液洗NC膜3×10 min。加入结合IRDyeTM的兔或鼠IgG二抗(800CW)(1∶10 000)室温孵育 1 h。TTBS缓冲液洗NC膜3×10 min。取出NC膜,用奥德赛扫描成像系统(Licor biosciences)扫描免疫印迹条带,分析条带强度。
细胞活力测定293wt细胞按每孔105个细胞接种于96孔板中,生长至80%丰度时转染 ssiPP2Ac质粒或siPP2Ac质粒,48 h后弃培养基,每孔加入无血清DMEM培养基100 μl和 CCK8 液10 μl,并在无细胞孔里加入100 μl DMEM培养基和CCK8液10 μl作为空白对照,将培养板在培养箱内孵育2 h,用酶标仪测定450 nm吸光度。计算细胞活力公式:细胞活力=[A实验组-A空白]/[A对照组-A空白]×100%。A实验组:具有细胞、CCK8溶液和药物溶液孔的吸光度,A空白:具有培养基和CCK8溶液而无细胞孔的吸光度。
统计学处理采用SPSS 12.0统计软件,符合正态分布的计量资料以均数±标准差表示表示,组间比较采用双尾t检验,P<0.05为差异有统计学意义。
结 果
大鼠原代海马神经元表达人tau蛋白引起轴突线粒体分布密度和PP2Ac显著下降大鼠原代海马神经元表达人tau蛋白48 h后,用MAP2抗体染突起和DAPI染细胞核后封片,共聚焦显微镜观察结果显示,与空载体相比,人tau表达原代神经元轴突内线粒体分布密度显著下降。免疫印迹检测结果显示,表达人tau的原代海马神经元内PP2Ac(t=4.814,P=0.0086)、MFN2(t=3.959,P=0.0167)、MFN1(t=4.193,P=0.0138)和OPA1(t=3.069,P=0.0370)均较空载体显著下降,DLP1(t=1.233,P=0.3428)和KHC(t=1.248,P=0.3383)与空载体差异无统计学意义(图1)。
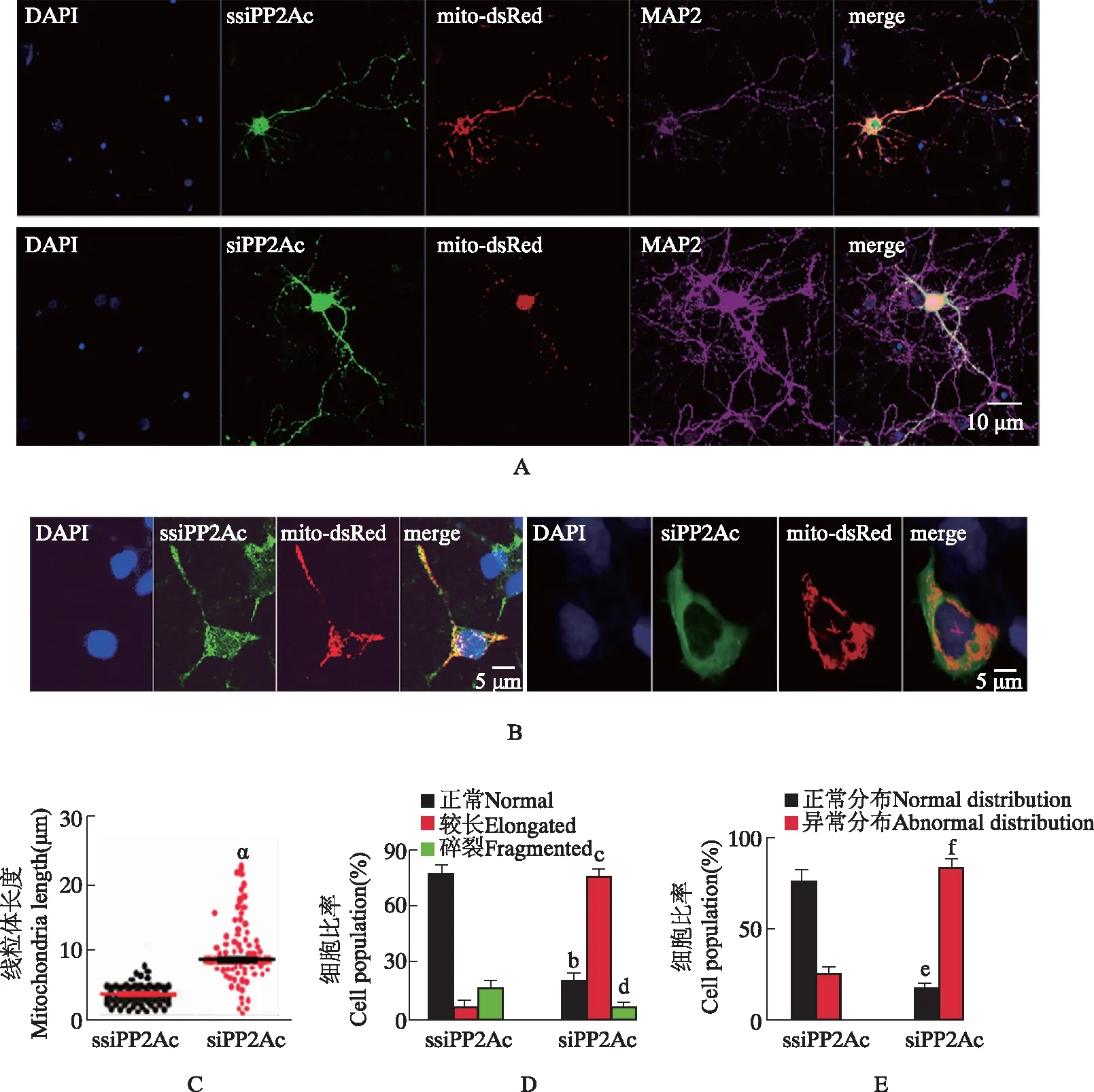
下调PP2Ac使原代大鼠海马神经元和293wt细胞线粒体异常分布于核周胞体大鼠原代海马神经元和293wt细胞转染ssiPP2Ac-EGFP质粒或siPP2Ac-EGFP质粒和标记线粒体的 mito-dsRed质粒48 h后,共聚焦显微镜观察结果显示,大鼠原代海马神经元转染siPP2Ac组与对照组相比轴突线粒体分布密度显著下降。293wt细胞转染siPP2Ac-EGFP质粒和标记线粒体的mito-Dsred质粒48 h后摄像结果也显示,与对照细胞相比,转染siPP2Ac质粒的293wt细胞线粒体平均长度显著增加(t=7.313,P<0.001),正常短管状线粒体比例(t=12.490,P<0.0001)和碎裂线粒体比例(t=2.276,P=0.0154)显著下降,长管状线粒体显著增多(t=19.210,P<0.0001),线粒体异常分布于核周围细胞比例也显著增加(t=13.000,P<0.0001)(图2)。
下调PP2Ac促进293wt细胞线粒体融合加速293wt细胞共转染siPP2Ac(或ssiPP2Ac)质粒和标记线粒体的mito-Dendra2质粒40 h后,采用50%强度488 nm激光多次高倍照射选定区域线粒体使其激活呈现红色,临近未照射激活的线粒体仍呈绿色,实时动态观测照射区域红色完全转变为黄色所需时间可测定线粒体完全融合时间。结果显示,siPP2Ac 表达后选定区域激活的线粒体与邻近线粒体完全融合时间平均仅需(11.17±3.86)min,明显短于ssiPP2Ac对照组的(18.78±2.69)min(t=2.857,P=0.0074)(图3)。
下调PP2Ac引起293wt细胞融合蛋白MFN1和MFN2水平升高免疫印迹检测结果显示,PP2Ac表达显著下调后(t=5.788,P=0.0044),293wt细胞融合蛋白MFN1(t=6.768,P=0.0025)、MFN2(t=3.121,P=0.0035)和OPA1(t=3.775,P=0.0199)的相对表达水平显著升高,分裂蛋白DLP1和Fis1及线粒体标记蛋白COXⅣ和微管蛋白的改变均无统计学意义(P均>0.05)(图4)。

OPA1:视神经萎缩蛋白1;DLP1:线粒体动力样蛋白1;MFN2:线粒体融合蛋白2;MFN1:线粒体融合蛋白1;KHC:驱动蛋白重链;PP2Ac:蛋白磷酸酶2A催化亚基;Mr:相对分子质量;与对照组比较,at=3.069,P=0.0370;bt=1.233,P=0.3428;ct=3.959,P=0.0167;dt=4.193,P=0.0138;et=1.248,P=0.3383;ft=4.814,P=0.0086
OPA1:optic atrophy 1 protein;DLP1:dynamin-like protein 1;MFN2:mitofusin 2 protein;MFN1:mitofusin 1 protein;KHC:kinesin heavy chain;PP2Ac:protein phosphatase 2A catalytic subunit;Mr:relative molecular mass;at=3.069,P=0.0370;bt=1.233,P=0.3428;ct=3.959,P=0.0167;dt=4.193,P=0.0138;et=1.248,P=0.3383;ft=4.814,P=0.0086 compared with vector
A.大鼠原代海马神经元人tau蛋白表达48 h时和对照组的线粒体分布图;B.大鼠原代海马神经元人tau蛋白表达48 h与对照组的突起线粒体分布密度比较;C.大鼠原代海马神经元人tau蛋白表达48 h时与对照组的OPA1、DLP1、MFN2、MFN1、KHC及PP2Ac的免疫印迹;D.C图免疫印迹的定量统计分析
A.the image of mitochondria distribution of rat primary hippocampal neurons transfected with htau40 or vector plasmids;B.the analysis of mitochondria distribution index of rat primary hippocampal neurons transfected with htau40 or vector plasmids;C.the Western blotting of OPA1,DLP1,MFN2,MFN1,KHC,and PP2Ac of rat primary hippocampal neurons transfected with htau40 or vector plasmids;D.quantitative analysis of immunoblotting in C-graphs
图1大鼠原代海马神经元表达人tau与表达空载体组的线粒体分布和分裂融合蛋白水平的比较
Fig1Comparison of mitochondria distribution and the relative level of mitochdria fission/fusion proteins of rat E18 primary hippocampal neurons(DIV9)transfected with human tau40-EGFP or vector plasmids
下调PP2Ac引起293wt细胞线粒体膜电位和细胞活力降低JC-1染色结果显示,下调 PP2Ac后HEK293细胞线粒体相对平均膜电位2.22为±1.09,明显低于对照组的3.19±1.36(t=2.300,P=0.0270);氧化磷酸化解偶联剂CCCP(10 μm)处理后ssiPP2Ac组(1.94±0.52)(t=3.544,P=0.0012)和siPP2Ac组(1.56±0.41)(t=2.353,P=0.025)细胞线粒体膜电位也均显著下降。CCK8细胞活力测定结果显示,PP2Ac表达下调后,siPP2Ac组的细胞活力为(85±5.8)%,明显低于ssiPP2Ac组的(99.7±3.59)%(t=6.249,P<0.0001)。
上调PP2Ac减轻293htau细胞线粒体形态分布和膜电位异常293htau细胞分别共转染EGFP-vector质粒或EGFP-PP2Ac质粒和mito-dsRed质粒36 h后,共聚焦摄像分析线粒体形态分布结果显示,PP2Ac表达引起293htau细胞的线粒体平均长度明显变短(t=7.300,P<0.0001),细胞内正常短管状线粒体比例显著升高(t=8.303,P<0.0001),且线粒体均匀分布于胞体和突起的细胞比例显著增多(t=9.269,P<0.001)。线粒体相对膜电位分析结果显示,PP2Ac表达的293htau细胞与对照质粒表达细胞的基础相对膜电位显著升高(t=2.271,P=0.0395),但 CCCP 处理后两者相对膜电位差异无统计学意义(P>0.05)(图5)。
与ssiPP2Ac比较,at=7.313,P<0.001;bt=12.490,P<0.0001;ct=19.210,P<0.0001;dt=2.276,P=0.0154;et= 9.601,P<0.0001;ft=13.000,P<0.0001
at=7.313,P<0.001;bt=12.490,P<0.0001;ct=19.210,P<0.0001;dt=2.276,P=0.0154;et= 9.601,P<0.0001;ft= 13.000,P<0.0001 compared with ssiPP2Ac
A.大鼠原代海马神经元表达siPP2Ac与ssiPP2Ac对照质粒的线粒体分布图;B.293wt细胞表达siPP2Ac与ssiPP2Ac对照质粒的线粒体分布图;C.293wt细胞表达siPP2Ac与ssiPP2Ac对照质粒的线粒体平均长度分析;D.293wt细胞表达siPP2Ac与ssiPP2Ac对照质粒的线粒体形状比例分析;E.293wt细胞表达siPP2Ac与ssiPP2Ac对照质粒的线粒体分布正常和异常的细胞比率比较
A.the mitochondria distribution of rat primary hippocampal neuron transfected with siPP2Ac or ssiPP2Ac plasmids;B.the mitochondria distribution of 293wt cells transfected with siPP2Ac or ssiPP2Ac plasmids;C.the analysis of mitochondria length of 293wt cells transfected with siPP2Ac or ssiPP2Ac plasmids;D.the population analysis of mitochondria shape of 293wt cells transfected with siPP2Ac or ssiPP2Ac plasmids;E.the population analysis of mitochondria normal or abnormal distribution of 293wt cells transfected with siPP2Ac or ssiPP2Ac plasmids
图2大鼠原代神经元和HEK293细胞表达siPP2Ac质粒组与ssiPP2Ac对照质粒组线粒体形态和分布的比较
Fig2Comparison of mitochondria shape and distribution of rat primary hippocampal neuron transfected with siPP2Ac or ssiPP2Ac plasmids

图3293wt细胞转染siPP2Ac质粒组与ssiPP2Ac质粒转染对照组的线粒体分裂融合动态(A)及绿色与红色共定位时间的比较(B)
Fig3Comparison of the mitochondria fission/fusion dynamics(A)and time for red colocalizing with green between siPP2Ac and ssiPP2Ac group(B)
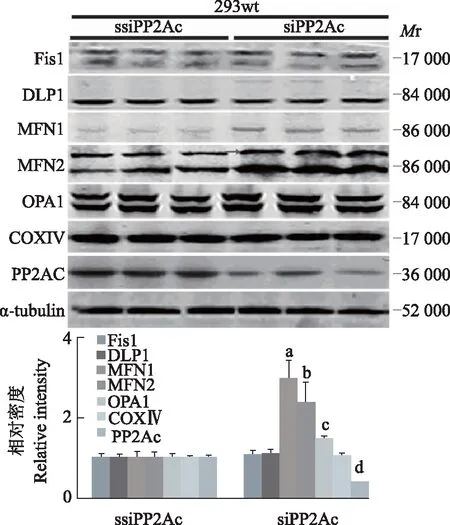
与ssiPP2Ac比较,at=6.768,P=0.0025;bt=3.121,P=0.0035;ct=3.775,P=0.0199;dt=5.788,P=0.0044
at=6.768,P=0.0025;bt=3.121,P=0.0035;ct=3.775,P=0.0199;dt=5.788,P=0.0044 compared with ssiPP2Ac
图4293wt细胞表达siPP2Ac和ssiPP2Ac质粒后的分裂融合蛋白表达及相对水平分析
Fig4The expressions of fission/fusion protein in 293wt cells transfected with siPP2Ac and ssiPP2Ac plasmids and their relative level analysis

与ssiPP2Ac比较,at=2.300,P=0.0270;bt=3.544,P=0.0012;ct=2.353,P=0.0250;dt=6.249,P<0.0001
at=2.300,P=0.0270;bt=3.544,P=0.0012;ct=2.353,P=0.0250;dt=6.249,P<0.0001 compared with ssiPP2Ac
A.293wt细胞表达siPP2Ac质粒和ssiPP2Ac质粒后的线粒体相对膜电位比较;B.293wt细胞表达siPP2Ac质粒和ssiPP2Ac质粒后的细胞活力比较
A.comparison of relative mitochondria membrane potential of 293wt cells transfected with siPP2Ac and ssiPP2Ac plasmids;B.comparison of cell viability of 293wt cells transfected with siPP2Ac and ssiPP2Acplasmids
图5293wt细胞表达siPP2Ac质粒和ssiPP2Ac质粒后的线粒体相对膜电位及细胞活力比较
Fig5The comparison of relative mitochondria membrane potential and cell viability of 293wt cells transfected with siPP2Ac and ssiPP2Ac plasmid

与对照组比较,at=7.300,P<0.0001;bt=8.303,P<0.0001;ct=8.659,P<0.0001;dt=2.938,P=0.014;et=9.269,P<0.001;ft=6.732,P<0.001;gt=2.271,P=0.0395
at=7.300,P<0.0001;bt=8.303,P<0.0001;ct=8.659,P<0.0001;dt=2.938,P=0.014;et=9.269,P<0.001;ft=6.732,P<0.001;gt=2.271,P=0.0395 compared with vector
A.293htau细胞转染PP2Ac或vector质粒后的线粒体形态和分布;B.293htau细胞转染PP2Ac或vector质粒后的线粒体长度分析;C.293htau细胞转染PP2Ac或vector质粒后的线粒体形态分析;D.293htau细胞转染PP2Ac或vector质粒后的线粒体正常分布和异常分布比率分析;E.293htau细胞转染PP2Ac或vector质粒后的线粒体相对膜电位分析
A.the shape and distribution of mitochondria of 293htau cells after transfection with PP2Ac or vector;B.the analysis of mitochondria length of 293htau cells after transfection with PP2Ac or vector;C.the analysis of mitochondria shape of 293htau cells after transfection with PP2Ac or vector;D.the analysis of mitochondria distribution of 293htau cells after transfection with PP2Ac;E.the analysis of mitochondria membrane potential of 293htau cells after transfection with PP2Ac or vector
图6表达PP2Ac的293htau细胞组与表达空载体组的线粒体形态分布和膜电位的比较
Fig6Comparison of mitochondria length and distribution and membrane potential of 293htau cells transfected with PP2Ac-EGFP or vector-EGFP plasmids
讨 论
研究显示,AD患者的PP2A活性显著降低[1]。作者曾报道tau蛋白在HEK293细胞和大鼠原代神经元积聚时,早期线粒体异常分布于细胞核周胞体区,轴突线粒体分布密度降低[8]。tau蛋白积聚必然伴随PP2A水平和活性改变,但尚未见tau蛋白积聚时PP2A活性变化参与tau 蛋白引起的线粒体分裂融合动态失衡的报道。因此,本研究首先在原代海马神经元表达人tau时发现,线粒体分布异常时PP2Ac水平显著下降,PP2Ab水平并无改变(数据未显示),提示PP2Ac下降很可能是tau蛋白积聚引起线粒体分布异常和功能障碍的重要途径。进一步下调PP2Ac表达时发现,大鼠原代海马神经元和293wt细胞出现与人tau聚集类似的线粒体异常分布于细胞核周围,且293wt细胞线粒体融合明显加速,融合蛋白MFN1、MFN2和OPA1水平显著升高,细胞线粒体相对膜电位和细胞活力显著降低。相反,上调PP2Ac表达则减轻293htau细胞线粒体形态和分布及功能异常。因此,本研究结果提示PP2Ac下调可在AD发病早期tau蛋白积聚时升高融合蛋白MFN1和MFN2,破坏线粒体分裂融合平衡,加重线粒体损伤导致神经元退变,而上调PP2Ac表达可改善人tau积聚引起的线粒体形态和分布及功能异常。
有研究显示,PP2A全酶分布于线粒体可使DLP1的Ser656位点发生去磷酸化,激活DLP1,从而促进线粒体分裂[6]。但本研究中DLP1条带无显著偏移,推测PP2Ac表达下降可能不通过阻断DLP1去磷酸化激活使线粒体融合加速。MFN1和MFN2可促进线粒体转运和外膜的融合,OPA1可促进内膜和嵴的融合[11-12]。本研究结果显示,PP2Ac下调使293wt细胞线粒体融合蛋白MFN1和MFN2显著增加,且线粒体分裂融合动态显示线粒体融合加速和线粒体相对膜电位相对下降及细胞活力降低。其可能原因是轻度损伤线粒体在升高的MFN1和MFN2作用下,逆向转运和正常线粒体外膜融合形成变长的损伤线粒体,这些损伤的线粒体因线粒体内膜和嵴未融合不能实现线粒体的膜电位功能修复(OPA1仅轻度升高致),也不能分裂成膜电位严重下降的损伤线粒体经自噬清除和膜电位正常线粒体(DLP1和 Fis1的相对不足引起),故损伤线粒体积聚在细胞内,导致细胞内线粒体相对膜电位降低和细胞活性下降。本研究中,293htau细胞上调 PP2Ac可改善线粒体异常分布并升高线粒体膜电位,进一步证明PP2Ac下调是htau表达早期损伤线粒体融合过度和异常核周聚集的重要机制。
PP2Ac表达下降引起293wt细胞内未修饰MFN2水平升高,提示PP2Ac下调激活了MFN2的表达。与此一致的是,有报导在脑内皮细胞抑制PP2A表达引起MFN1、MFN2及OPA1升高时,伴有活化的转录因子XBP1及磷酸化Eif2α水平升高[13]。因此,本研究中PP2Ac下降也可通过此途径引起MFN1和MFN2表达升高。研究报道,人tau 蛋白过表达可激活JAK2诱导STAT1的Tyr701磷酸化,使其二聚化激活入核,从而抑制NMDA受体表达导致神经元突触功能障碍和记忆障碍[14]。另据研究发现,下调PP2Ac可升高STAT1的磷酸化和核内分布激活凋亡基因表达[15]。作者曾发现,人tau过度表达导致轻度损伤线粒体表面的PINK1减少和Parkin减少,使线粒体自噬障碍[16]。因此,人tau表达可能激活STAT1激活MFN1的表达或抑制PINK1和Parkin的表达,抑制MFN1和MNF2降解。人tau蛋白表达时,PP2Ac下降的原因可能是:PP2Ac与PP2Aa和PP2Ab形成全酶参与tau蛋白去磷酸化增多,参与STAT1去磷酸化的PP2Ac减少,或结合Jak1/Tyk2/STAT1的PP2Ac减少,致STAT1磷酸化激活也可能抑制PP2Ac表达。
本研究中下调PP2Ac后修饰的MFN2轻度后移,其原因可能是PP2Ac下调引起MFN2的 Ser442位点磷酸化升高所致,因PP2Ac参与MFN2的被PKA磷酸化的Ser442位点的去磷酸化。本研究中人 tau 蛋白积聚时原代神经元线粒体轴突分布减少伴PP2Ac下调和MFN1及 MFN2轻度下降,可能是内源性鼠tau对人tau诱发的MFN1和MFN2的降解障碍产生代偿性激活清除过度。
Li等[17]研究发现,PP2A抑制在野生型小鼠成神经瘤细胞引起氧化应激和细胞活力降低。本研究中下调PP2Ac时,293wt细胞内线粒体变长并聚集于核周胞体区,线粒体形态不同于其他报道PP2A抑制剂 OA导致神经元碎裂[6]。推测原因可能是终末分化细胞与周期细胞的差异,因为有报道一氧化氮在氧分压正常时可激活PKA促进线粒体融合,增加心肌细胞对缺血再灌注损伤的耐受性[18]。Zhang等[19]研究显示,下调PP2A抑制因子Ⅱ升高PP2A活性,激活 PKA磷酸化GSK3β的Ser9抑制GSK3β活性,可改善人 tau小鼠的记忆障碍,增加树突复杂度。与此一致的是,增加线粒体外膜的PKA/AKAP可使神经元树突的线粒体密度增加和变长,促进树突发生[20]。因此,PP2Ac下调也可能通过抑制PKA或使线粒体PKA/AKAP分布减少,导致线粒体分裂减少和突起分布减少。
综上,本研究发现,PP2Ac下调是人tau积聚引起的线粒体分裂融合动态失衡和核周异常聚集及膜电位下降的关键因素,改善PP2Ac水平下降可显著改善线粒体分裂融合失衡。提示在AD脑内随着人tau蛋白积聚,PP2Ac水平下降早期导致线粒体分裂融合动态失衡使其形态功能障碍,可能是神经元轴突缩短退变的早期机制之一。

