慢性乙肝病毒感染引起的肝硬化患者血清microRNA表达变化研究△
邓巧娟 刘 娜 陈 恺
(1.广东医科大学附属医院感染内科 湛江 524001;2.广东医科大学附属医院老年病科 湛江 524001)
肝硬化是由一系列慢性肝脏疾病引起肝脏损伤并最终发展形成的。引起肝硬化的原因有很多,其中酗酒、慢性丙肝病毒感染和非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是西方国家肝硬化发生的主要原因,而在亚洲地区,慢性乙肝病毒感染是引起肝硬化的主要原因[1]。在近年的研究中,一些新的标记物被发现并且具有用于肝硬化诊断的前景,其中就包括血清microRNA[2]。但目前关于microRNA在肝硬化中的变化研究相对较少,本课题主要拟对由慢性乙肝病毒感染引起的肝硬化患者进行血清microRNA表达变化检测,并对肝硬化代偿期及失代偿期病人血清microRNA表达变化进行比较,分析不同microRNA在肝硬化发生发展过程中的诊断和预后价值,现报道如下。
1 资料与方法
1.1 一般资料
随机选取我院2017年1月~2018年10月间收治的62例肝硬化合并肺炎患者作为此次研究对象,其中男49例,女13例;年龄32~75岁,平均(53.51±2.64)岁;按照肝功能 Child-Pugh分级标准,A级16例,B级31例,C级15例;代偿分期:代偿期32例,失代偿期30例。另选取同期来我院体检健康者30例设为对照组,其中男18例,女12例;年龄25~59岁,平均(42.11±6.82)岁。收集两组患者的临床资料,所得数据对比均无统计学意义(P>0.05),存在可比性。
入选标准:(1)肝硬化患者诊断符合2000年西安全国病毒性肝炎及肝病学术会议修订标准[3],均通过B超,实验室检查临床诊断为慢性乙肝病毒引起肝硬化的患者;(2)神志清楚,自愿参与本研究。
排除标准:(1)肝癌,其他病毒性肝炎,遗传性肝病,血吸虫肝病等疾病;(2)存在肝硬化之外可能会对血清microRNA表达产生影响的疾病;(3)临床资料不全。
1.2 方法
(1)样品采集:在患者进行治疗前抽取患者静脉血,离心提取血清,冻-80℃备用,同时对对照组部分健康人作为对照。采用TRIzol试剂对血清总的RNA进行提取,并采用Nanodrop 2000测定RNA浓度和纯度,采用琼脂糖凝胶电泳分析RNA质量。
(2)二代测序技术检测microRNA表达变化:将Adaptor mix(New England biolabs)与小分子RNA(<50nt)进行杂交和连接,然后采用ILLumina HiSeq2000 platform进行小分子RNA反转录以及测序分析。测序结果与参考的microRNA库Bowtie v0.12.7进行比对,分析不同microRNA表达。
1.3 观察指标
对比两组血清microRNA表达水平。
1.4 统计学处理
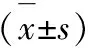
2 结果
肝硬化代偿组与失代偿组患者microRNA低于对照组,其中肝硬化代偿组低于失代偿组,microRNA表达高于失代偿组,差异有统计学意义(P<0.05),见表1。
表1 各组病毒载量、甲胎蛋白以及microRNA表达水平对比

组别microRNA(ng/L)肝硬化代偿期组(n=32)47.31±19.38肝硬化失代偿期组(n=30)6.42±1.84对照组(n=30)77.56±32.36F80.85P<0.05
3 讨论
本研究通过调查慢性乙肝病毒感染引起的肝硬化患者血清microRNA表达变化及临床意义发现:肝硬化代偿组与失代偿组患者病毒载量、甲胎蛋白以及microRNA均低于对照组,其中肝硬化代偿组病毒载量、甲胎蛋白低于失代偿组,microRNA表达高于失代偿组,差异有统计学意义(P<0.05);肝硬化代偿组与失代偿组患者microRNA高表达人数明显低于对照组,但其中肝硬化代偿组microRNA高表达人数高于失代偿组,差异有统计学意义(P<0.05)。考虑当在肝硬化发生发展的过程中,肝细胞的坏死或凋亡,炎症均会导致microRNA被释放到血液循环中,从而导致血清microRNA含量的改变,而失代偿期患者的microRNA含量更低,说明其与肝硬化程度以及坏死性炎症程度成负相关[4~5]。
综上所述,microRNA作为一类新的生物学指标,具有良好的稳定性、可重复性等优点,在肝硬化过程中具有重要作用。

