电针对糖尿病神经痛模型大鼠痛觉敏化及脊髓小胶质细胞BDNF 表达的影响
瞿思颖王涵芝胡群祺邰昭霞费雪瑜蒋永亮方剑乔*何晓芬*
(1. 浙江中医药大学第三临床医学院康复医学院,杭州 310053; 2. 浙江中医药大学针灸研究所,杭州 310053;3. 浙江省针灸神经病学研究重点实验室,杭州 310053; 4. 浙江中医药大学附属第三医院,杭州 310005)
糖尿病患病人数日益增多,糖尿病引起的并发症[1]已成为影响患者生存质量的主要因素[2]。 糖尿病神经痛(diabetic neuropathic pain,DNP)一种常见的糖尿病并发症,主要表现为轻度刺激引起的自发性痛觉过敏和轻微触觉等无害刺激引起的异常性疼痛[3],有研究表明小胶质细胞在糖尿病神经痛的产生与维持中发挥重要作用,已成为治疗DNP 的重要靶点[4],DNP 大鼠腰段脊髓背角小胶质细胞激活以及数量增加[5-6],鞘内注射小胶质细胞抑制剂米诺环素抑制DNP 大鼠痛觉过敏[7]。 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在疼痛、炎症和继发性损伤中发挥重要的作用,初步研究发现小胶质细胞释放脑源性神经营养因子参与DNP 的产生维持[8-9]。 针刺是目前控制神经病理疼痛的主要手段之一[10],有实验研究结果表明在大鼠足三里、昆仑穴进行低频电针干预能有效减轻DNP 大鼠热痛过敏反应[11]。 有报道电针可通过抑制脊髓小胶质细胞的活化,减轻坐骨神经压迫性损伤引起的神经痛敏化反应[12];也有报道电针可通过干预脑缺血大鼠皮质BDNF 的合成和分泌改善大脑缺血再灌注损伤[13],但电针能否通过减少DNP大鼠脊髓背角小胶质细胞和BDNF 的表达产生镇痛作用尚有待明确。
本实验旨在通过建立糖尿病神经痛大鼠模型,观察大鼠L4-L6 脊髓背角中CD11b(小胶质细胞活化标记物)和BDNF 表达的变化,探讨脊髓背角小胶质细胞和BDNF 是否参与电针镇痛。
1 材料与方法
1.1 材料
1.1.1 实验动物
30 只5 周龄清洁级健康雄性SD 大鼠,体重约150 g,购于中国科学院上海实验动物中心【SCXK(沪)2018-0006】,饲养于浙江中医药大学动物实验研究中心【SYXK (浙) 2018-0012】。 饲养期间各组大鼠自由饮水,正常组大鼠饲喂啮齿类动物标准颗粒饲料,模型组大鼠饲喂高脂高糖饲料,具体饲料配方参考寿[14]。 饲养环境:昼夜明暗各半循环照明,湿度恒定,温度维持在22 ~26℃。 所有动物实验操作均严格遵守实验动物伦理管理条例,并经过浙江中医大学实验动物伦理委员会许可(伦理审批号为:IACUC-20180319-13)。
1.1.2 实验试剂与仪器
链脲佐菌素,STZ(Sigma,美国,S0130);小鼠抗CD11b 抗体(BIO-red,美国,MCA275GA);兔抗BDNF 多克隆抗体(Alomone,以色列,ANT-010);驴抗兔Alexa Fluor488 IgG (H+L)二抗(Jackson,美国,批号711-545-152);驴抗小鼠Alexa Fluor647 IgG(H+L)二抗(Jackson,美国,批号715-605-150);驴血清(Solarbio,中国,SL034)。
韩氏穴位神经刺激仪(北京华卫产业开发公司,HANS 200E,中国);动态足底触觉仪(Ugo Basile公司,37450,意大利);足底热辐射测痛仪(Ugo Basile 公司,37360,意大利);冰冻切片机(Thermo Fisher Scientific 公司,CryoStar NX50,美国);激光共聚焦显微镜(Nikon 公司,A1R,日本);罗氏卓越型血糖仪(Roche Diagnostics GmbH 公司,德国)。
1.2 实验方法
1.2.1 实验分组及实验干预
大鼠随机分为正常组(N group):饲喂啮齿类动物标准颗粒饲料饲养,仅予以腹腔注射1 mL 的柠檬酸缓冲液;模型组(M group):予以高脂高糖饲料饲喂4 周后,禁食16 h,予以腹腔注射35 mg/kg 链脲佐菌素;电针组(EA group):予以高脂高糖饲料饲养。 喂4 周后,禁食16 h,予以腹腔注射35 mg/kg链脲佐菌素,并于链脲佐菌素注射2 周后(即6 周)予以电针治疗,隔天1 次,持续2 周,共治疗7 次。方法:首先对大鼠予以固定,选用双侧“足三里”“昆仑”穴,采用0.25 mm×13 mm 的毫针,进针后连接韩氏穴位神经刺激仪,设置电针参数如下:频率2 Hz,强度1 ~2 mA,共干预30 min。 每组10 只。
1.2.2 空腹血糖(fasting blood glucose,FBG)检测
分别在基础(base)、4 周(4 weeks)、6 周(6 weeks)、8 周(8 weeks)这4 个时间点,对大鼠均禁食不禁水8 h 后检测大鼠的空腹血糖(fasting blood glucose,FBG)。 剪尾尖用尾静脉采血,用血糖仪对各组大鼠的空腹血糖进行检测。
1.2.3 热痛阈(thermal paw withdrawal latency,PWL)检测
采用足底热辐射测痛仪检测各组大鼠的热痛阈(thermal paw withdrawal latency,PWL)。 将大鼠放在透明的有机玻璃格子内,适应约30 min,待其安静后,将足底热辐射测痛仪的测试仪上的,“十”字形标记置于大鼠的足底跖部无毛区,避开足垫,从热源开始照射大鼠,至大鼠出现抬足、舔脚反应时的时间为热痛阈。 以20 s 作为最高痛阈,以免足爪受损。 痛阈测定时每组循环测定5 次,每次间隔5 min,去除极大值和极小值后计算3 次平均值作为大鼠PWL。
1.2.4 机械痛阈(paw withdrawal thresholds,PWT)检测
机械痛阈(Paw withdrawal thresholds,PWT)检测方法:取单侧平均值作为大鼠机械痛觉异常的指标。 于正式测量前,将大鼠置于透明的塑料盒内适应环境约30 min,直至大鼠停止梳理毛发和探索性活动并安静后开始测量。 避开足垫,将类Von Frey丝的金属丝置于大鼠后足中央,启动与金属丝相连的机械泵,金属丝即以恒定速度自动上抬,刺激力量从0 g 开始以2.5 g/s递增,对大鼠足底施加持续的机械刺激,直至大鼠产生缩腿反应。 最大刺激力量设定为50 g,以免损伤大鼠足爪。 每次检测间隔5 min,总共测5 次,去极大值和极小值后计算3 次平均值作为最终检测值。
1.2.5 免疫荧光法检测大鼠脊髓背角CD11b 和BDNF 荧光强度的表达
8 周时检测好各组大鼠痛阈后,每组取3 只大鼠,用戊巴比妥(40 mg/kg,BW)予以麻醉,用4℃预冷的生理盐水经左心室、升主动脉快速灌注至大鼠肝脏变白,再先快后慢推注4%多聚甲醛。 快速冲出腰段脊髓,将脊髓放于4%多聚甲醛后固定6 h,然后置于15%和30%的蔗糖溶液梯度脱水,经液氮快速冷冻后,放于-80℃冰箱保存。
大鼠腰段脊髓节段行厚度为30 μm 的冰冻切片。 用TBST 漂洗脊髓切片10 min×3 次,10%驴血清37℃孵育1 h。 孵育完成后,将切片转移至含10%驴血清的TBST 稀释的兔抗BDNF 抗体(稀释比例1 ∶400)和小鼠抗CD11b 抗体(稀释比例1 ∶600)中4℃孵育过夜,次日将切片37℃复温1 h,TBST 漂洗10 min×6 次,然后将切片置于含10%驴血清的TBST 稀释的驴抗兔Alexa Fluor488 IgG (H+L) 二抗(稀释比例:1 ∶600) 和驴抗小鼠Alexa Fluor647 IgG (H+L)二抗(稀释比例:1 ∶800)中予以37℃孵育1 h,TBST 漂洗10 min × 6 次。 将切片转移至黏附载玻片,风干,滴加抗荧光淬灭液后,缓慢盖上载玻片完成封片。 在激光共聚焦显微镜下观察脊髓切片并拍片。 每组大鼠3 只大鼠,每只大鼠选取3 ~5 张脊髓切片,激光共聚焦显微镜扫描所得图像用计算机辅助图像分析软件系统(Image J 软件)对图片进行分析,计算免疫阳性反应的平均光密度值,把正常组的相对表达量作为1 的倍数,其他相对正常组的比值(增加倍数)则作为该组平均光密度值的结果[15]。
1.3 统计学分析
所有数据均用SPSS 22.0 处理,结果用平均值±标准误(±s)表示,多组间比较使用单因素方差分析。 以P<0.05 表示差异具有显著性。
2 结果
2.1 大鼠空腹血糖(FBG)变化
各组大鼠不同时间点FBG 结果如图1 所示,各组大鼠基础(base)血糖及4 周(4 weeks)时的血糖差异无显著性;在6 周(6 weeks)和8 周(8 weeks)时,模型组(M group)及电针组(EA group)大鼠FBG明显上升(P<0.01;P<0.01)。
2.2 大鼠热痛阈(PWL)变化
各组大鼠不同时间点热痛阈(PWL)结果如图2所示。 各组大鼠基础(base)PWL 及4 周(4 weeks)时的PWL 差异无显著性;6 周(6 weeks)时,模型组(M group)及电针组(EA group)大鼠PWL 明显下降(P<0.01;P<0.01);8 周(8 weeks)时,电针组(EA group)大鼠PWL 明显上升(P<0.01)。
2.3 大鼠机械痛阈(PWT)变化
各组大鼠不同时间点机械痛阈(PWT)结果如图3 所示。 各组大鼠基础(base)PWT 及4 周(4 weeks)时的PWL 差异无显著性;6 周(6 weeks)时,模型组(M group)及电针组(EA group)大鼠PWT 明显下降(P<0.01;P<0.01);8 周(8 weeks)时,电针组(EA group)大鼠PWT 明显上升(P<0.01)。
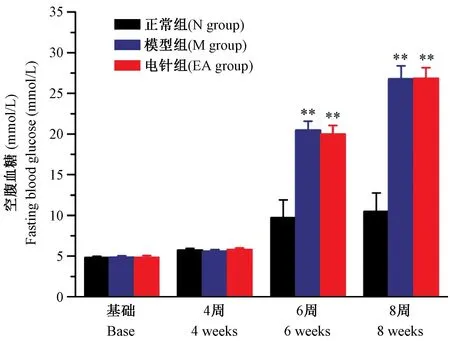
图1 大鼠血糖变化Note. Compared with the N group,**P<0.01.Figure 1 Changes of fasting blood glucose in rats

图2 各组大鼠热痛阈变化情况Note. Compared with the N group,**P<0.01. Compared with the M group,##P<0.01.(The same in the following Figures)Figure 2 Changes of paw withdrawal latency in rats

图3 各组大鼠机械痛阈变化情况Figure 3 Changes of paw withdrawal threshold in rats
2.4 大鼠脊髓背角小胶质细胞CD11b 的表达
采用免疫荧光法观察各组大鼠脊髓背角小胶质细胞CD11b 的表达。 各组大鼠脊髓背角I-II 层上CD11b 荧光染色代表图(图4A)和各组大鼠在脊髓背角I-II 层上CD11b 平均光密度值统计结果(图4B)。 与N group 比较,M group 大鼠脊髓背角I-II层上CD11 平均光密度显著升高(P<0.01);与M group 比较,EA group 大鼠脊髓背角I-II 层上CD11平均光密度显著降低(P<0.01)。
2.5 大鼠脊髓背角BDNF 的表达
采用免疫荧光法检测大鼠脊髓背角BDNF 的表达。 与N 组比较,M 组大鼠脊髓背角I -II 层上BDNF 荧光强度显著升高(P<0.01);与M 组比较,EA 组大鼠脊髓背角I -II 层上BDNF 荧光强度显著降低(P<0.01)。 各组大鼠脊髓背角I -II 层上BDNF 阳性细胞代表图(图5A)和各组大鼠在脊髓背角I -II 层上BDNF 荧光强度(图5B)。
2.6 BDNF 在脊髓背角小胶质细胞表达
免疫荧光双标实验结果如图6 所示。 BDNF 阳性细胞表达显示为绿色,小胶质细胞(CD11b)阳性细胞表达显示为红色,BDNF 和CD11b 免疫荧光双标的阳性细胞呈黄绿色,表明糖尿病神经痛诱导大鼠脊髓背角小胶质细胞产生BDNF。

图4 大鼠脊髓背角CD11b 相对表达量(免疫荧光染色,标尺=200 μm)Figure 4 Relative expression of CD11b in spinal cord of rats(Immunofluorescence staining,Bar=200 μm)

图5 大鼠脊髓背角BDNF 相对表达量(免疫荧光染色,标尺=200 μm)Figure 5 Relative expression of BDNF in spinal cord of rats(Immunofluorescence staining,Bar=200 μm)

图6 BDNF 和小胶质细胞共表达(免疫荧光染色,标尺=20 μm)Figure 6 Co-expression of BDNF and microglia in spinal cord(Immunofluorescence staining,Bar=20 μm)
3 讨论
糖尿病神经痛的定义为糖尿病患者外周体感觉系统异常直接引起的疼痛[16]。 糖尿病神经疼痛的发病机制尚未有公认,目前针对性的药物疗法旨在通过给予抗抑郁药和抗惊厥药等来缓解症状,但药物的使用受到副作用和耐受性的限制。 临床研究表明,电针是治疗糖尿病神经病理痛的有效非药物疗法之一,且2 Hz 的低频电针比100 Hz 更能有效抑制糖尿病神经痛敏化反应[11]。
小胶质细胞在正常条件下处于静止状态,周围炎症、高血糖症和由此产生的活性氧物质可影响脊髓中的局部微环境[4]使小胶质细胞被迅速激活。利用链脲佐菌素引起的糖尿病神经痛模型中小胶质细胞的活化表现为细胞体肥大、细胞数量增加和小胶质细胞标记物染色水平增加[17],如本文中使用的分化簇11b(CD11b)就是小胶质细胞特异性标记物之一[18]。 本实验研究结果显示M 组大鼠L4-L6脊髓背角CD11b 平均光密度值较正常组显著升高,电针干预后CD11b 平均光密度明显下降。 这表明脊髓小胶质细胞参与糖尿病神经痛产生与维持,脊髓小胶质细胞可能参与电针镇痛。
脑源性神经营养因子 ( brain derived neurotrophic factor,BDNF)可促进神经系统中神经元的增殖营养存活,并可介导突触形成和轴突可塑性[19]。 近年来一系列的研究发现脑源性神经营养因子与神经病理痛密切相关,在神经病理痛的发生发展中发挥着极其关键的作用[20]。 坐骨神经痛大鼠[21]与糖尿病神经痛大鼠[22]中小胶质细胞源性BDNF 表达比正常组高,向糖尿病神经痛大鼠鞘内注射BDNF 可减轻机械痛与热痛觉过敏[23]。 本实验研究发现模型组大鼠脊髓背角BDNF 平均光密度较正常组显著升高,电针干预后BDNF 平均光密度显著下降。 有研究报道脑源性神经营养因子被ATP 刺激后从小胶质细胞中释放出来,是小胶质细胞和神经元之间的关键信号分子,可以阻断脊髓中异常的伤害性过程[24]。 同时BDNF 的释放反过来可以诱导激活小胶质细胞并促进小胶质细胞迁移,BDNF 还可调节小胶质细胞的增殖存活和细胞动力学[25]。 有研究发现BDNF 通过激活脊髓小胶质细胞可促进脊髓神经元的增强和机械超敏反应,从而在神经元再生过程中影响周围的环境[26-27]。 本实验免疫荧光双标实验结果显示BDNF 与小胶质细胞(CD11)存在共表达。
本实验结果表明,低频电针对糖尿病神经痛大鼠血糖无明显作用,可提高糖尿病神经痛大鼠的热痛阈和机械痛阈,免疫荧光结果显示M 组大鼠脊髓背角小胶质细胞表面标记物CD11b 以及BDNF 表达明显增多;电针可明显抑制M 组大鼠脊髓背角小胶质细胞和BDNF 的表达。 综上所述,脊髓背角小胶质细胞BDNF 参与糖尿病神经痛的产生与维持;低频电针可显著改善糖尿病神经痛,其可能的机制是抑制脊髓背角小胶质细胞BDNF 的表达。 本研究结果部分阐明了低频电针治疗糖尿病神经痛的作用机制。
——滋阴养胃 少酸宜甜

