伊马替尼在斑马鱼血管和神经发育过程中的作用研究
鲍奕清,陈思,洪瑞晟,朱仪,高敏,李乐乐,张旭,王新,刘东,石运伟
(南通大学神经再生重点实验室,生命科学学院,医学院,江苏 南通 226001)
伊马替尼属于2-苯基氨基嘧啶类化合物,化学名为4-[(4-甲基-1-哌嗪基)甲基]-N-[4-甲基-3-[4-(3-吡啶基)-2-嘧啶基]氨基]苯基]苯甲酰胺,是一种高特异性酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)[1]。 伊马替尼是目前临床首选的儿童慢性粒细胞白血病(chronic myeloid leukemia,CML)治疗药物[2];接受伊马替尼治疗的CML 患者10 年生存率可以达到80%以上[3]。 此外,伊马替尼也被用于胃肠间质瘤治疗;其有效治疗CML 的药理机制已被明确证实为靶向抑制BCR-ABL 表达[1]。
伊马替尼甲磺酸盐于2002 年以商品名“格列卫”在我国上市以来,临床应用持续增加,也伴随着不良反应逐渐显现,包括血液学和非血液学不良反应。 血液学不良反应主要为血红蛋白、白细胞、血小板等减少,其主要发生于疾病治疗过程中,一般在用药后6 ~15 d 出现,严重程度与用药剂量和病期相关,血液学不良反应与其他不良反应往往在同一病例中均有表现。 非血液学不良反应临床表现主要为:水肿和水钠潴留,肌痛和肌痉挛,恶心、呕吐等消化系统异常,肝肾功能异常以及胸闷、窦性心动过速等心脏毒性和心脏功能异常,皮肤及附件系统许多临床症状表现较为严重,包括多行红斑疹、红色斑丘疹、剥脱性皮炎等[4]。 伊马替尼在临床使用中的不良反应,促进该类药物的研发,其二代药物目前仍处于临床实验阶段[5]。 因此,探讨其产生不良反应的原因将有助于提高研发阶段药物的成药几率。
伊马替尼临床不良反应遍及人体多个器官,我们在探讨伊马替尼不良反应的研究中重点关注在人体各个器官分布的血管和神经系统。 本研究以胚胎期斑马鱼为动物模型,在整体动物水平上考察伊马替尼对斑马鱼血管和神经发育的毒副作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验中使用的野生型AB 系和转基因斑马鱼系Tg(kdr1:EGFP)、Tg(kdr1:mCherry)、Tg(fli1a:nEGFP)、Tg(hb9:EGFP)、Tg(huc:mCherry)由南通大学实验动物中心提供。 转基因斑马鱼系均由野生型AB 鱼系构建。 斑马鱼养殖系统为ESEN 水处理系统(北京),在养殖系统中定时定量喂养。 斑马鱼房间上午08:00 开启照明,按照14 h/10 h 交替开关照明,房间温度为(28 ± 2)℃,相对湿度为(60 ±5)%。 所有斑马鱼实验操作均在南通大学实验动物中心完成。 动物实验符合江苏省实验动物管理委员会伦理规范,所有动物实验遵循3R 原则,动物实验伦理审批号为20180510-001。
1.1.2 仪器和设备
Tricaine 购自Sigma-Aldrich 公司(美国)。 低熔点的琼脂糖购自Life Technologies Corporation(美国)。 原位杂交(ISH)及Q-PCR 实验材料购自购于Roche 公司(瑞士)。 用NaCl,KCl,CaCl2 和MgSO4制备E3 胚胎培养液。 氯化钠和其他化学品购自国药集团化学试剂有限公司(中国)。 体视显微镜为奥林巴斯MVX10(日本)。 激光共聚焦显微镜型号为Leica TCS-SP5 LSM,购自Leica 公司(德国)。
1.2 方法
1.2.1 动物实验
斑马鱼胚胎繁育方法依照ZFIN:The Zebrafish Book (http:/ /zfin.org/zf_info/zfbook/zfbk.html)。 收集6 月龄斑马鱼成鱼所产胚胎,将胚胎置于28.5℃的E3 溶液中进行培养。 在受精后6 h(hpf),解剖显微镜下筛选状态良好的胚胎用于实验。 将10 个左右的胚胎置于96 孔板中,用E3 溶液培养,依照图1A所示实验流程进行后续处理。
1.2.2 激光共聚焦显微镜成像
发育至48 hpf 的斑马鱼胚胎,用tricaine 麻醉后用0.8%的低熔点琼脂糖凝胶(UltraPureTMLow Melting Point Agarose,Invitrogen)包埋。 使用Leica TCS-SP5 LSM 激光共聚焦显微镜成像。
1.2.3 基因表达分析
取野生型斑马鱼胚胎进行药物处理至48 hpf,收集胚胎进行固定后保存于-20℃甲醇中。 ISH 实验过程在本实验室发表的工作中已有报道[6-7]。 用来制作vegfr2(ENSDART00000170626.2)探针所用的PCR 引物序列为,正向引物:5′-TCGGTTTTAG GAAGGACGGA-3′;反 向 引 物:5′-CGACTCAATGC GTACCGATG-3′。 用 来 制 作pdgfrα(ENSDART000 00103510.5)探针所用的PCR 引物序列为,正向引物:5′-CATGCTGACACCACATTCCG-3′;反向引物:5′-TGGATGCTGAAGTTCTGGTCT-3′。 利 用 q-PCR技术进一步分析基因vegfr2 和pdgfrα表达。 q-PCR实验过程在本实验室发表的工作中已有报道[8]。vegfr2 分析所用引物为,正向引物:5′-CCTCAGTC AAAGCCTTCTTCA-3′,反向引物:5′-TGCAAATGAG TGTGAGTGTCC-3′。pdgfra分析所用引物为,正向引 物:5′-CGTGACCATGGGATTCCTGA-3′,反 向 引物:5′-CGACCCAAGTTACTCTCCTCACTCA-3′。
1.3 统计学分析
用GraphPad Prism 5 软件对实验数据进行统计学分析,统计结果表示为平均值±标准差(±s)。 使用Dunnett' s 检验的单因素方差分析(One-way ANOVA)用于多组比较,P<0.05 表示差异具有统计学意义。
2 结果
2.1 伊马替尼对斑马鱼胚胎发育安全性评估
按图1A 所示,将发育至8 hpf 的野生型斑马鱼胚胎置于96 孔板中,分别用含有不同浓度伊马替尼的胚胎培养液处理斑马鱼胚胎,胚胎发育至48 hpf后在显微镜下观察统计。 结果显示,100 μg/mL 及以下浓度的伊马替尼溶液处理40 h 后,斑马鱼胚胎整体上未见明显的致死、畸形、发育延迟等毒性(图1B)。 对三次重复实验进行计数,除100 μg/mL 的伊马替尼溶液处理组有偶然死亡,其他剂量组斑马鱼胚胎整体发育正常(图1C)。
2.2 伊马替尼抑制斑马鱼胚胎ISV 发育
在上述安全浓度范围内,按图1A 所示实验流程,伊马替尼溶液处理发育至8 hpf 的Tg(fli1a:nEGFP)×Tg(kdrl:mCherry)转基因斑马鱼胚胎。 结果显示,在100 ~0.01 μg/mL 浓度范围内,伊马替尼处理40 h 后斑马鱼胚胎ISV 发育异常。 主要表现为ISV 内皮细胞数量明显减少:对照组斑马鱼胚胎发育至48 hpf 时,每条ISV 内皮细胞数量为5 个左右,而伊马替尼处溶液理组斑马鱼胚胎ISV 内皮细胞数量在4 个以内(图2A、B)。 ISV 内皮细胞数量减少,导致ISV 的部分缺失。 ISV 内皮细胞数量减少同时导致管腔直径显著变窄,ISV 腔化异常(图2A、C)。
2.3 伊马替尼抑制斑马鱼胚胎ISV 发育但不影响Cap 运动神经元发育
在100 ~0.01 μg/mL 浓度范围内,按图1A 所示实验流程,用伊马替尼溶液对Tg(hb9:EGFP) ×Tg(kdrl:mCherry)转基因斑马鱼胚胎进行处理。 结果显示,伊马替尼处理40 h 后,显著抑制斑马鱼ISV的发育(图3A),造成ISV 的部分缺失,能够重复前述实验结果。 同时发现,伊马替尼溶液处理斑马鱼胚胎后,Cap 运动神经元的轴突长度和分枝数量无明显变化(图3B、C)。
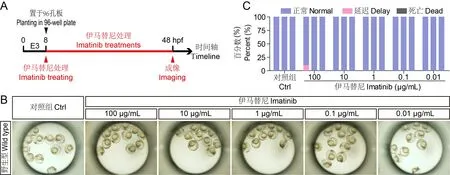
图1 伊马替尼对斑马鱼胚胎发育安全性评估Note. A,Experimental procedures; B,Effect of imatinib on the overall development of zebrafish embryos in the concentration range of 100 μg/mL to 0.01 μg/mL; C,Statistics of zebrafish embryo development treated with imatinib solution showed no significant developmental phenotypes such as lethality,malformation,and delayed development (the number of embryos in each group was 10 or 11).Figure 1 Safety evaluation of imatinib on zebrafish embryo development

图2 伊马替尼显著抑制斑马鱼胚胎ISV 腔化和血管内皮细胞的增殖(n=8)Note. A,ISV endothelial cells nuclear and ISV morphology of in 48 hpf zebrafish embryos.In vivo imaging offli1a:nEGFP labeled vascular endothelial cell nuclei and kdrl:mCherry labeled vascular endothelial cell zebrafish embryonic ISV endothelial cell nuclei and endothelial cells was performed by confocal laser scanning microscopy. B,The number of endothelial cells in the ISV of 48 hpf zebrafish embryos was counted and statistically analyzed,and treatment with the imatinib solution significantly reduced the number of endothelial cells in the ISV compared with the control group. C,measurement statistics of ISV diameter in zebrafish embryos at 48 hpf showed that treatment with the imatinib solution significantly reduced ISV diameter compared with the control group.(*P<0.05,**P<0.01,***P<0.001)Figure 2 Imatinib significantly inhibited ISV cavitation and proliferation of vascular endothelial cells in zebrafish embryos(n=8)
2.4 伊马替尼抑制斑马鱼胚胎ISV 发育但不影响huc 标记神经元的发育
在100 ~0.01 μg/mL 浓度范围内,用伊马替尼溶液处理Tg(huc:mCherry)×Tg(kdrl:EGFP)斑马鱼胚胎。 结果显示,处理40 h 后,伊马替尼显著抑制斑马鱼ISV 发育(图4A),造成ISV 的部分缺失,能够再次与前述实验结果吻合。 同时,伊马替尼溶液处理斑马鱼胚胎后,huc 标记神经元的数目无显著改变(图4B)。
2.5 伊马替尼调控vegfr2 及pdgfrα 信号途径抑制斑马鱼胚胎ISV 发育
按照图5A 所示实验流程,收集胚胎进行ISH分析,并对胚胎躯干部位进行拍照。 结果显示,100、1 μg/mL 浓度的伊马替尼溶液处理野生型斑马鱼胚胎后,vegfr2 和pdgfrαmRNA 表达水平均明显降低(图5B)。 通过q-PCR 实验进一步验证伊马替尼溶液处理后vegfr2 和pdgfrα的表达水平,结果显示,100、1 μg/mL 浓度的伊马替尼溶液处理野生型斑马鱼胚胎后,vegfr2 和pdgfrα的表达水平显著降低(图5C、D)。
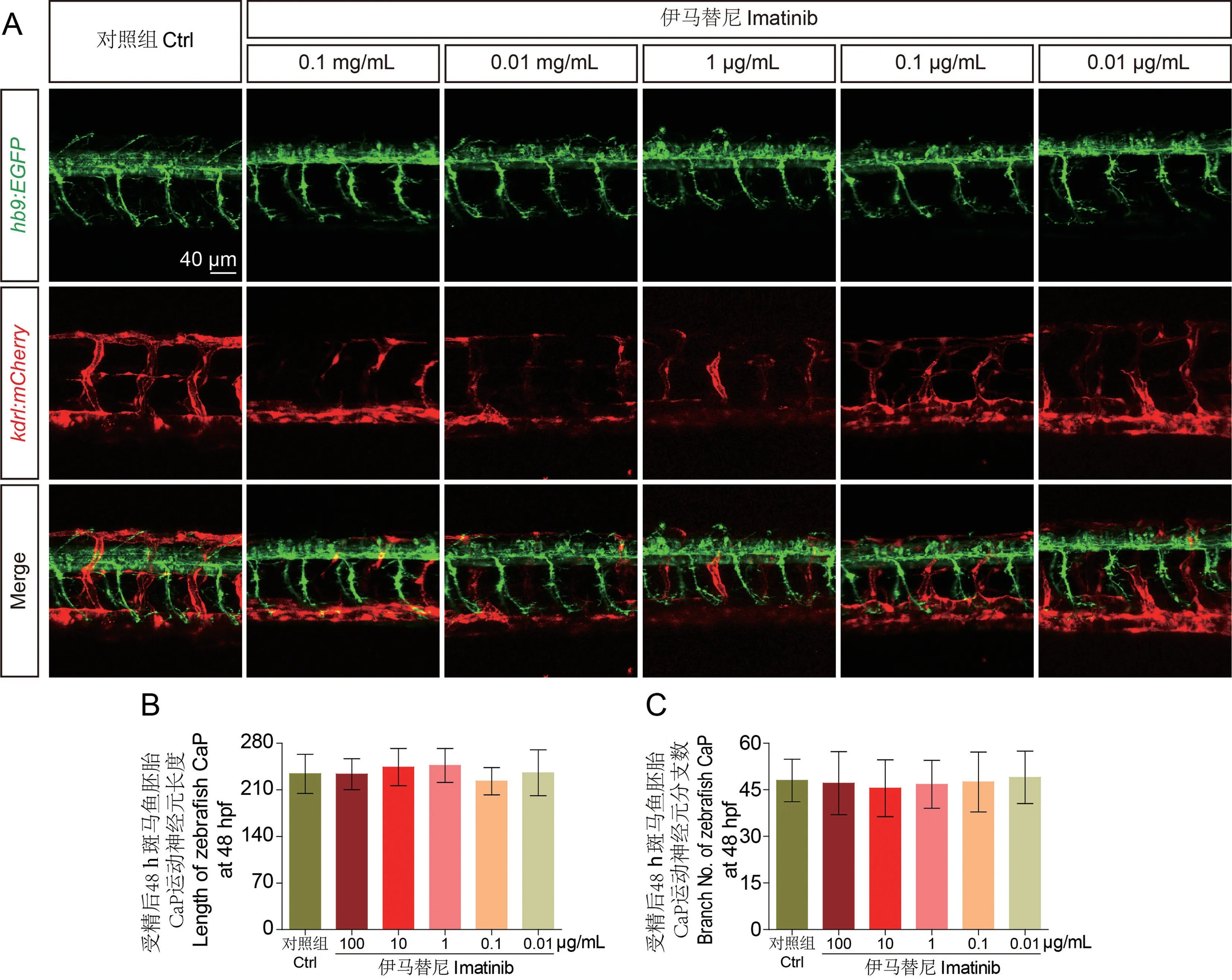
图3 伊马替尼特异性抑制斑马鱼胚胎ISV 发育而对运动神经元形态无显著影响(n=8)Note. A,In vivo imaging of Cap motoneurons and ISVs from 48 hpf zebrafish embryos was performed by confocal microscopy to analyze Cap motoneurons and ISV morphology. There was a significant loss of ISV,but no significant change in Cap motoneuron morphology after treatment with imatinib solution. B,The length of Cap motoneuron axons in 48 hpf zebrafish embryos was statistically analyzed,and there was no significant change in Cap motoneuron axon length after treatment with imatinib solution. C,The number of Cap motoneuron processes in 48 hpf zebrafish embryos was counted,and there was no significant change in the number of Cap motoneuron processes after treatment with imatinib solution.Figure 3 Imatinib specifically inhibited ISV development in zebrafish embryos but had no significant effect on motor neuron morphology(n=8)
3 讨论
斑马鱼(danio rerio)是药物筛选及毒理研究的良好模式生物,利用其进化保守、幼鱼通体透明、生长周期短、产卵量大、体外受精等特点,可以方便实现活体成像、高通量筛选、遗传操作等研究目的。本研究利用标记血管内皮细胞和神经元的转基因斑马鱼系,通过激光共聚焦活体成像技术,观察伊马替尼对斑马鱼胚胎发育的影响。 伊马替尼是第一个成功用于临床治疗CML 的TKI 类药物[9]。 自2001 年上市以来,伊马替尼以良好的治疗效果广泛的应用于CML 临床治疗。 新近临床研究显示:接受TKI 治疗3 年以上并持续分子响应MR4.0 ≥2 年的儿童(包括术后复发的患者)可以安全停药[5]。伊马替尼通常以甲磺酸盐的形式成药,具有良好临床效果的一个重要因素是其良好的药代动力学性质,口服生物利用度F 为98%,体内代谢产物去甲基化合物仍有活性,并且伊马替尼和代谢物的血浆半衰期分别为18 h 和40 h[1,10-12]。
这些临床治疗优势使得伊马替尼的临床用量不断增加,但多种临床不良反应也逐渐显现,对伊马替尼的研究亦不断深入。 伊马替尼主要通过抑制BCR-ABL 蛋白酪氨酸磷酸化发挥对CML 的治疗作用[3]。 此外,伊马替尼也被报道参与多个靶点的抑制,包括c-KIT、v-ABL、TEL/ABL、PDGFR 等活性的抑制[13-14]。 上述伊马替尼的靶向抑制均通过与酪氨酸激酶活性部位ATP 结合位点附近相结合,失活靶蛋白活性,最终导致促进CML 发生的下游信号通路关闭[15]。 伊马替尼靶向治疗CML 的分子机制已经基本明确,但其临床不良反应的来源仍不清楚。

图4 伊马替尼特异性抑制斑马鱼胚胎ISV 发育而对huc 标记神经元数量无显著影响(n=8)Note. A,In vivo imaging of huc labeled neurons and ISVs from 48 hpf zebrafish embryos was performed by confocal microscopy to analyze huc neurons and ISV morphology. There was a significant loss of ISV,but no significant change in the morphology of huc labeled neurons after treatment with imatinib solution. B,The number of huc labeled neurons in 48 hpf zebrafish embryos was counted,and the number of huc neurons was not significantly changed after treatment with imatinib solution.Figure 4 Imatinib specifically inhibited ISV development in zebrafish embryos but had no significant effect on the number of huc labeled neurons(n=8)
本研究在整体动物水平上,通过活体成像研究伊马替尼对斑马鱼胚胎发育的影响,探讨伊马替尼的毒副作用。 结果显示,100 ~0.01 μg/mL 的伊马替尼处理40 h,发育至48 hpf 的斑马鱼体型无显著异常,这与文献报道符合[16]。 在此浓度范围内,考察伊马替尼对斑马鱼血管发育的影响,发现伊马替尼能够显著抑制斑马鱼血管发育,包括抑制血管内皮细胞的增殖和ISV 的腔化。 进一步考察伊马替尼对斑马鱼神经发育的影响,结果显示伊马替尼对斑马鱼胚胎血管损伤的同时,对运动神经元和huc 标记神经元无显著影响。 这提示伊马替尼的临床不良反应可能与其对血管内皮细胞增殖和ISV 腔化的抑制相关。 对伊马替尼的分子机理研究主要集中于CML 的研究,其抑制血管新生的分子机理有待明确。 目前已有多个靶向血管内皮细胞的替尼类药物被批准用于临床肿瘤治疗,如乐伐替尼(lenvatinib)[17]、阿帕替尼(apatinib)[18]等。 这些替尼类药物均通过调控VEGF、PDGFR 等介导的信号途径靶向抑制肿瘤血管新生。 本研究对伊马替尼调控VEGF、PDGFR 信号进行了初步探索。 实验结果显示伊马替尼能够显著降低vegfr2 和pdgfrαmRNA 表达,并且随伊马替尼处理浓度增高,抑制效果增强。 不同浓度的伊马替尼对vegfr2 和pdgfrαmRNA 表达水平的下调程度与对ISV 发育的抑制程度具有较好的关联。 因此,我们推测伊马替尼很可能通过调控VEGF、PDGFR 信号途径抑制斑马鱼ISV 的发育。 其确切的分子机理是否与VEGF、PDGFR 信号途径相关还有待更多的研究证据。

图5 伊马替尼抑制斑马鱼胚胎vegfr2 和pdgfrα mRNA 表达Note. A,ISH test procedure and photographic site. B,ISH analysis ofvegfr2 andpdgfrα in the trunk position of wild-type zebrafish embryos.Vegfr2 andpdgfrα mRNA expression levels were significantly lower after treatment of wild-type zebrafish embryos with imatinib. C,Vegfr2 mRNA expression was measured by q-PCR assay after treatment of wild-type zebrafish embryos with imatinib(n=3).Vegfr2 mRNA expression levels were significantly lower after treatment of wild-type zebrafish embryos with imatinib. D,Pdgfrα mRNA expression was measured by q-PCR experiments after imatinib treatment of wildtype zebrafish embryos (n = 3).Pdgfrα mRNA expression levels were significantly lower after treatment of wild-type zebrafish embryos with imatinib.(*P<0.05,**P<0.01,***P<0.001)Figure 5 Imatinib inhibitedvegfr2 andpdgfrα mRNA expression in zebrafish embryos

