基于LC-MS 的冠心病人源菌群小鼠代谢组学研究
朱华,郭亚茜,杜晓鹏,李卓,苏磊,秦川
(卫健委人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
代谢组学是通过分析细胞或组织受遗传、环境等因素影响产生的小分子代谢物的变化规律,识别不同病理生理同状态下的差异代谢产物,进而推测正常或疾病时机体代谢的生理病理机制[1-2]。 冠心病作为一种常见的心血管疾病,由于基因与基因、基因与环境的相互作用导致存在大量特征性代谢产物及相关代谢通路,其病理生理机制与代谢性密切相关[3-4]。 对冠心病患者及相关动模型的粪便、血液等进行代谢组学分析,了解其发生、发展进程中伴随的小分子物质的生物学变化,发现可能相关的代谢标志物,研究其病理机制,对冠心病早期筛查、诊断、疾病进展监测、治疗效果评估和预后评价等各个方面都具有重要意义[5-6]。 目前主要的代谢组技术平台主要有气相色谱-质谱(GC+MS),液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)等。 其中LC-MS 具有灵敏度高、分离效率高、数据库完整易于分析等优点[7-8]。 LC-MS 法主要检测非挥发性的低分子化合物,样品用量少,可同时检测几百种化合物,目前己被广泛用于心血管疾病、胃肠道疾病、糖尿病、肿瘤等多种疾病及药理、毒理、营养等方面的研究。 课题组在前期工作中已成功建立冠心病菌群人源化小鼠模型,本研究在此基础上,通过LC-MS 对模型小鼠进行血浆的非靶向代谢组学研究,从代谢组学角度探讨肠道菌群与冠心病发生、发展的关系,寻找其可能存在的新干预靶点。
1 材料与方法
1.1 材料
1.1.1 动物模型
实验使用的动物为课题组自己繁育的无菌C57BL/6J 小鼠,雌性,饲养于无菌隔离器,实验动物使用许可证号【SYXK(京)2018-0019】。 饲养条件:温度21 ~25℃,湿度40% ~70%,光照周期明暗比12h:12h。 实验获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)批准,批准号ZH17001。 模型建立方法见参考文献[9]。
1.1.2 主要试剂与仪器
分析用甲醇,纯净水、乙腈、甲酸均为Thermo 公司产品。 主要仪器:质谱仪(Thermo,QE HF-X),色谱仪(Thermo,Vanquish UHPLC),色谱柱(Thermo,Accucore HILIC column),低温离心机(Thermo,ST16R),真空冷冻干燥机(Labogene ,Scan Speed 40)。
1.2 方法
1.2.1 样品采集及处理
在粪菌移植6 周、10 周后每组分别安乐7 只动物,小鼠眼眶取血,肝素抗凝,1500 rpm/min 离心10 min,分离血浆,无菌管分装后,-80℃保存待测。检测时取100 μL 血浆样本置于EP 管中,加400 μL 80%甲醇水溶液,漩涡震荡,室温静置60 min 后4℃15 000 rpm/min 离心20 min。 取上清于1.5 mL 离心管中真空冷冻干燥。 残留物用100 μL 复溶剂溶解,漩涡震荡,4℃15 000 rpm/min 离心15 min 取上清100 μL 进行LC-MS 分析。 从处理好样本中取等量上清100 μL 混匀做质控。 选择实验样本的空白基质作为空白样本,处理方法与样本相同。
1.2.2 数据处理
将下机原始数据导入CD 搜库软件做保留时间、质荷比等参数的初步筛选。 然后对样品根据保留时间偏差0.2 min、质量偏差5 ppm 进行峰对齐,以提高鉴定准确度。 随后根据设置的质量偏差5 ppm、信号强度偏差30%、信噪比3、最小强度100 000、加和离子等参数进行峰提取,对峰面积进行定量,整合目标离子预测化合物的分子式并与mzCloud 数据库进行比对。 空白样本用于去除背景离子,质控样本用于定量结果进行归一化,最终得到数据鉴定和定量结果。
1.3 统计学分析
数据分析使用SPSS 22.0 统计软件。 统计结果用平均值±标准差(±s)形式表示,组间差异使用One-way ANOVA 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 分析方法验证
QC 样本的作用在于测试加样前仪器状态,评价实验过程中色谱-质谱系统的稳定性。 QC 样本相关性数值越接近于1 表示测试方法稳定性越好,数据质量越高。 在正负离子2 个模式下,QC 样本相关性最小值为0.976,表明此次检测方法稳定,数据可信(图1)。 通过偏最小二乘法判别分析(PLSDA)获得模型评价参数(R2,Q2),R2 和Q2 值越接近1,表示模型越稳定可靠;若R2 和Q2 小于0.5,则表示模型可靠性较差。 实验得到的模型相关评价参数为:6 周时R2=0.66,Q2=0.71(图2A),10周时R2=0.60,Q2=0.97(图2B),说明模型构建稳定,数据可靠。
2.2 总样本主成分(PCA)分析
对采集到的数据进行PCA 分析,可以看到实验组、对照组在正负离子分析模式中均被明显的分开(图3),说明两组动物间代谢存在明显的差异。 而每个组内不同时间节点则聚合的较好,说明在组内不同时间的代谢方面模型是稳定的(图3)。
2.3 差异代谢产物的筛选与鉴定
本实验使用PLS-DA 模型第一主成分的变量投影重要度(Variable Importance in the Projection,VIP)值结合t-testP值获得差异性表达代谢物。 设置阈值为VIP >1.0,差异倍数FC >2.0 或FC <0.5 且Pvalue <0.05,在建模6 周时正离子模式筛选出差异代谢产物476 个,其中上调223 个,下调253 个。 10 周时正离子模式筛选出差异代谢产物475 个,其中上调193 个,下调282 个。 6 周负离子模式筛选出差异代谢产物344 个,其中上调152 个,下调192 个。 10 周负离子模式筛选出差异代谢产物330 个,其中上调104 个,下调226 个(表1)。
在HMDB 数据库中找出对应的可能内源性物质,再在PeakView 软件中找出这些可能物质相应的一级和二级质谱图,通过与数据库(HMDB,METLIN,MassBank 和KEGG)中的一级和二级质谱图进行比对,最终通过标准品确认30 个在2 个时间点均存在的差异代谢物。 其中L-肉毒碱、苯丙酮酸、1-萘酚、2-萘酚在模型组显著升高(表2)。
2.4 代谢通路分析
为进一步研究这30 种差异代谢物与冠心病之间的关系,本研究通过MetPA 3.0 进行代谢通路分析来确定与差异代谢物最为相关的代谢通路。 最终发现次级胆汁酸代谢通路(影响因子0.33)、甘氨酸、丝氨酸和苏氨酸代谢途径(影响因子0.31)这2个在建模6 周、10 周2 个时间点都发生改变的代谢通路(图4)。 且这两条代谢通路均为下调(图5)。
3 讨论
本研究基于LC-MS 技术对冠心病人源菌群小鼠的血浆进行了非靶向代谢组学研究。 在建模6周、10 周2 个时间节点的R2 和Q2 值分别为0.66、0.71 和0.60、0.97,说明代谢模型构建成功,有良好的预测能力。 在PCA 分析中,CON 组和CAD 组在正负离子模式下均被明显的区分开,而在组内不同阶段则聚合的较好,说明两组动物间的小分子物质代谢存在明显差异,但在组内代谢方面是稳定的。
通过多元统计数据分析,鉴定出包括L-肉毒碱、苯丙酮酸、1-萘酚、2-萘酚在内的30 种在2 个时间节点都具有显著差异性的代谢物。 这些代谢物主要包括苯和其取代的衍生物、核苷酸类、类固醇和类固醇衍生物类、羧酸及其衍生物类、胺类等。肉毒碱类代谢物在冠心病患者与对照人群中的差异几乎在所有有关冠心病代谢组学研究都被报道过。 L-肉毒碱是一种来源于甲硫氮酸和赖氨酸生物合成的季铵化合物,在能量代谢,特别是脂肪酸分解代谢中发挥重要作用,它可以辅助转移长链脂肪酸通过线粒体内膜进入基质,通过促进其β-氧化为心肌细胞提供所需能量[10-12]。 L-肉毒碱减少会导致脂肪代谢异常,血脂升高,加速动脉粥样硬化进程,促进冠心病的发生发展[13-14]。 本研究中也发现在不同时间节点模型组动物L-肉毒碱水平的显著降低。 与上述报道相符。

图1 QC 样本相关性分析结果Figure 1 Results of QC sample correlation analysis

图2 模型评价参数Note. A,Positive ion mode; B,Negative ion mode.Figure 2 Evaluation parameters of metabolic model
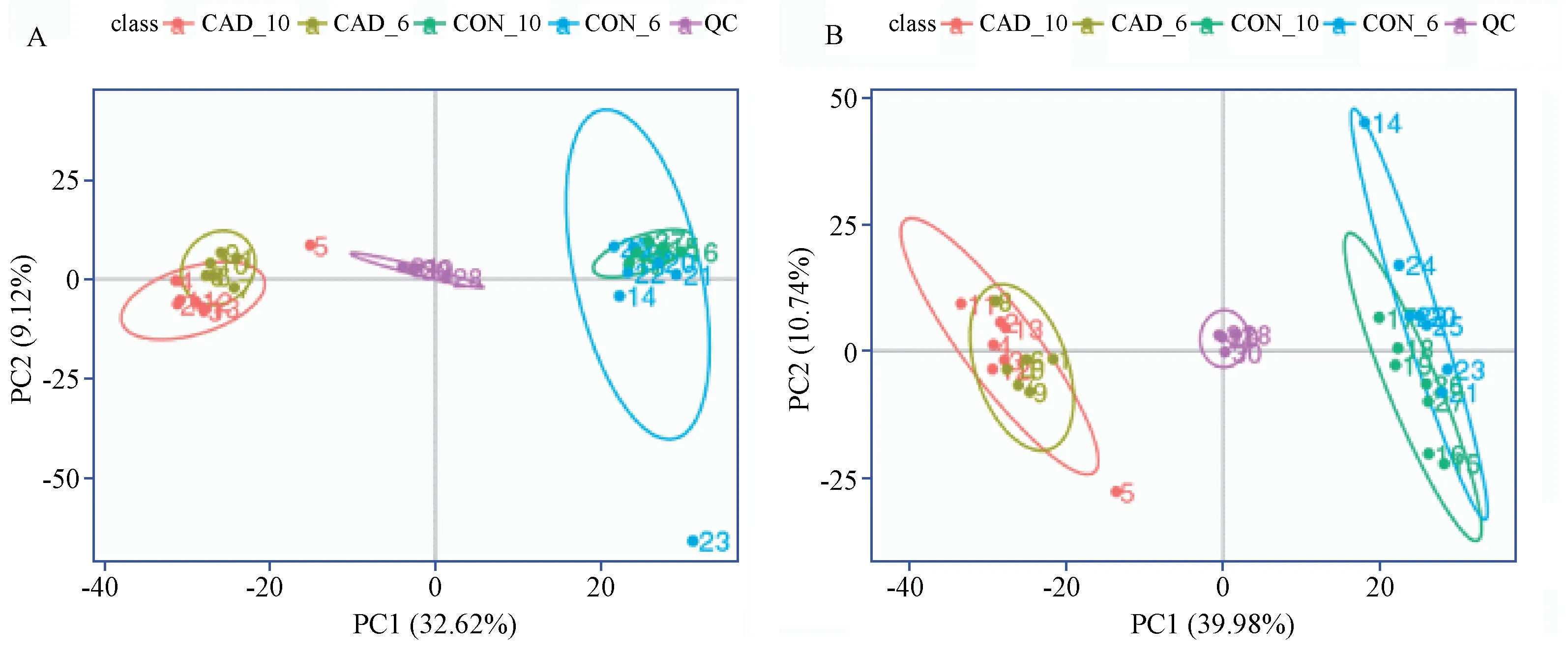
图3 总样品PCA 分析Note. A,Positive ion mode; B,Negative ion mode.Figure 3 PCA of the QC samples
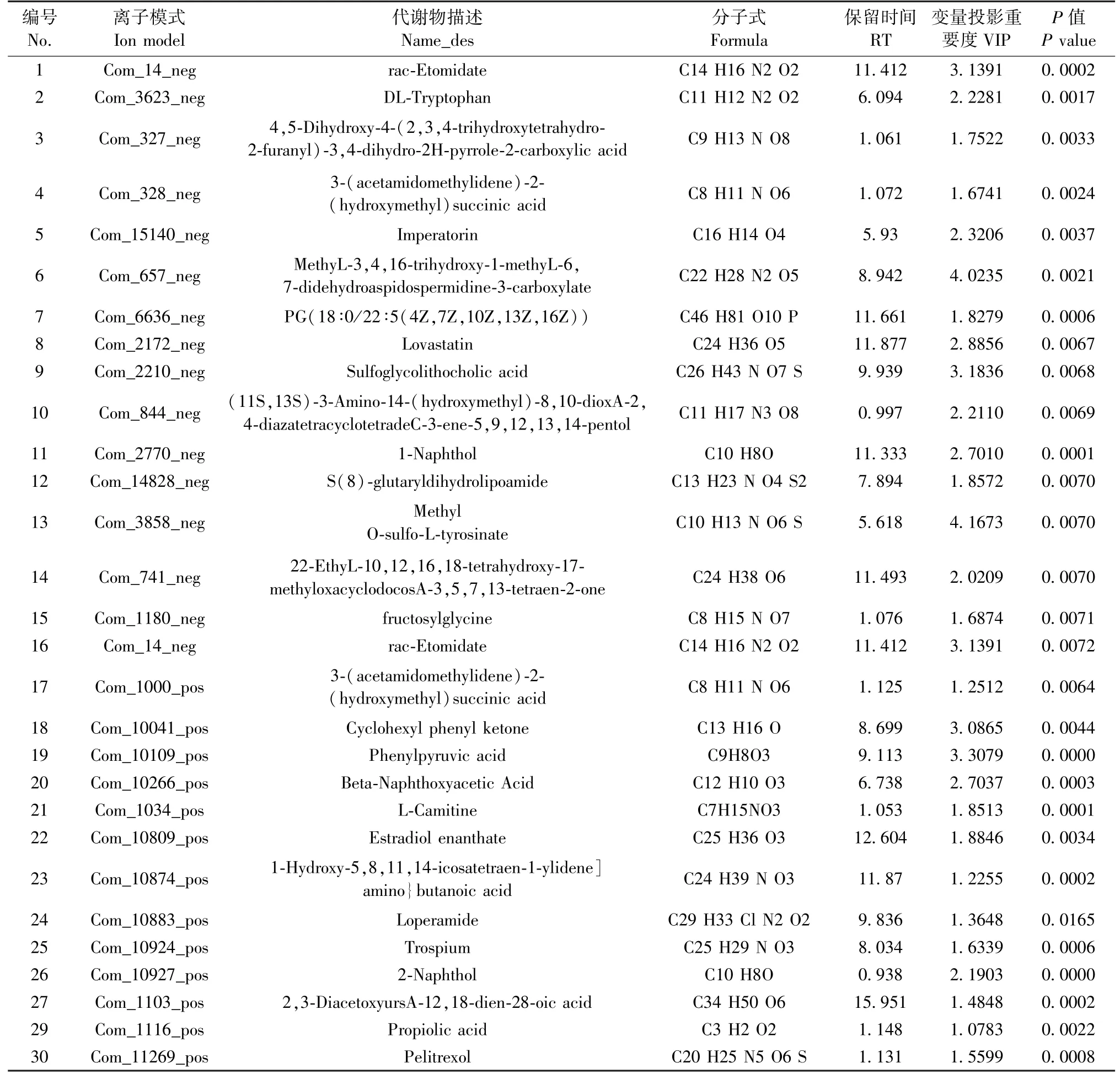
表2 特征性差异代谢产物Table 2 Characteristic differential metabolites
为进一步研究这30 种代谢物和冠心病之间的关系,通过代谢通路分析确定了与所选代谢物最为相关的代谢通路。 最终发现次级胆汁酸代谢、甘氨酸、丝氨酸和苏氨酸代谢这2 个通路在6 周、10 周2个时间点都呈现下调趋势。 甘氨酸、丝氨酸和苏氨酸代谢途径主要是促进磷酸肌酸和ATP 合成:甘氨酸是内源性抗氧化剂还原性谷胱甘肽的组成氨基酸,在谷氨酸-半胱氨酸连接酶的催化下,消耗ATP产生γ-谷氨酸半胱氨酸,然后在谷胱甘肽合成酶催化下,与甘氨酸结合合成谷胱甘肽。 苏氨酸主要通过苏氨酸脱水酶、苏氨酸脱氢酶、苏氨酸醛缩酶催化转变为其他物质。 处于氨基酸代谢中间位置的丝氨酸则主要通过增加NADPH 的合成,消除氧自由基的毒害作用,在维持细胞的存活中起重要作用[15-17]。 模型动物这条代谢通路下调,能量代谢降低,氧自由基、肉毒碱、丙酮类有害代谢产物增加。这与冠心病患者缺血缺氧使三羧酸循环(TCA)受抑制,能量供应不足的病理生理机制是吻合的。
胆汁酸不仅是参与脂类消化吸收的重要物质,也是调控糖脂和能量代谢的关键信号分子[18]。 胆汁酸以胆固醇为原料在肝脏中合成,通过肠肝循环在肠道中代谢。 胆汁酸与肠道菌群之间存在着相互作用的关系。 肠道菌群可促进食物中营养物质的吸收,并产生大量代谢物通过相应的受体间接调控宿主代谢[19]。 胆汁酸的肠道调控,主要是通过激活肠道FXR 核受体实现。 胆汁酸代谢通路下调使胆固醇代谢减慢,血脂升高[20]。 这与模型组移植志愿者的临床症状、小鼠模型体重增长趋势及血脂变化情况相符。

图4 不同时间节点的共同差异代谢通路Note. A,6 weeks after modeling. B,10 weeks after modeling.Figure 4 Common differential metabolic pathways at different time nodes

图5 冠心病人源菌群小鼠差异代谢通路Note. A,Bile acid metabolism pathway. B,Glycine,serine and threonine metabolism pathway.Figure 5 Differential metabolic pathways in mice with coronary heart disease
本研究应用代谢组学技术对冠心病人源菌群小鼠的特征性代谢产物及相关代谢通路进行研究分析,发现了与冠心病患者类似的改变,为冠心病病理机制、早期诊断、治疗效果评估等的研究提供了基础数据。 但代谢组学技术可检测出大量差异性代谢产物,如何有效筛选出与疾病明确相关的特征性代谢物质仍是需要解决的问题。 这些不足希望可以通过进一步提高完善代谢组学检测分析技术来解决。

