内镜下射频消融术联合药物治疗藏区巴雷特食管患者的临床研究
潘雯 刘超 任涛 李晓萍 高薇娜 梁翠婷 刘秋梅
巴雷特食管(Barrett's esophagus,BE)为食管腺癌的癌前病变之一,80.0%的食管腺癌来源于BE[1]。中国BE患病率为1%~3.8%。高原藏区患者因饮食习惯、饮酒、肥胖、久居高原等因素,使得藏族BE的发病率显著高于内地城市的平均水平[2]。内镜下射频消融术(endoscopic radio frequency ablation,ERFA)是目前应用最广泛的治疗BE伴异型增生的方法[3]。本研究通过比较单用药物及其与ERFA联合药物对治疗藏区BE患者的临床疗效评估,旨为藏区BE患者找到一种更安全有效的治疗方法。
资料与方法
一、一般资料
选取2017年1月至2018年6月就诊于西藏自治区人民政府驻成都办事处医院消化内科的患者160例。其中,男性84例,女性76例,年龄24~78岁(50.6±12.2)岁。经胃镜、病检证实为BE,充分告知患者单独药物治疗及其与ERFA联合治疗的优缺点和潜在风险,患者及家属自行选择治疗方案。本研究通过西藏自治区人民政府驻成都办事处医院伦理委员会批准[伦审号为(2017)科研第35号]。全部患者或其委托代理人均签署知情同意书。
二、纳入与排除标准
1.纳入标准:(1)18岁≤年龄<80岁;(2)胃镜、病检证实为BE;(3)无精神障碍、语言障碍、听力障碍等影响研究进程者。
2.排除标准:(1)年龄<18岁,≥80岁;(2)排除身体状况差,不能耐受麻醉和手术,如严重的心肺疾病、凝血功能障碍、肝肾功能不全等;(3)已确诊有胃肠道及其他脏器恶性肿瘤。
三、研究分组
研究患者分为药物治疗组和ERFA联合治疗组。药物治疗组采用药物治疗1个月,药物包括质子泵抑制剂及粘膜保护剂,术后1年复查胃镜、病检。ERFA联合治疗组是采用药物治疗组的药物联合ERFA治疗,术后3个月进行第二次ERFA联合药物治疗,术后1年复查胃镜、病检。除治疗方法不同外,其余治疗手段均为相同的常规处理。
四、设备及仪器
本研究使用的设备及仪器包括OLYMPUS GIFHQ290(日本OLYMPUS公司)、GIF-Q260胃镜(日本OLYMPUS公司)、Barrx™90/60射频消融系统(美国BARRX Medical公司)。
五、内镜诊断及治疗
所用内镜操作均在静脉麻醉下进行。常规胃镜检查,窄带成像内镜(narrow band imaging,NBI)及1.5%白醋染色确定治疗区域后,退出胃镜。将Barrx™90/60射频消融电极安装在内镜前端,再次进镜,内镜直视下将电极片置于治疗区域进行灼烧(能量密度设定为12 J/cm,功率为300 W),灼烧后病变表面凝固坏死,粘膜呈黄白色改变,利用电极片铲除表面凝固坏死的粘膜,再对同一病灶进行第2~3次射频消融术治疗。并记录内镜下分型、术中出血量、操作时间等。
六、组织病理学
所有标本均经过取材、固定、脱水、浸蜡、包埋、切片、贴片、染色和封片标准处理,然后由指定的2名病理学医生各自独立读片,任何读片结果的分歧将由病理学专家进行非盲共识评价,均以最重病理结果作为结果。
七、术后处理及并发症观察
1.术后处理:术后禁食24 h,给予持续静滴质子泵抑制剂(proton pump inhibitor,PPI)及镇痛、补液等对症治疗,24 h后据个体情况由低温流质饮食逐渐过渡为软食,留院观察3~5 d后如无严重并发症可安排出院,出院后半月给予PPI强化治疗及黏膜保护剂,再继续给予PPI常规剂量及黏膜保护剂治疗半个月。每位受试者研究期限为12个月(截止日期至2019年6月)。
2.并发症观察:记录近期及远期不良事件,ERFA术后患者不同程度出现一过性不良事件,如咽痛、发热、反酸、烧心、嗳气、恶心、腹胀、腹痛等。并发症包括出血、穿孔、狭窄等。
八、临床疗效评定
(一)胃食管反流病评定
BE患者中可能无任何临床症状,部分患者可有胃食管反流症状,利用胃食管反流病问卷(GerdQ),对患者症状频率及程度进行评分(见表1)。8分为临界分值,总分≥8分,即提示胃食管反流病诊断。
(二)内镜表现评定
BE内镜下的典型表现为齿状线消失或上移,食管下端粉红色的光滑鳞状上皮中见有桔红、紫红或天鹅绒样红色柱状上皮黏膜区,可有充血水肿、糜烂、增生等表现。治疗后病变完全消失,视为治愈;病变缩小为原来的1/2以上,为有效;病变缩小少于原来的1/2或病变部位增多,活检与治疗前相比无改观,为无效。总有效率为治愈率与有效率之和。
(三)病理学改变
据病理学标准,评定较前有无改善,若无肠化、杯状细胞等表现,即活检病变消失,逆转为复层鳞状上皮,视为治愈;活检为柱状上皮、鳞状上皮或者柱状上皮和鳞状上皮复合型,为有效;若活检与治疗前相比无改观,为无效。总有效率为治愈率与有效率之和。
九、统计学分析
采用SPSS17.0统计学软件进行数据处理。计量资料采用均数±标准差(±s)表示,胃食管反流病评分等计量资料采用t检验、治疗后内镜及病理评价有效率等计数资料均采用卡方检验等统计学分析。以P<0.05为差异具有统计学意义。
结 果
一、本研究的患者情况
本次研究共纳入了160例患者,每组各80例。两组患者在人口学信息、症状、形态分型及长度分型方面差异无统计学意义,一致性好较好,具有可比性(P>0.05,见表2)。患者随访时间为1年,随访过程中药物治疗组及ERFA联合治组分别有2例、3例患者失访。
二、临床症状评分
据胃食管反流病问卷,药物治疗组、ERFA联合治疗组术前、术后3个月及术后1年分别进行评分,两组均显示术后(3个月及1年)评分均显著低于术前,但药物治疗组与ERFA联合治疗组之间,术后3个月与术后1年之间,差异均无统计学意义(P>0.05,见表3)。

表1 胃食管反流病问卷(GerdQ)
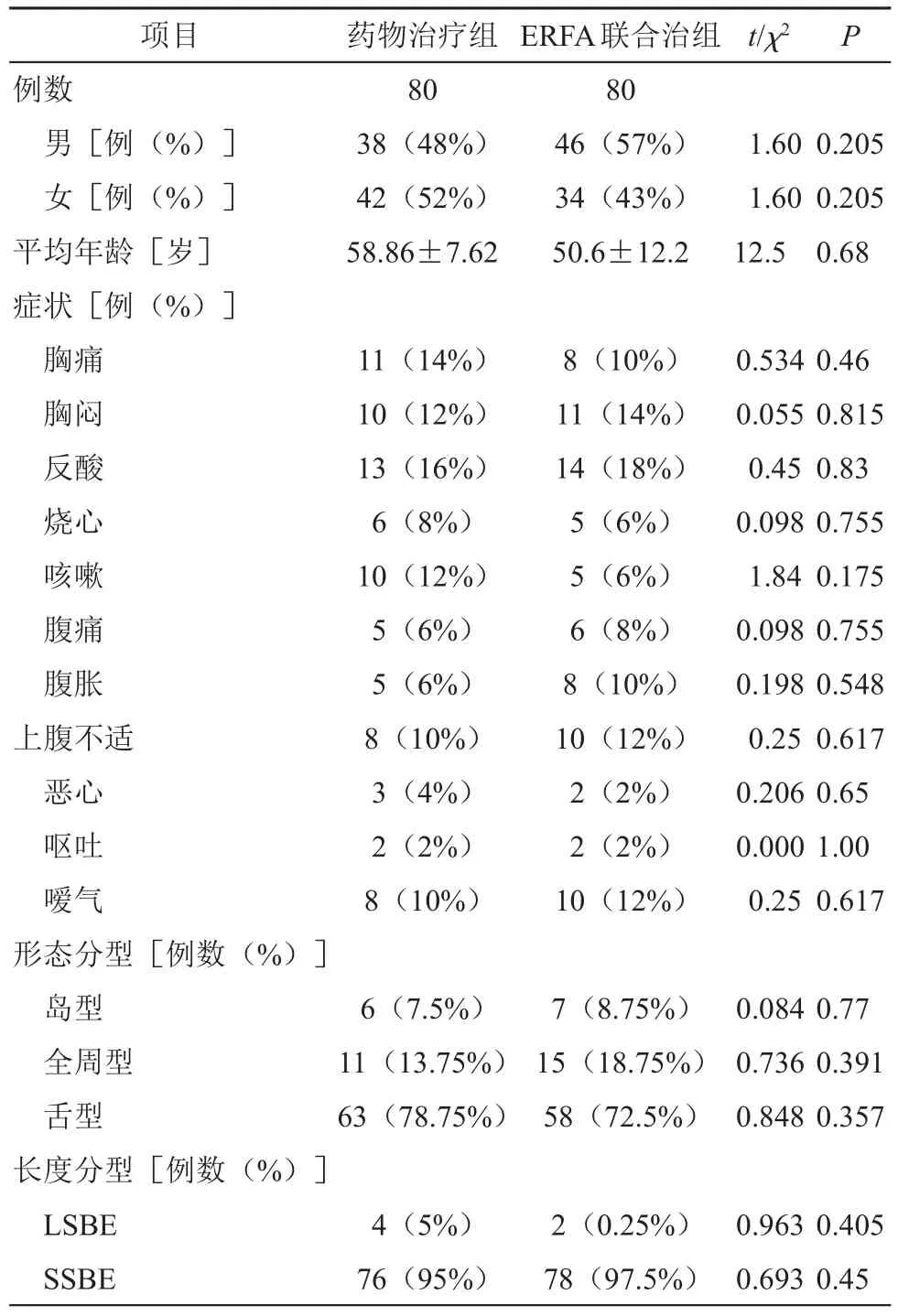
表2 两组患者的一般情况
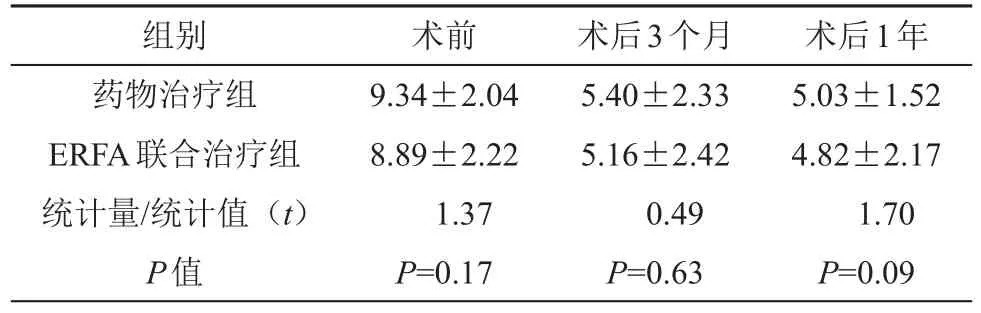
表3 术前、术后临床症状评分的比较
三、两组内镜下的表现情况
术后3个月药物治疗组内镜下治愈4例,有效11例,总有效率18%;ERFA联合治疗组内镜下治愈45例,有效32例,总有效率96%;术后1年复查,药物治疗组治愈及有效分别为2例和9例,总有效率14.1%;ERFA联合治疗组治愈及有效分别48例和25例,总有效率94.8%。胃镜下表现的改变药物治疗组、ERFA联合治疗组代表病例内镜表现。见图1和图2。内镜有效性提示药物治疗组显著高于ERFA联合治疗组(P<0.05,见表4)。
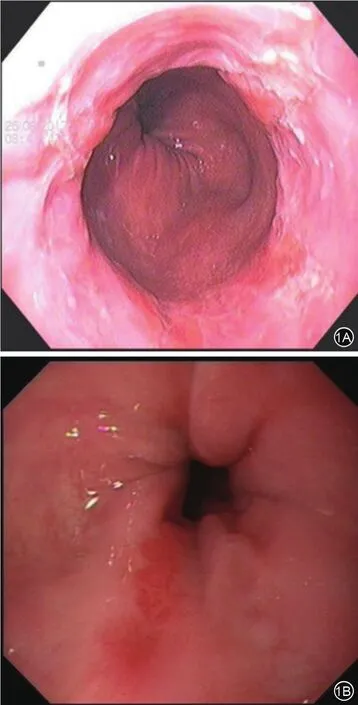
图1 药物治疗组内镜下时治疗前与治疗后食管表现1A示齿状线上移,可见舌状红色柱状上皮黏膜;1B示齿状线上移,仍可见舌状红色柱状上皮黏膜
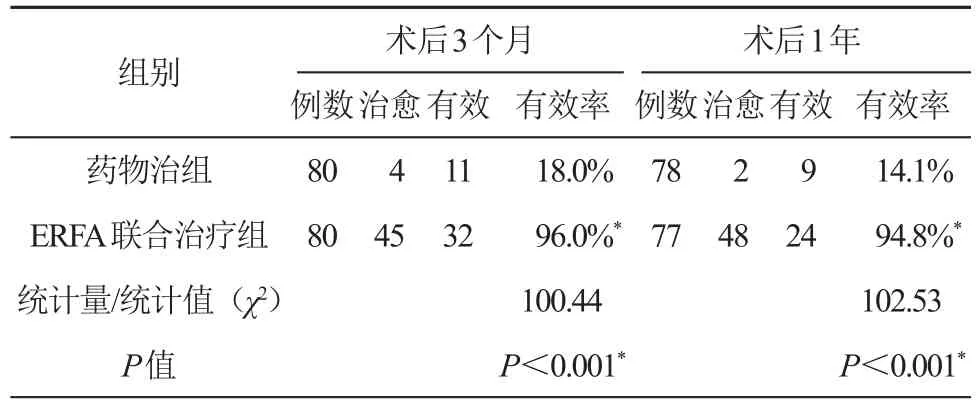
表4 两组内镜有效性的评估
四、病理学改变
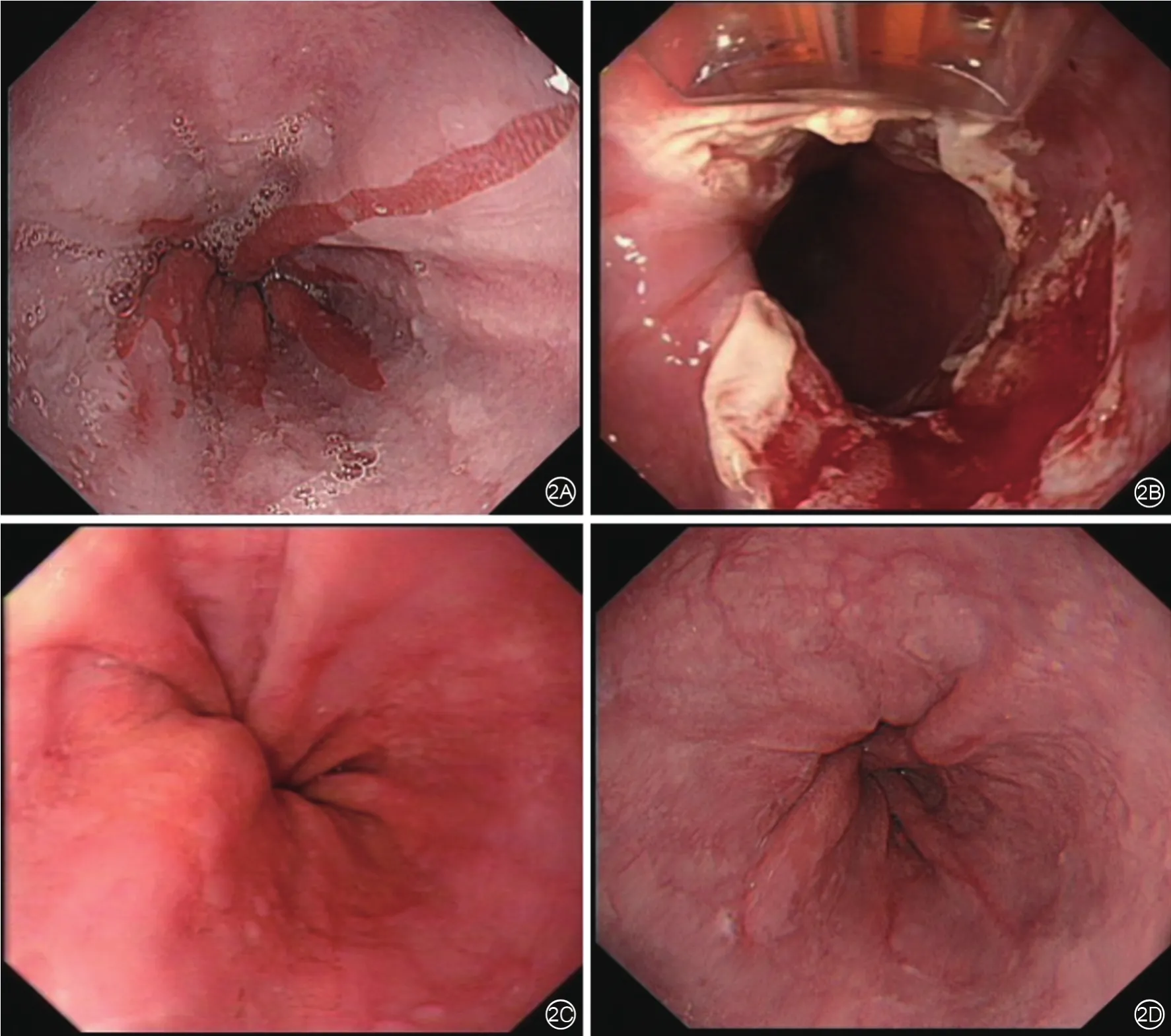
图2 ERFA联合治疗组内镜下术前、术中及术后食管表现2A示术前齿状线上移,可见舌状红色柱状上皮黏膜;2B示术中针对病变区域进行内镜RFA治疗;2C示术后3个月复查病变缩小为原来的1/2以上,内镜下达到有效,再次给予内镜下RFA联合药物治疗;2D示仅表现为条索状充血痕等炎症表现,巴雷特上皮几乎完全消失,内镜下达到治愈
术后3个月复查病理活检,药物治疗组治愈1例,有效5例,总有效率7.5%;ERFA联合治疗组病理活检治愈43例,有效32例,总有效率93.8%;术后1年复查病检,药物治疗组治愈及有效分别0例和4例,总有效率5.1%,ERFA联合治疗组治愈及有效分别39例和31例,总有效率90.9%。ERFA联合治疗组病理活检及病理有效性显示药物治疗组显著高于ERFA联合治疗组(P<0.05)。见图3和表5。
五、其他观察指标
入选的160例患者中,按形态分型,舌型BE居多,共121例(占76%),全周型26人(占16%)、岛型13人(占8%);按长度分型,长节段巴雷特食管(long segment of Barrett's esophagus,LSBE)占绝大多数,共154人(占96%),短节段巴雷特食管(short segment of Barrett's esophagus,SSBE)仅6人(占4%),与各国文献指南统计数据类似。
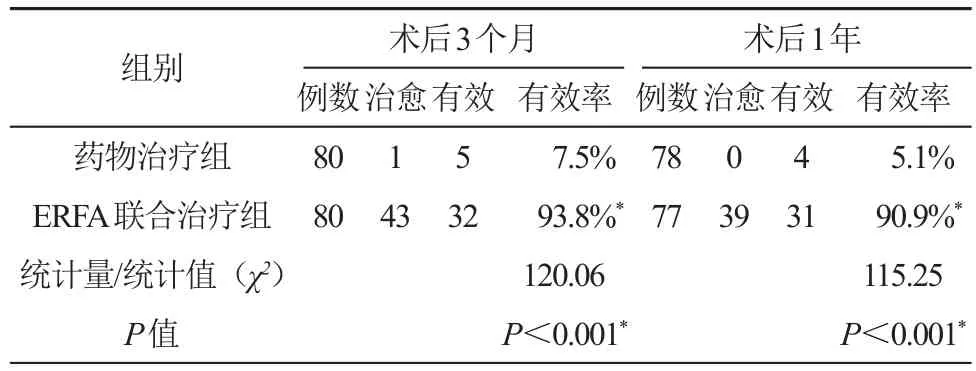
表5 两组病理有效性的比较
ERFA联合治疗组术后3个月复查,总有效率93.8%,5例无效,包括1例全周型、4例舌型,其中LSBE 2例、SSBE 1例;术后1年复查,失访3例,总有效率90.9%,7例无效,包括2例全周型、5例舌型,其中LSBE 2例、SSBE 1例。无论术后3个月还是1年,岛型均治愈。见表6。
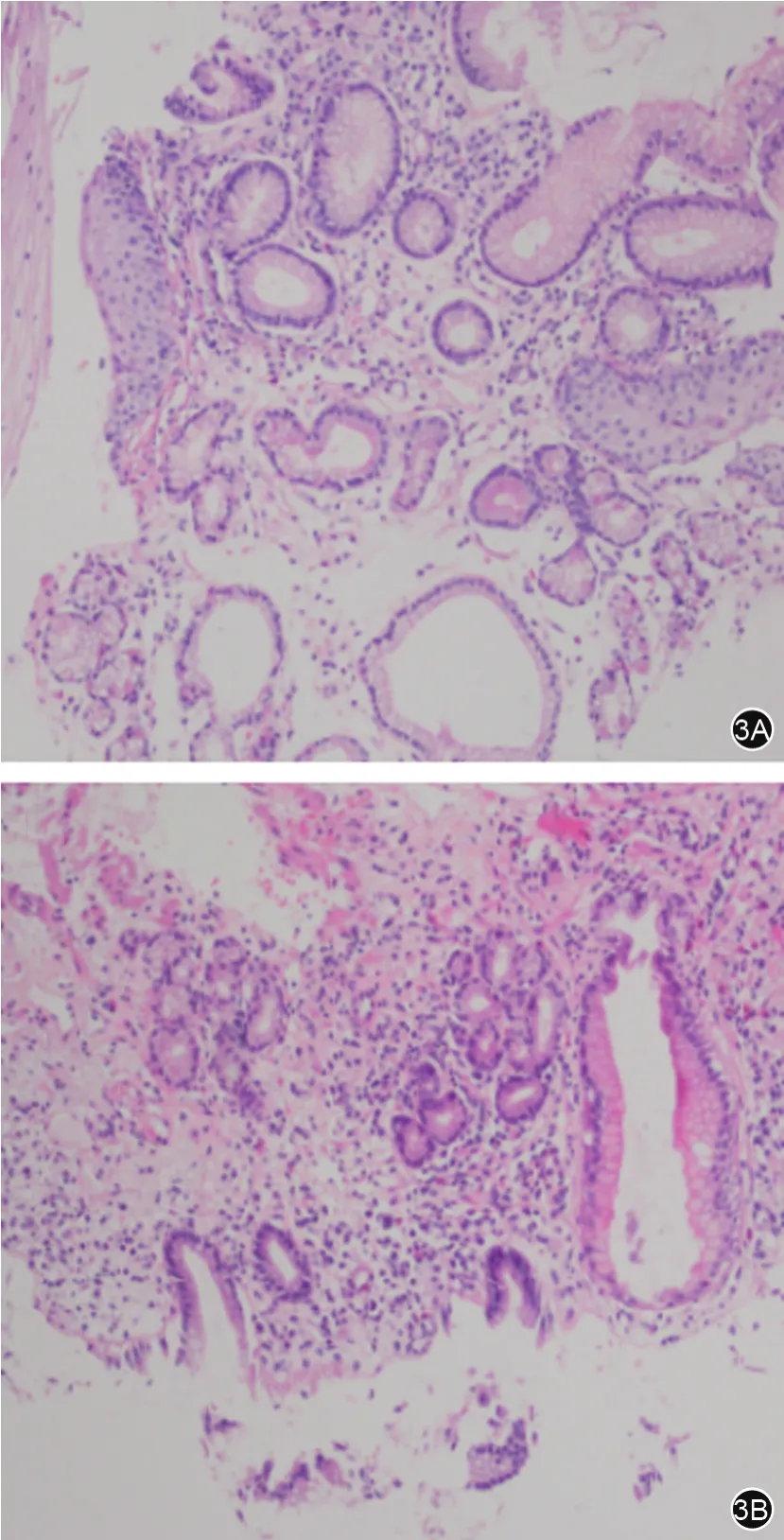
图3 ERFA联合治疗组治疗前后病理检查3A示术前病理活检查见杯状细胞,提示BE;3B示术后1年病理活检提示鳞柱交界粘膜,可见粘膜轻度慢性炎,未见粘膜上皮杯状细胞化生(HE染色10×40)
ERFA治疗BE操作时间短、术中出血量少、住院时间短,具体时间视病变大小、类型而定。见表7。
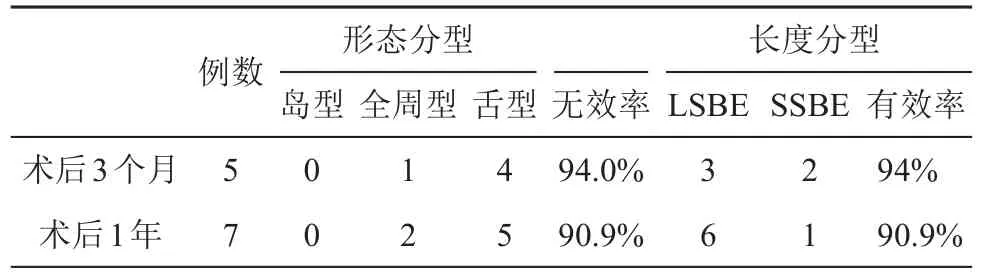
表6 ERFA术后复查各类型无效例数与内镜有效率
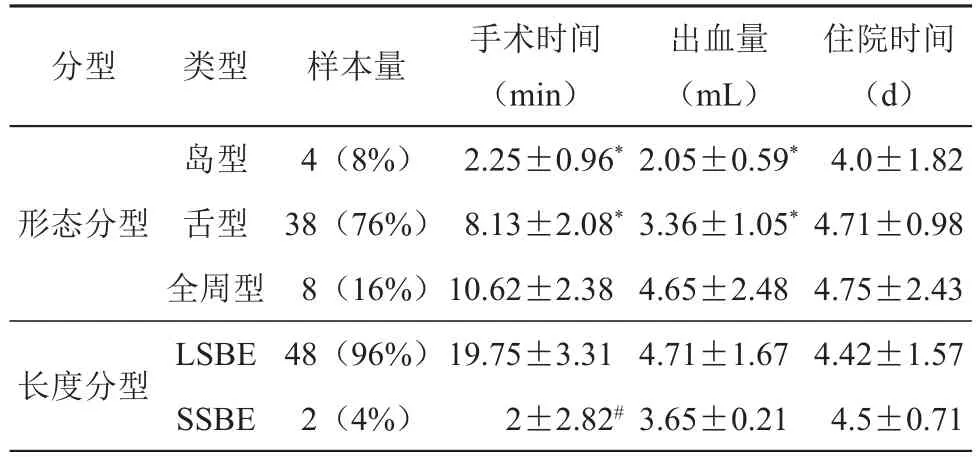
表7 各类型BE操作时间、出血量、住院时比较
六、两组治疗方法的不良反应与并发症情况
药物治疗组未出现特殊不良反应与并发症;ERFA联合治疗组术后不同程度出现一过性胸痛、烧心、反酸、咽痛、腹胀、恶心、呕吐、发热等不适,术后给予静脉泵入质子泵抑制剂等治疗24 h后基本可缓解,持续2~3 d,一般不超过7 d。两组无一例出现出血、穿孔、狭窄、误吸、肺炎等并发症;无死亡和对生命有危险并能够导致人体永久或显著的伤残、对器官功能产生永久损伤、导致住院或住院时间延长得严重不良事件发生。
讨 论
食管癌为世界上6种最常见癌症死亡原因之一,西方以食管腺癌为主,我国90%为鳞状细胞癌,还有一部分为腺癌、腺鳞癌和小细胞癌[4]。近年来,随着我国生活水平的不断提高,肥胖、反流性食管炎人群大量增加,导致食管腺癌发病率不断上升,其中80.0%的食管腺癌来源于BE[1]。
一、BE的流行病学
BE是指食管下段单层柱状上皮取代复层鳞状上皮的一种病理现象,可伴肠化或不伴肠化,属于食管腺癌的癌前病变[5]。巴雷特上皮是慢性损伤造成的肠上皮化生,发生腺癌的几率为0~14.8%,比正常情况高30~125倍[6]。BE在欧美发病率较高,近年来亚洲国家也呈明显的上升趋势,是目前已知导致食管腺癌的最危险因素之一[7]。高原藏区患者BE发病率高于内地患者[2]。可能为久居高海拔低氧地区、饮食习惯、饮酒等因素所致。随着高原藏区生活水平的提高,藏区患者对健康及生活质量的追求亦随之增高。部分有临床表现的BE患者,想要通过更积极安全的方式改善生活质量。同时,对于食管腺癌的癌前病变,藏区患者逐步认识并开始重视BE。虽然定期随访可以实现对食管早癌的早诊早治,但也增加了患者的心理负担及医疗成本。因此,迫切需要在癌前疾病阶段(如BE伴或不伴上皮内瘤变),便进行干预治疗。
二、BE的治疗方式
对BE的治疗主要包括药物治疗、内镜治疗和外科治疗。药物治疗主要用以缓解症状、治疗食管炎。同样,虽有研究显示,腹腔镜胃底折叠术治疗BE,90.0%的患者无不典型增生和腺癌的发展,且创伤小、不良反应少[8];亦有研究报道BE手术治疗创伤小,但术中有3.0%~5.0%的死亡率,术后有高达40.0%~50.0%的复发及永久丧失食管功能的几率[9]。因此,BE的内镜下根除治疗就显得尤为重要[10]。内镜下治疗较药物治疗疗效确切,较外科手术治疗创伤小、术后并发症少,且可以保存食管的功能。内镜治疗包括光动力疗法、射频消融术、冷冻疗法、内镜下黏膜切除术、内镜粘膜下剥离术等。Nicholas等[11]指出,内镜下根除治疗的治疗终点以彻底根除肠化生优于彻底根除异型增生,但需根据患者的所有临床特点做决定。目前,国内外关于BE治疗指南中均支持使用射频消融疗法。美国胃肠病学会最新指南指出,对于伴异型增生的BE,推荐使用ERFA,对于不伴有异型增生的BE,建议给予ERFA[12]。
三、ERFA的发展
射频消融术(radiofrequency ablation,RFA)是一种通过热效应导致黏膜病变凝固、坏死的简便、安全、有效的治疗方式[3]。目前,ERFA主要是内镜结合HALO消融系统,后者包括用于环周消融的HALO360系统和用于局灶消融的HALO60/90系统。ERFA是以电极与黏膜均匀的接触,通过高频率射频波使组织中离子震动、摩擦生热,并传导至邻近组织,使病灶局部产生高温,肿瘤组织经过发生细胞凝固性坏死,形成不可逆性毁损灶,破坏异常的柱状上皮,并允许周围正常的鳞状细胞上皮向病灶中心生长。ERFA被广泛用于治疗BE和早期食管腺癌,且多项临床试验均证实该方法安全、有效[13-19]。Shaheen 等[20]的一项多中心随机对照实验中,证实ERFA能够减少伴有低到高度不典型增生的BE患者进展为食管腺癌的风险。实际上,不伴上皮内瘤变的BE中,早期食管腺癌的发展风险为每年0.3%[21],而伴有低级别上皮内瘤变[22]和高级别上皮内瘤变[23]的早期食管腺癌发展风险分别为0.5%和7.0%,即不伴上皮内瘤变的BE与伴低级别上皮内瘤变的BE癌变风险相似,亦有监测随访及积极治疗的必要性。另外,ERFA的操作较内镜下黏膜切除术、内镜粘膜下剥离术等更为可控,消融深度一致,仅限于500~1000 μm之间。因此,几乎无并发症(<0.2%),消融后食道狭窄的发生率只有1.7%[24]。
基于以上原因,该实验采用了ERFA治疗藏区BE患者。该实验进一步证实,药物联合ERFA治疗不但能缓解症状,而且可显著改善内镜及病理表现,并可达到较高的肠上皮化生根除率,有效地治疗BE,进而能够有效地控制疾病的恶性进展。同时,该实验证实ERFA治疗BE耗时少、操作简便、不良事件风险小。ERFA引起的术中、术后轻微不良反应,包括发热、胸痛、反酸、恶心、呕吐等,但多为一过性;无严重并发症发生,如穿孔、出血、食管狭窄等,但因随访时间相对较短,仍需长期随访观察有无长期并发症。藏区与其他地区BE患者具有相似的内镜表现,以舌型、SSBE居多。术后随访证实,岛型BE患者均治愈,而全周型、舌型,以及LSBE、SSBE具有无效者,考虑与病灶大小有关。Krishnamoorthi等[25]报道ERFA治疗BE后复发的风险很小,其中伴肠化、低级别上皮内瘤变、高级别上皮内瘤变,早期食管腺癌复发率分别为7.1%/年、1.3%/年,0.8%/年,但仍建议在完全根除BE后需定期监测。多个研究小组业已证实,BE的节段长度、裂孔疝大小和年龄是术后复发的危险因素[26-30]。
综上所述,对于高原藏区BE患者,有效治疗可以阻断经化生-异型增生-肿瘤途径所导致的食管腺癌的发生,ERFA联合药物治疗较单用药物治疗更安全、有效。因此,后续加强对不同节段长度、裂孔疝大小、年龄及伴有肠化或低级别上皮内瘤变、高级别上皮内瘤变患者的分层管理、随访,观察其有无长期并发症、有无复发以及最终转归是我们下一步工作的重点。

