负载型CoS2/Bi2WO6的制备及其光催化性能研究
马 鑫,钱 湘,范小强,马江权
江苏省先进催化与绿色制造协同创新中心,常州大学石油化工学院,江苏 常州 213164
有机污染物废水和染料废水是造成当前环境污染最严重的问题之一,自然界降解此类废水的能力有限。如果上述问题长期得不到解决,将不可避免地导致不可挽回的生态破坏,因此解决环境问题是目前最重要的任务之一[1-2]。传统污水处理技术通常稳定性差,有机污染物不能被完全无机化,并可能产生二次污染物[3-4],因而无二次污染的光催化技术受到越来越多的关注[5-7]。光催化技术是指利用太阳能作为能量,使光催化材料被激发而生成光生电子-空穴对,然后通过光生电子-空穴对与有机污染物之间的氧化还原反应将有机物分解为无机物[8-9]。高效稳定的光催化剂的发展是其核心,复合半导体光催化剂降解有机污染物是一项非常有前景的绿色技术[10-11]。
Fujishima等[12]使用TiO2电极作为光催化剂来分解水并同时产生氢和氧,从而为光催化打开了大门。某些特定的金属氧化物半导体材料,例如TiO2和ZnO等[13-14]具有结构稳定、制备成本低和对环境友好的优点,被广泛应用于各种水污染处理过程。但是这些金属氧化物具有较大的宽带隙(Eg为2.7 eV),只能利用日光中的紫外线(约4%),不能利用约43%的可见光,从而降低了太阳能的利用率,大大降低了其应用价值[15]。因此,能够有效利用太阳能的新型光催化材料的开发已经成为研究的热点[16-18]。
钙钛矿型氧化物近年来已成为光催化领域的后起之秀[19-21]。钙钛矿型氧化物大多数具有规则的晶格排列,并且有平行于晶格的条纹,结构稳定[22-23]。作为多元素化合物,在不同原子的相互作用下,化合物中原子的结构和半径会产生一定程度的变化,从而使其具有特殊的理化性质。钨酸铋(Bi2WO6)是典型的钙钛矿型氧化物,是一种具备非金属含氧酸盐结构的新型光催化材料。由于其合适的带隙,相对较高的光稳定性,独特的晶体结构和无毒性,引起了广泛的关注[24-25]。但是纯Bi2WO6具有较宽的带隙(2.70 eV),只能被紫外光或部分可见光激发,光吸收率低并且光生电子-空穴对易于复合,材料的光催化性能降低,不能完全满足预期的要求。为了降低电子-空穴复合率,Bi2WO6复合材料提高光催化性能的研究成为近年来的热点。例如离子掺杂可以改变Bi2WO6的表面性质,扩大光学响应范围[26-27];将不同的材料与Bi2WO6偶联,也是提高Bi2WO6光催化活性的有效方法[28-30]。
金属硫化物是一种具有优异性能的可见光催化剂,它的价带一般由S 3p轨道杂化而成,比O 2p轨道的能级值负一些。相较于氧化物,金属硫化物有较小的带隙能,更容易被可见光所激发,通过复合[31]或掺杂[32-33]等手段可以增强其可见光响应,或通过改变催化剂中各组分的组合方式(如构筑异质结[34],核壳结构[35]等)阻碍其光生电子被空穴吸引。选择恰当半导体材料与金属硫化物进行复合是构筑高效光催化剂的普遍措施之一。当可见光照射时,光生电子从金属硫化物的导带快速跃迁至自身带隙值范围较宽的半导体材料的导带上,有利于阻止光生电子被空穴吸引,促进目标复合催化剂表层上的量子效率的提升;或者基于Z型电荷转移机理,光生电子从半导体的导带转移到金属硫化物的价带与其空穴复合,使得金属硫化物表面富集电子,抑制了空穴对其的氧化能力,而另一半导体表面富集空穴,抑制了电子对其的还原能力,不仅有利于分离空间中的光生电荷,同时抑制了金属硫化物的光腐蚀性。由于金属硫化物优异的光学性能和电性能,表明其也是一类具有巨大研究前景的半导体光催化材料。本研究选择金属硫化物(CoS2)为原料参与反应,通过一步水热法合成具有CoS2/Bi2WO6异质结的光催化剂,CoS2的负载可减小Bi2WO6的带隙能,提高电子-空穴对的有效间隔并促进电荷载流子的传输。考察CoS2/Bi2WO6在亚甲基蓝(MB)降解过程中的光催化性能,并探讨新型CoS2/Bi2WO6复合异质结光催化剂的可能反应机理。
1 实验部分
1.1 光催化剂的制备
将0.006 mol硝酸铋[Bi(NO3)3·5H2O]{或0.004 mol硝酸钴[Co(NO3)2·6H2O]}溶解在60 mL去离子水中,搅拌10 min。然后搅拌下小心加入0.003 mol钨酸钠(Na2WO4·2H2O)或[0.008 mol硫代硫酸钠(Na2S2O3·5H2O)]。搅拌30 min后将所得溶液转移至内衬特氟龙的100 mL不锈钢高压釜中,并在180 ℃下反应24 h。将高压釜自然冷却至室温后通过离心分离得到的白色沉淀物(或黑色沉淀物),用乙醇和去离子水洗涤三遍以上,然后将产物在80 ℃下干燥24 h,得到白色固体样品为纯Bi2WO6(黑色固体样品为纯CoS2)。
CoS2/Bi2WO6异质结催化剂通过类似的水热法合成。将0.006 mol硝酸铋溶解在60 mL去离子水中,搅拌10 min后小心加入0.003 mol钨酸钠。之后将一定量的CoS2加入到混合物中,再搅拌30 min。然后将混合物转移到衬有特氟龙的100 mL不锈钢高压釜中,并在180 ℃下反应24 h。将高压釜自然冷却至室温,通过离心分离得到白色沉淀物用乙醇和去离子水洗涤三遍以上。最后将产物在80 ℃下干燥24 h。合成得到不同CoS2含量的CoS2/Bi2WO6-x复合材料(x为CoS2的质量分数,%)
1.2 光催化剂性能表征
粉末X射线衍射(XRD)是在Shimadzu XRD 6000衍射仪上进行,Cu/Kα辐射,40 kV和30 mA,λ为0.154 06 nm,扫描速度为4 (°)/min,衍射角(2θ)为5°~80°。使用场发射扫描电子显微镜(FESEM,SUPRA55,德国)检查样品的形貌特征。采用X射线光电子能谱仪(XPS)(Escalab 250Xi,美国)检测CoS2/Bi2WO6的化学成分,150 W,Al/Kα辐射。在FS5荧光分光光度计上以320 nm的激发波长进行光致发光光谱(PL)分析。N2吸附-解吸等温线在BET(Brunauer-Emmett-Teller)分析仪(Micromeritic Tri Star II 3020,USA)上测定。紫外-可见光漫射(UV-Vis DRS)分光光度计(Shimadzu UV-3600,日本)测定材料的光吸收性能,使用BaSO4作为参考,在300~800 nm进行测量。
1.3 光催化活性评估
采用室温可见光照射(250 W Xe弧光灯在400 nm处装有紫外线截止滤光片)下MB水溶液光催化降解过程来测量光催化性能。将100 mg制备的CoS2/Bi2WO6异质结光催化剂加到MB浓度为10 mg/L的100 mL水溶液中,黑暗中磁力搅拌60 min充分混合,以达到吸附-解吸平衡,测定上层清液的初始MB浓度(C0,mg/L)。然后打开灯进行光催化反应,定时取约4 mL悬浮液,通过离心(4 500 r/min)10 min除去光催化剂,用分光光度计分析上清液,得到MB(664 nm)的残留浓度Ct(mg/L)。
2 结果与讨论
2.1 光催化剂的表征
2.1.1 晶体结构分析
如图1所示为制备的CoS2/Bi2WO6-0.3%复合材料样品的XRD图谱。可以看出,光催化剂的所有衍射峰均为纯Bi2WO6和CoS2,分别与标准Bi2WO6峰(JCPDS39-256)[25]和CoS2(JCPDS89-1492)[26]相匹配,表明已成功制备了立方钙钛矿结构的Bi2WO6样品。纯Bi2WO6的主要衍射峰出现在28.3°,32.8°,47.1°,55.8°,58.5°,68.7°,76.1°和78.2°,分别对应Bi2WO6的(131),(200),(260),(133),(262),(400),(333),(131)八个晶格面。CoS2的主要特征峰出现在27.9°,32.3°,36.2°,39.8°,46.3°和54.9°,分别对应于CoS2的(111),(200),(210),(211),(220),(311)的晶格面。由于CoS2/Bi2WO6复合材料的XRD图谱与单一CoS2或Bi2WO6物质的图谱相似,说明通过水热法成功合成了CoS2/Bi2WO6复合物。与纯CoS2和Bi2WO6相比,CoS2/Bi2WO6复合材料XRD图谱上显示了所有特征衍射峰,表明CoS2的负载并没有改变原始晶体结构。但是添加CoS2后相对峰强度发生了变化,表明CoS2可以负载到Bi2WO6晶格中,形成CoS2/Bi2WO6异质结。

图1 催化剂样品的XRD图谱Fig.1 XRD patterns of catalyst samples
2.1.2 催化剂微观形貌分析
图2为SEM测定的催化剂样品微观形貌和结构。图2(a)显示纯Bi2WO6的表面粗糙且不规则,为片层状花球型结构。图2(b)显示纯CoS2是由小方形颗粒的聚集形成的。CoS2/Bi2WO6-0.3%的SEM图像见图2(c),可以看到CoS2以团簇状附着于Bi2WO6的片层状结构上。这表明CoS2已紧密附着在Bi2WO6的表面上。这种形态具有大量的中空介孔,大大增加了比表面积,有利于提高催化剂的降解效率。

图2 催化剂样品的SEM图谱Fig.2 SEM images of catalyst samples
2.1.3 化学状态分析
XPS可用于分析CoS2/Bi2WO6异质结中的元素组成和结合状态,催化剂样品的XPS分析结果见图3。图3(a)表明,Bi2WO6和CoS2/Bi2WO6-0.3%的总谱由Bi 4f,W 4f,O 1s,Co 2p和C 1s态的各种结合能组成。图3(b)显示了O 1s的XPS光谱,在Bi2WO6谱线中可以拟合三个峰,其结合能分别为532.17,530.97和530.17 eV,分别对应于材料表面的吸附氧、纯Bi2WO6相中(Bi2O2)2+层和(WO4)2-层的晶格氧。由图3(c)看出,Bi2WO6中的结合能为37.77 eV和35.67 eV,分别对应于W4f7/2和W4f5/2轨道的+6氧化态。而在CoS2/Bi2WO6-0.3%中W 4f的结合能为37.87 eV和35.77 eV,它们也产生相似程度的位移,表明CoS2中的部分电子转移到Bi2WO6上,从而使结合能发生变化。图3(d)是Bi 4f的XPS光谱。由图可见,CoS2/Bi2WO6-0.3%和纯Bi2WO6都有两个对应于Bi2WO6中Bi3+的峰。Bi 4f的两个特征峰的结合能分别为164.67 eV和159.37 eV,分别对应于Bi3+的Bi4f5/2和Bi4f7/2轨道。经过观察比较,CoS2/Bi2WO6-0.3%复合材料的Bi4f峰移至高能区,Bi4f7/2的特征峰移至159.47 eV,而Bi4f5/2也移至高能区,这种现象的出现可以归因于电子从CoS2转移到Bi2WO6。如图3(e)所示,复合材料Co 2p的XPS光谱中有两个特征峰,结合能分别为777.56 eV和792.66 eV,分别对应于Co2p3/2峰和Co2p1/2峰。XPS数据表明成功合成了CoS2/Bi2WO6光催化剂,这与XRD和SEM结果相符合。

图3 催化剂样品的XPS图谱Fig.3 XPS spectra of catalyst samples
2.1.4 多孔结构的确定
催化剂样品的N2吸附-脱附结果如图4所示。从图4可以看出,所有样品的等温线都表现出IV型等温线和H3磁滞回线的特征。从图4(a)可以看出,纯Bi2WO6具有典型的IV型等温曲线,H3型磁滞回线表明存在介孔结构,磁滞回线向相对压力(P/P0)约为1处移动,这表明存在大于50 nm的孔径,这由测得的孔径分布确认(见图5)。加载CoS2后,复合材料仍保持IV等温曲线并保持磁滞回线,表明该材料仍具有介孔结构。根据比表面积数据的分析,纯Bi2WO6的比表面积为13.4 m2/g,平均孔径为168.4 nm。CoS2/Bi2WO6-0.3%复合材料的比表面积为15.0 m2/g,平均孔径为155.0 nm。结果表明,CoS2/Bi2WO6-0.3%复合物的比表面积大于Bi2WO6的比表面积,可以提供更多的活性位点并加快反应速度,提高溶液中目标污染物的降解率。该结果可归因于CoS2/Bi2WO6的三维花状结构和Bi2WO6较大的BET值。而较小的孔径意味着更多的孔,而广泛分布的孔洞可以扩大表面积。

图4 催化剂样品的N2吸附-脱附等温线Fig.4 N2 adsorption desorption isotherms of catalyst samples

图5 催化剂样品的孔体积分布Fig.5 Pore volume distribution of catalyst samples
2.1.5 PL光谱分析
光致发光是物质吸收光子并发射光子的过程。如果该材料产生光生电子-空穴对,则光致发光信号将减弱,可以反映电子-空穴对的分离程度。较低的PL峰强度表示较低的电荷载流子复合率,意味着较高的光催化效率。图6所示为激发波长320 nm时催化剂样品的PL光谱。由图6可以看到,CoS2/Bi2WO6-0.3%复合材料的峰形与纯Bi2WO6的峰形基本相同,但是峰强度明显降低,这表明在Bi2WO6上掺杂CoS2有效地抑制了光生电子和空穴的结合。通过将CoS2负载在Bi2WO6上来构建CoS2/Bi2WO6异质结,降低电子和空穴的结合概率,而能带的差异引起了复合材料两侧之间的电势差,从而造成大量的光生载流子转移至催化剂表面,加速俘获氧气和氢氧根形成超氧自由基和羟基自由基,提高催化剂光催化性能。
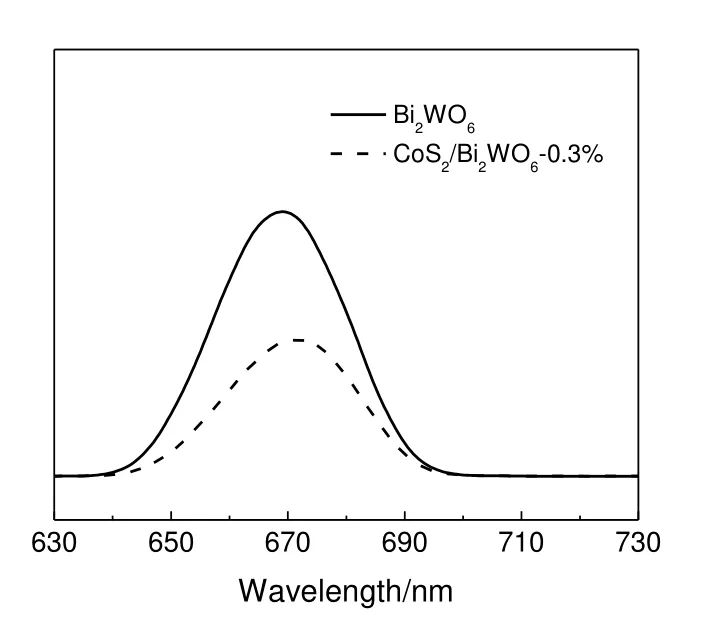
图6 催化剂样品的的PL光谱Fig.6 PL spectra of catalyst samples
2.1.6 光吸收性能
通过UV-Vis漫反射光谱研究了CoS2含量对复合材料光吸收性能的影响,结果如图7(a)所示。从图中可以看出,与纯Bi2WO6相比,复合材料的光吸收波长在480 nm左右出现红移。随着CoS2含量的增加,光吸收波长逐步增大。带隙能的值可通过以下公式(2)估算:

式中:α是吸收系数,A是常数,h是普朗克常数,ν是光频率,Eg是能带能量,n与过渡类型有关[36-37]。样品的带隙能可以通过图7(b)来显示(当纵坐标为0时,k1和k2为带隙值)。通过图7(b)估算得纯Bi2WO6的带隙值约为2.92 eV,而CoS2/Bi2WO6-x复合材料中的Eg值最小的是CoS2/Bi2WO6-0.3%,为2.58 eV。因此,添加CoS2可以有效地减少复合材料的带隙,扩大了光吸收范围。

图7 不同CoS2含量(x)的CoS2/Bi2WO6-x复合材料的紫外可见漫反射光谱Fig.7 UV-vis diffuses reflectance spectra of CoS2/Bi2WO6-x with different x
2.2 光催化活性
通过在可见光下降解有机染料MB来评估CoS2/Bi2WO6-x异质结的光催化活性,结果如图8所示。由图8可见,纯CoS2的降解效率最低,仅为20%左右。纯Bi2WO6的降解效率约为70%,具有一定的催化活性但性能却不高,这可能是由于Bi2WO6的带隙较小所致。然而,CoS2/Bi2WO6-x复合材料的光催化降解效率得到了显著提高,当负载量为0.3%时,降解效率最高,在60 min的暗反应和120 min的可见光照射下,MB的降解率达到97.71%。此外,负载量为0.1%和0.5%的CoS2/Bi2WO6复合材料的光催化活性也较高,反应120 min后MB的降解率均可达到约90%。

图8 不同催化剂样品降解MB的性能Fig.8 Degradation performances of MB by different catalyst samples
从图8可以看出,随着负载量的增加,不同复合材料的降解效率呈现出先提高后降低的趋势。原因可能是当CoS2的量少时,复合材料的活性位点不足,转移到催化剂表面的光生电子-空穴对少,捕获自由基的能力弱。当CoS2的负载量较大时,CoS2沉积并聚集在Bi2WO6的表面上,并且在表面上发生堆积现象,从而减小了催化剂的比表面积。同时,太多的氧空位充当光生电子与光生空穴之间的复合中心,从而抑制了光生载流子的转移并降低了光催化性能。
将图8所示的MB降解反应实验数据用一级反应动力学方程进行拟合:ln (C0Ct)=kt,得到如图9所示的结果。可以看到,所有催化剂下的对数浓度比与时间呈现线性关系,说明本催化降解过程符合一级动力学关系。曲线的斜率即为MB一级降解反应速率常数k,结果列于表1。可以看到,CoS2/Bi2WO6-0.3%催化MB降解的速率常数远大于其它催化剂的速率常数,甚至是纯Bi2WO6催化剂速率常数的2.36倍。

图9 MB一级降解反应动力学拟合Fig.9 Kinetic fitting of first-order degradation of MB
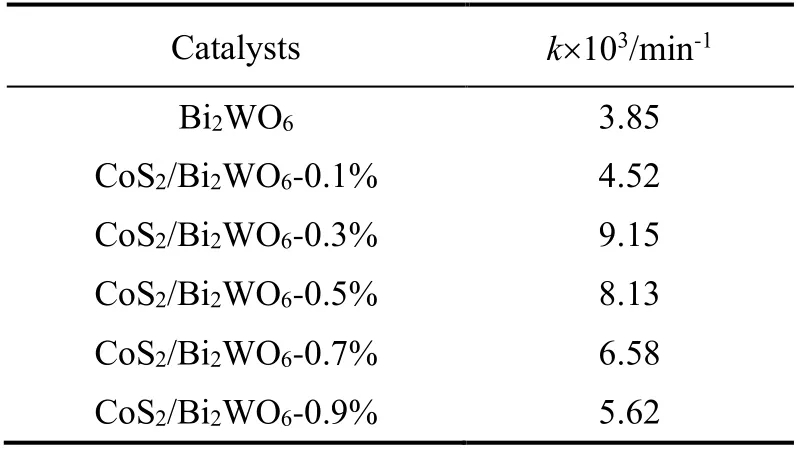
表1 光催化MB降解反应速率常数Table 1 Rate constants of MB photocatalytic degradation
2.3 光催化剂的稳定性
光催化剂的稳定性和可重复使用性在实际应用中也起着重要作用。将所制备的CoS2/Bi2WO6-0.3%样品重复催化MB光降解实验四次,结果如图10所示。从图10可以看出,经过四个循环实验,降解率略有下降,但总体保持在90%以上。实验结果表明,所制备的光催化剂具有很强的光催化活性和光稳定性,显示出良好的催化能力,可以循环使用多次。

图10 CoS2/Bi2WO6-0.3%催化剂的光催化稳定性Fig.10 Degradation performances of MB by re-used CoS2/Bi2WO6-0.3%
2.4 CoS2/Bi2WO6光催化机理初探
为了更好地探索CoS2/Bi2WO6光催化的机理,在降解过程中,选择几种活性物质清除剂,在N2饱和条件下对三种主要活性物质·h+,·OH和·O2-进行自由基捕获实验[38-39],结果见图11。从图11可以看出,添加乙二胺四乙酸二钠(EDTA-2Na)对MB的降解表现出相当大的抑制作用,这表明·h+可能是主要的活性物质。而添加TBA时降解率并未降低,表明·OH不是主要活性物质[40]。此外,连续不断通入N2到溶液中排除O2,其目的是防止光生电子和溶解氧形成·O2-自由基,这可能是降解速率降低的原因,这表明·O2-也是活性物质之一[41]。

图11 带活性物质清除剂的CoS2/Bi2WO6-0.3%催化MB光降解结果Fig.11 Photo-degradation of MB by CoS2/Bi2WO6-0.3%with active species scavengers
Bi2WO6和CoS2的能带值是通过以下经验方程理论计算的[42]:

式中:EVB是价带电势,ECB是导带电势;EC是氢标度上的自由电子能量,其值为4.5 eV;Eg是复合材料的带隙能量;X是半导体的绝对电负性[43]。CoS2和Bi2WO6的X值分别为5.31 eV和6.36 eV,CoS2和Bi2WO6的带隙能分别为1.8 eV和2.58 eV。因此,Bi2WO6的ECB值和EVB值分别为0.57 eV和3.15 eV,经计算,CoS2的ECB值和EVB值分别为0.09 eV和1.89 eV。很明显,Bi2WO6的ECB和EVB值均高于CoS2,这意味着用CoS2修饰Bi2WO6有助于有效分离光生电荷载流子。
光催化降解MB的可能反应机理如图12所示。从上面的数据可以看出,由于CoS2的带隙很小,因此在可见光照射下很容易被激发,导致产生光生电子和空穴。由于CoS2的CB值(ECB=0.09eV)低于Bi2WO6,因此可见光激发的电子可以轻松迁移到Bi2WO6。因此光生电子和空穴被有效地分离,这有利于抑制Bi2WO6表面上电子和空穴的复合。此外,大量e-和h+可用于产生活性自由基,例如·OH和·O2-。出现这种现象的原因是,e-可以被表面吸附的O2捕获,生成具有强氧化性的·O2-,并且—OH基团可以捕获光生h+形成反应性·OH自由基。最终,有机污染物MB被生成的·OH强氧化剂有效地分解。因此,与纯Bi2WO6相比,将CoS2掺杂到Bi2WO6中形成p-n异质结有利于拓宽可见光的吸收范围并降低带隙能量,最终提高光催化效率。
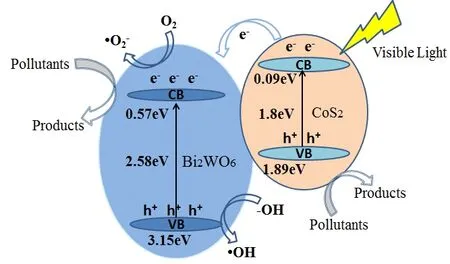
图12 可见光照射下CoS2/Bi2WO6光催化剂上电荷转移过程的机理Fig.12 Mechanism of charge transfer process over CoS2/Bi2WO6 photocatalyst under visible light irradiation
3 结 论
采用一步水热法成功合成了具有异质结结构的CoS2/Bi2WO6复合光催化剂,并将其用于降解有机污染物MB。CoS2成功地负载在Bi2WO6的表面上形成CoS2/Bi2WO6异质结,促进了光生电子和空穴的分离,扩大了光吸收范围,并提高了复合催化剂在可见光下的光催化活性。CoS2的最佳负载量为0.3%,反应180 min后MB降解率达到97.1%。自由基捕获实验证明,在光降解过程中起关键作用的活性物质是·h+和·O2-,而不是·OH。合成的CoS2/Bi2WO6复合材料是一种新型的具有高催化效率的光催化剂。

