右美托咪定对脑缺血再灌注损伤小鼠糖萼的影响
马海波 杨迎春 刘晶晶 穆东亮 夏瑞

[摘要] 目的 探讨右美托咪定对脑缺血再灌注损伤小鼠糖萼的影响。 方法 将C57BL6/J雄性成年小鼠45只按随机数字表法分为假手术组、生理盐水组和右美托咪定组,每组各15只。假手术组仅切开右侧颈部皮肤,暴露右侧颈总动脉。右美托咪定组为造模前30 min,腹腔注射右美托咪定40 μg/kg,然后建立缺血60 min再灌注24 h后急性脑缺血再灌注损伤模型。生理盐水组为造模前30 min,腹腔注射等容量生理盐水,然后建立缺血60 min再灌注24 h后急性脑缺血再灌注损伤模型。采用TTC染色法计算脑梗死体积百分比;采用酶联免疫吸附法(ELISA)检测肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)表达;采用ELISA检测氧化应激相关蛋白[丙二醛(MDA)、超氧化物歧化酶(SOD)]表达。 结果 与生理盐水组比较,右美托咪定组的脑梗死体积显著减小,神经功能缺损评分显著降低,差异有统计学意义(P < 0.05或P < 0.01)。与生理盐水组比较,右美托咪定组的活动时间和活动距离显著延长,差异有统计学意义(P < 0.05或P < 0.01)。与生理盐水组比较,右美托咪定组的HPSE/β-actin、TNF-α/β-actin、NF-κB/β-actin水平均显著降低,SDC-1/β-actin、Tie-2/β-actin水平均显著升高,差异有高度统计学意义(P < 0.01)。与生理盐水组比较,右美托咪定组的TNF-α和IL-6水平均显著降低,差异有高度统计学意义(P < 0.01)。与生理盐水组比较,右美托咪定组的MDA水平显著降低,SOD水平显著升高,差异有高度统计学意义(P < 0.01)。 結论 右美托咪定对脑缺血再灌注损伤糖萼具有良好的保护作用,且具有脑保护作用,可减轻炎症和应激反应。
[关键词] 右美托咪定;脑缺血再灌注损伤;糖萼;炎性因子;氧化应激
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0008-06
Effect of Dexmedetomidine on glycocalyx in mice with cerebral ischemia-reperfusion injury
MA Haibo1 YANG Yingchun2 LIU Jingjing3 MU Dongliang4 XIA Rui5▲
1.School of Medicine, Yangtze University, Hubei Province, Jingzhou 434023, China; 2.Department of Anesthesiology, Beijing Fengtai Hospital, Beijing 100071, China; 3.Department of Anesthesiology, Beijing Armed Police Corps Hospital, Beijing 100027, China; 4.Department of Anesthesiology, the First Hospital of Peking University, Beijing 100034, China; 5.Department of Anesthesiology, the First Hospital of Yangtze University, Hubei Province, Jingzhou 434000, China
[Abstract] Objective To investigate the effect of Dexmedetomidine on glycocalyx in mice with cerebral ischemia-reperfusion injury. Methods Forty-five C57BL6/J male adult mice were randomly divided into sham operation group, normal saline group and Dexmedetomidine group, with 15 mice in each group. In sham operation group, only the skin of the right neck was cut and the right common carotid artery was exposed. In Dexmedetomidine group, 40 μg/kg Dexmedetomidine was injected intraperitoneally 30 minutes before the establishment of the model. The mice in normal saline group were injected with equal volume of normal saline 30 minutes before modeling, and then acute cerebral ischemia-reperfusion injury model was established 24 hours after 60 minutes of ischemia-reperfusion. The percentage of infarct volume was calculated by TTC staining, the expression of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were detected by enzyme-linked immunosorbent assay (ELISA), and the expression of oxidative stress-related proteins (malondialdehyde [MDA], superoxide dismutase [SOD]) were detected by ELISA. Results Compared with normal saline group, the infarct volume and neurological deficit score of Dexmedetomidine group were significantly reduced, the differences were statistically significant (P < 0.05). Compared with normal saline group, the activity time and distance of Dexmedetomidine group were significantly lengthened, the differences were statistically significant (P < 0.05 or P < 0.01). Compared with normal saline group, the levels of HPSE/β-actin, TNF-α/β-actin and NF-κB/β-actin in Dexmedetomidine group were significantly decreased, and the levels of SDC-1/β-actin and Tie-2/β-actin in Dexmedetomidine group were significantly increased, the differences were highly statistically significant (P < 0.01). Compared with normal saline group, the levels of TNF-α and IL-6 in Dexmedetomidine group were significantly reduced, the differences were highly statistically significant (P < 0.01). Compared with normal saline group, MDA level of Dexmedetomidine group was significantly decreased, and SOD level of Dexmedetomidine group was significantly increased, the differences were highly statistically significant (P < 0.01). Conclusion Dexmedetomidine can protect glycocalyx from cerebral ischemia-reperfusion injury, reduce inflammation and stress response.
[Key words] Dexmedetomidine; Cerebral ischemia-reperfusion injury; Glycocalyx; Inflammatory factors; Oxidative stress
缺血性脑卒中占脑卒中的大多数,具有较高致残率和致死率[1-2]。当出现缺血性脑卒中时,脑组织细胞在缺血缺氧后恢复血液灌注,从而导致组织损伤或功能障碍,其功能并未减轻或恢复,反而加重,称为脑缺血再灌注损伤[3-4]。随着我国老龄化社会的到来以及医学技术的进步,外科手术的复杂性和难度逐步提高,使围术期脑缺血再灌注损伤成为麻醉医师关注的热点和难点[5-6]。近年来,发现脑血管内皮细胞糖萼成为研究脑缺血再灌注损伤的一个新方向,并且能够作为脑损伤程度评估的新的生物标志物之一,还能够作为靶点预防以及治疗围术期脑缺血再灌注损伤[7]。右美托咪定是一种新型辅助麻醉药物,其能够通过与肾上腺素受体结合发挥镇痛作用,且证实其具有脑保护作用[8-9]。本研究旨在探討右美托咪定对脑缺血再灌注损伤小鼠糖萼的影响。
1 材料与方法
1.1 实验动物
C57BL6/J雄性成年小鼠45只,SPF级,8~12周龄,体重25~30 g。小鼠被安置在无菌环境中的(25±2)℃,湿度(55±5)%,12 h的光照循环,实验前至少7 d由专业动物员饲养,实验小鼠购自湖北省疾病预防控制中心[动物合格证号:NO.42000600034352;许可证号:SYXK(鄂)2009-0027],饲养于长江大学医学部动物实验中心,所有实验方案经过长江大学医学伦理委员会同意,实验过程遵循《实验动物福利伦理审查指南》。
1.2 主要试药
乙酰肝素酶(HPSE)、多配体聚糖-1(SDC-1)、血管生成素受体-2(Tie-2)、肿瘤坏死因子-α(TNF-α)、核因子κB(NF-κB)抗体均购自美国CST公司(#14669S、#12922S、#4224S、#3707S、#8242S),RIPA裂解液及BCA蛋白定量试剂盒购自碧云天生物科技公司,TNF-α及白介素-6(IL-6)试剂盒购自武汉赛维尔生物科技有限公司,丙二醛(MDA)及超氧化物歧化酶(SOD)试剂盒购自上海晶抗生物有限公司,盐酸右美托咪定购自江苏恒瑞医药股份有限公司。
1.3 实验方法
1.3.1 实验分组及处理方法 按照随机数字表法将小鼠分为假手术组、生理盐水组和右美托咪定组,各15只。生理盐水组与右美托咪定组建立缺血60 min再灌注24 h急性脑缺血再灌注损伤模型。假手术组仅切开右侧颈部皮肤,暴露右侧颈总动脉。右美托咪定组为造模前30 min,腹腔注射右美托咪定40 μg/kg。生理盐水组为造模前30 min,腹腔注射等容量生理盐水。
1.3.2 脑缺血模型制备 术前8 h禁食,允许进水。3%异氟醚吸入麻醉,取仰卧位,颈部备皮消毒后,于小鼠颈部正中切口,且对组织进行逐层钝性分离,右侧迷走神经和颈总动脉充分暴露且小心分泌,以及尽可能避免损伤迷走神经,再向上分离至右侧颈总动脉Y型分叉处。小鼠右侧颈外动脉与右侧颈总动脉近心端分别应用丝线缝扎,小动脉夹夹闭右侧颈内动脉。于颈总动脉近心端剪一破口,再将线栓于小鼠右侧破口处插入,轻轻插入右侧颈内动脉,插入9 mm左右,线栓妥善固定。阻塞60 min后将线栓拔出恢复灌注,缝合伤口。模型成功标准:小鼠清醒后出现损伤对侧肢体瘫痪以及站立不稳,并且提尾时向损伤对侧旋转为其成功标准。
1.3.3 神经功能缺损评分及行为学实验 神经功能缺损评分采用Longa评分法,由双盲观察者与再灌注24 h后进行评定。从0~4分细分5个等级,0分为正常,无明显神经功能缺失,4分最为严重,小鼠无法自发行走或有意识障碍。以Homecage监测系统评价脑缺血再灌注24 h后于30 min内小鼠自发活动时间与活动距离。
1.3.4 血清和脑组织标本采集 24 h后再次麻醉,16号钝性针头插入心脏至主动脉根部,血管钳固定针头取血,每只小鼠采血量4~5 mL,常温静置30 min后,离心4000 r/min×10 min,离心半径10 cm,分离血清,-80℃下储存。再用生理盐水50 mL迅速灌注,见肝脏变白,立即断头取脑,冰上取脑组织,-80℃下储存。
1.4 观察指标
1.4.1 各组小鼠脑梗死体积变化 切除小脑和脑干然后以冠状面均匀切片,切片层厚为2 mm,以新鲜配制的1.5%TTC染色。Image J 图像处理软件计算脑梗死体积百分比。
1.4.2 各组小鼠糖萼损伤情况 Western blot检测SDC-1、HPSE、Tie-2表达。取“1.3.4”项下脑组织标本,加入0.8 mL细胞裂解液中,放置于低温条件下超声匀浆,离心,取上清液,于-20℃保存备用。采用BCA法检测各组蛋白含量。样品中加入上样缓冲液,充分混匀后于95℃变性处理5 min。上样,以β-actin作为内参,按0.1 mL/cm2加入一抗溶液,于4℃下过夜。加入二抗孵育1 h,采用Western blot检测蛋白表达灰度值。
1.4.3 各组小鼠炎性因子表达 取“1.3.4”项下血清标本,采用酶联免疫吸附测定(ELISA)法检测TNF-α和IL-6表达。
1.4.4 各组小鼠氧化应激相关蛋白表达 取“1.3.4”项下血清标本,采用ELISA检测MDA、SOD表达。
1.5 统计学方法
采用Graphpad Prism 8对实验数据进行分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用Tukey′s检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠脑缺血再灌注損伤后梗死体积、神经功能缺损评分及行为学实验结果比较
与生理盐水组比较,右美托咪定组的脑梗死体积显著减小,神经功能缺损评分显著降低,差异有统计学意义(P < 0.05或P < 0.01)。与生理盐水组比较,右美托咪定组的活动时间和活动距离显著延长,差异有统计学意义(P < 0.05或P < 0.01)。见图1。
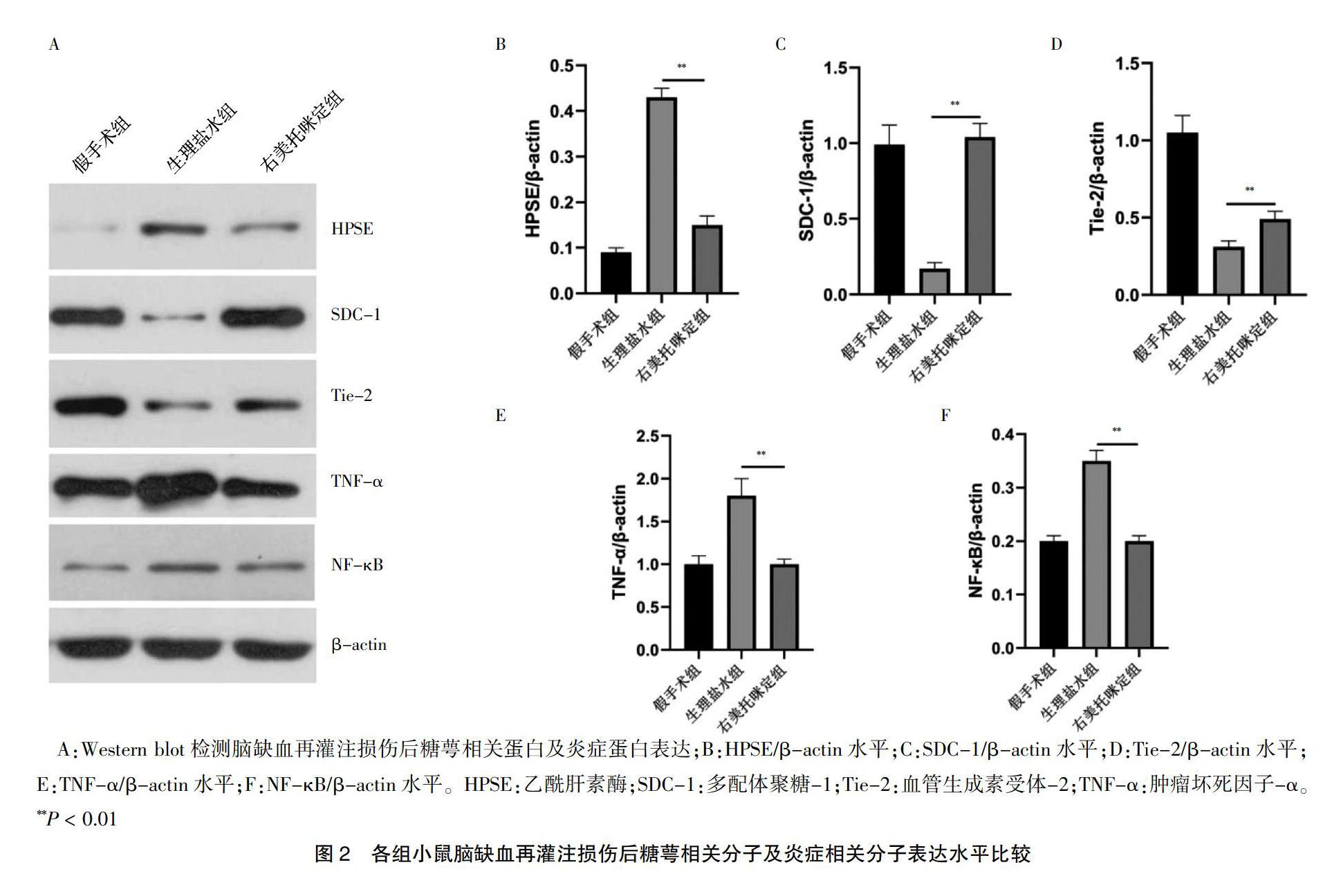
2.2 各组小鼠脑缺血再灌注损伤后糖萼相关分子及炎症相关分子表达水平比较
与生理盐水组比较,右美托咪定组的HPSE/β-actin、TNF-α/β-actin、NF-κB/β-actin水平均显著降低,SDC-1/β-actin、Tie-2/β-actin水平均显著升高,差异有高度统计学意义(P < 0.01)。见图2。
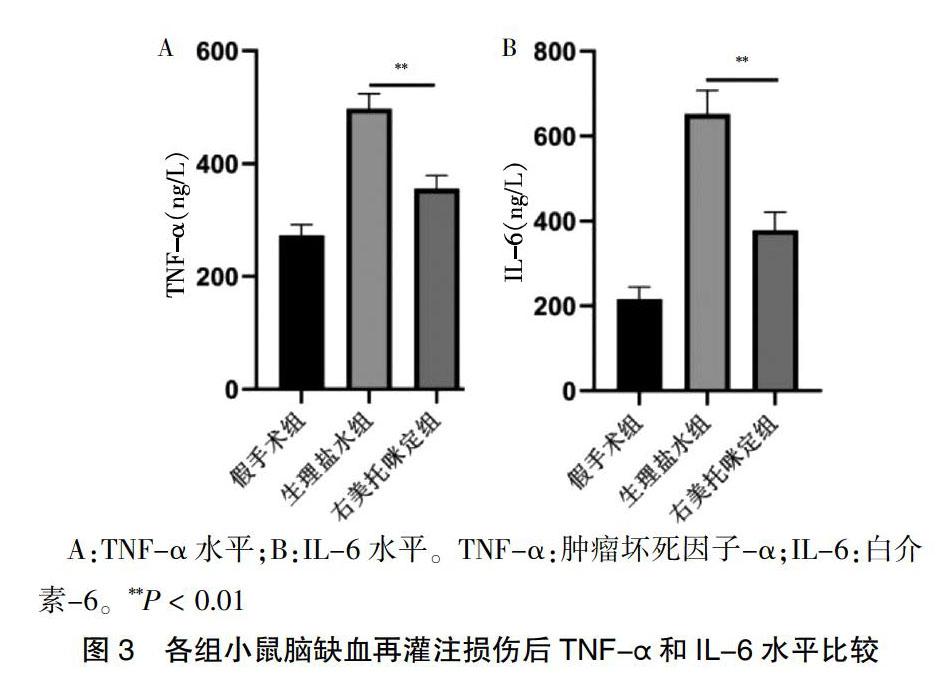
2.3 各组小鼠脑缺血再灌注损伤后TNF-α和IL-6水平比较
与生理盐水组比较,右美托咪定组的TNF-α和IL-6水平均显著降低,差异有高度统计学意义(P < 0.01)。见图3。
A:TNF-α水平;B:IL-6水平。TNF-α:肿瘤坏死因子-α;IL-6:白介素-6。**P < 0.01
2.4 各组小鼠脑缺血再灌注损伤后氧化应激相关蛋白表达水平比较
与生理盐水组比较,右美托咪定组的MDA水平显著降低,SOD水平显著升高,差异有高度统计学意义(P < 0.01)。见图4。
3 讨论
右美托咪定是在手术室和重症监护室中广泛使用的一种新型、高效、高选择性α2-肾上腺素能受体激动剂[10-11]。右美托咪定几乎不引起呼吸抑制,可安全用于机械通气和自主呼吸患者[12]。右美托咪定的脑保护作用已经过临床验证,然而其机制尚不清楚。右美托咪定保护脑功能的机制是复杂的[13]。研究表明,右美托咪定可能通过抑制氧化应激和炎性反应,减轻大鼠脑缺血再灌注损伤[14]。另有研究表明,右美托咪定可减少炎症介质和神经内分泌激素的释放,维持颅内匀浆平衡,减轻缺血性脑损伤,具有脑保护作用[15]。有文献报道,右美托咪定能够抑制神经元自噬,保护鼠脑免于缺血再灌注损伤[16]。研究发现,右美托咪定通过抑制TLR4信号通路减轻新生儿大鼠脑缺血再灌注损伤[17]。
脑血管内皮细胞被一层糖萼分子层所覆盖,因含有硫酸化的糖胺聚糖侧链而带有负电荷,从而调节血管渗透性[18]。脑内皮糖萼作为内皮细胞的表面结构,阻隔了血小板、白细胞与血管内皮的的黏附分子接触,通过结合糖胺聚糖可减少白细胞激活,减轻脑缺血再灌注损伤。HPSE抑制剂通过抑制内皮糖萼的降解,可减少内生HPSE、炎性坏死因子和促纤维化因子的表达,从而减轻脑缺血再灌注损伤。缺血再灌注损伤容易导致内皮糖萼的脱落,而内皮细胞的激活和内皮糖萼的脱落大大增加了缺血再灌注损伤中免疫反应、血栓形成和组织损伤的风险[19]。因此,脑血管内皮糖萼在围术期脑缺血再灌注损伤的预防、治疗和改善预后均有重要意义。而右美托咪定在脑缺血再灌注损伤中是否对内皮糖萼有保护作用尚不清楚。血管生成素-1(Ang-1)/Tie-2系统在血管完整性和稳定性中起重要作用。研究报道显示,鞘内注射右美托咪定可以通过抑制缺血再灌注引起的金属蛋白酶(可降解糖萼成分)释放,增加Ang-1/Tie-2系统活性,从而保护血脊髓屏障不受缺血再灌注损伤[20]。
NF-κB及TNF-α作为重要的炎性蛋白,在脑卒中后的炎性反应中起着非常重要的作用[21-22]。炎性因子在脑缺血再灌注损伤中发挥着重要作用,脑缺血后神经元可发生坏死,释放炎性介质,影响脑损伤的转归。其中TNF-α及IL-6作为重要的炎症蛋白,在脑缺血再灌注的炎性反应中起着非常重要的作用[21-22]。
MDA含量是反映机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度。SOD是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分。MDA和SOD作为重要的氧化应激指标在脑缺血再灌注损伤中有重要意义。
综上所述,右美托咪定对脑缺血再灌注损伤糖萼具有良好的保护作用,且具有脑保护作用,减轻炎症和应激反应。但本研究仍存在一些不足之处,观察小鼠相对较少,未观测糖萼脱落的其他相关指标,观察机制相对较少,因经费原因,未设置糖萼基因敲除对照组,还需在后续作多中心、多样本深入研究,提供可靠的参考价值。
[参考文献]
[1] Zhai ZY,Feng J. Constraint-induced movement therapy enhances angiogenesis and neurogenesis after cerebral ischemia/reperfusion [J]. Neural Regen Res,2019,14(10):1743-1754.
[2] Bu J,Shi S,Wang HQ,et al. Acacetin protects against cerebral ischemia-reperfusion injury via the NLRP3 signaling pathway [J]. Neural Regen Res,2019,14(4):605-612.
[3] 闵冬雨,李红岩,关乐,等.脑心清对脑缺血再灌注损伤模型大鼠的保护机制[J].中国组织工程研究,2020,24(2):215-222.
[4] Wang Y,Luo J,Li SY. Nano-curcumin simultaneously protects the blood-brain barrier and reduces m1 microglial activation during cerebral ischemia-reperfusion injury [J]. ACS Appl Mater Interfaces,2019,11(4):3763-3770.
[5] 杨翠娥,王慧.银杏黄酮對脑缺血再灌注损伤大鼠脑组织的保护作用[J].卒中与神经疾病,2019,26(6):660-663.
[6] Feng J,Chen X,Guan B,et al. Inhibition of peroxynitrite-induced mitophagy activation attenuates cerebral ischemia-reperfusion injury [J]. Mol Neurobiol,2018,55(8):6369-6386.
[7] 沈俊逸,赵智明,刘春丽,等.人参皂苷对大鼠脑血管内皮细胞MEG3表达的干预作用及促进血管新生的研究[J].中华中医药杂志,2019,34(8):3418-3421.
[8] 李郑琛,贾英萍,王媛,等.右美托咪定后处理对大鼠脑缺血再灌注损伤组织的保护作用[J].郑州大学学报:医学版,2019,54(3):439-442.
[9] 宋文英,郑伟,宋宇龙,等.右美托咪定对脑缺血再灌注损伤大鼠认知功能及神经功能的保护作用研究[J].临床和实验医学杂志,2019,18(1):18-21.
[10] 许位,石秋艳,孙原,等.亚低温联合右美托咪定对大鼠脑缺血再灌注损伤的保护作用[J].贵州医药,2018,42(8):934-937.
[11] 邢娜,李平乐,张建文,等.右美托咪定对脑缺血再灌注损伤大鼠神经的保护作用及机制[J].中国老年学杂志,2018,38(12):3011-3015.
[12] 林生,周广利,傅志俭.右美托咪定预先给药对大鼠局灶性脑缺血再灌注时谷氨酸和γ-氨基丁酸含量的影响[J].中华麻醉学杂志,2018,38(7):886-888.
[13] 曹立梅,李强,董智强,等.右美托咪定后处理对大鼠局灶性脑缺血-再灌注损伤的保护作用及机制研究[J].河北医学,2018,24(5):705-711.
[14] 薄立军,于沛霞,黄立宁,等.右美托咪定对脑缺血缺氧新生大鼠神经功能的影响[J].河北医科大学学报,2017, 38(9):1068-1071.
[15] 徐璐丹,樊腾,张红伟,等.不同剂量右美托咪定预处理对大鼠局灶性脑缺血再灌注损伤的影响[J].南京医科大学学报:自然科学版,2018,38(7):973-977.
[16] 方洁.不同剂量右美托咪定对大鼠脑缺血再灌注损伤脑组织TNF-α、IL-1β及ICAM-1表达的影响[J].中国老年学杂志,2018,38(3):713-715.
[17] 兰琛,曹江北.右美托咪定对大鼠局灶性脑缺血-再灌注损伤后抗氧化能力的影响[J].临床麻醉学杂志,2016,32(5):488-490.
[18] 吴从印,陈娟,冯光球,等.老年缺血性脑血管病患者血管内皮细胞功能指标与沉默信息调节因子1的相关性分析[J].中国医药,2019,14(4):549-552.
[19] 王良芳,陈志武.低氧损伤下调大鼠脑血管内皮细胞中硫化氢及其介导的Rho A-ROCK通路激活[J].安徽医科大学学报,2019,54(1):50-55.
[20] Fang B,Li XQ,Bi B,et al. Dexmedetomidine attenuates blood-spinal cord barrier disruption induced by spinal cord ischemia reperfusion injury in rats [J]. Cell Physiol Biochem,2015,36(1):373-383.
[21] Jin R,Yang G,Li G. Inflammatory mechanisms in ischemic stroke:role of inflammatory cells [J]. J Leukoc Biol,2010,87(5):779-789.
[22] Schilling M,Besselmann M,Muller M,et al. Predominant phagocytic activity of resident microglia over hematogenous macrophages following transient focal cerebral ischemia:an investigation using green fluorescent protein transgenic bone marrow chimeric mice [J]. Exp Neurol,2005,196(2):290-297.
(收稿日期:2020-01-10 本文编辑:李亚聪)

