白热斯丸对氢醌致C57BL/6小鼠白癜风模型的治疗作用及机制研究
热沙拉提·依孜则 马丽 马福昌 霍仕霞 斯拉甫·艾白 李治建

[摘要] 目的 探討白热斯丸对皮肤外涂氢醌建立脱色C57BL/6小鼠白癜风模型的治疗作用,为白热斯丸的临床前研究提供实验支持。 方法 采用氢醌软膏外涂皮肤复制C57BL/6小鼠白癜风模型:C57BL/6小鼠,SPF级,32只,雌雄各半,检疫合格后用2.5%氢醌软膏外涂皮肤连续造模20 d。造模动物皮肤均出现白斑,根据随机数字表按皮肤白斑大小分组,分为空白对照组、模型对照组、白癜风胶囊组、白热斯丸治疗组,每组8只,雌雄各半。空白对照组与模型对照组按20 mL/kg给予等体积溶媒,其他各组给予相应药液,1次/d,连续30 d。隔天肉眼观察毛发脱色及脱色面积并拍照。治疗结束后摘眼球取血,分离血清采用酶联免疫吸附实验(ELISA)法测定酪氨酸酶含量。取皮肤进行苏木精-伊红(HE)染色法对含黑色素的毛囊进行计数。 结果 四组有黑色素的毛囊数所占比例、毛发脱色评分、血清酪氨酸酶含量比较,差异均有统计学意义(均P < 0.05);与空白对照组比较,模型对照组有黑色素的毛囊数所占比例、血清酪氨酸酶含量降低,毛发脱色评分增大,差异均有统计学意义(P < 0.05或P < 0.01);与空白对照组比较,白癜风胶囊组和白热斯丸治疗组有黑色素毛囊数所占比例减小,毛发脱色评分增大,差异均有高度有统计学意义(均P < 0.01),但两组血清酪氨酸酶含量与空白对照组比较差异无统计学意义(P > 0.05);与模型对照组比较,白癜风胶囊组和白热斯丸治疗组有黑色素的毛囊数所占比例、血清酪氨酸酶含量增大,毛发脱色评分减小,差异均有统计学意义(P < 0.05或P < 0.01)。白热斯丸治疗组有黑色素毛囊数所占比例、毛发脱色评分、血清酪氨酸酶含量与白癜风胶囊组比较,差异无统计学意义(P > 0.05)。 结论 白热斯丸能够促进酪氨酸酶含量增加,促进有活性的黑素细胞增生,从而促进黑素的生成,毛发脱色评分也明显降低,对C57BL/6小鼠白癜风模型有较好的治疗作用,并可能与白癜风胶囊有同样的治疗作用。
[关键词] 白癜风;C57BL/6小鼠模型;氢醌;维吾尔医
[中图分类号] R29 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0018-04
Study on the therapeutic effect and mechanism of Bairesi Pills on vitiligo model induced by hydroquinone in C57BL/6 mice
Reshalati·Yizize1 MA Li2 MA Fuchang2 HUO Shixia2 Silafu·Aibai2 LI Zhijian2
1.School of Traditional Uighur Medical, Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830011, China; 2.Department of Toxicology Laboratory, Xinjiang Institute of Traditional Uyghur Medicine, Xinjiang Uygur Autonomous Region, Urumqi 830049, China
[Abstract] Objective To investigate the therapeutic effect of Bairesi Pills on the skin coated with hydroquinone to establish a decolorized model of vitiligo in C57BL/6 mice, so as to provide experimental support for the preclinical study of Bairesi Pill. Methods The model of vitiligo in C57BL/6 mice was established by applying hydroquinone ointment on the skin: C57BL/6 mice, SPF level, 32 mice, male and female half. After passing quarantine, 2.5% hydroquinone ointment was applied on the skin for 20 days. All the model animals had vitiligo on their skin. According to the random number table of the size of vitiligo, the model animals were divided into the blank control group, the model control group, the Vitiligo Capsules group, and the Bairesi Pills treatment group, with 8 patients in each group, half male and half female. The blank control group and the model control group were given equal volume solvent according to 20 mL/kg, and the other groups were given corresponding solution once a day for 30 consecutive days. On the next day, the decolorization and decolorization area of the hair were observed and photographed. After the treatment, the eyeballs were collected and the blood was collected. The serum was isolated and the tyrosinase content was determined by enzyme-linked immunosorbent assay (ELISA). The hair follicles containing melanin were counted by hematoxylin-eosin (HE) staining in skin. Results There were statistically significant differences in the proportion of hair follicles, hair decolorization score and serum tyrosinase content in the four groups (all P < 0.05). Compared with the blank control group, the proportion of melanin hair follicles and the serum tyrosinase content in the model control group decreased, and the hair decolorization score increased, with statistically significant differences (P < 0.05 or P < 0.01). Compared with the blank control group, the proportion of melanin hair follicles in the Vitiligo Capsules group and the Bairesi Pills treatment group decreased, and the hair decoloration score increased, the differences were highly statistically significant (all P < 0.01), but there was no statistically significant difference in the serum tyrosinase content between the two groups compared with the blank control group (P > 0.05). Compared with the model control group, the proportion of melanin hair follicle number, the serum tyrosinase content and the hair decolorization score in the Vitiligo Capsules group and the Bairesi Pills treatment group increased, and the differences were statistically significant (P < 0.05 or P < 0.01). The proportion of melanin hair follicles, hair decolorization score and serum tyrosinase content in the Bairesi Pills treatment group were not statistically significant compared with the Vitiligo Capsules group (P > 0.05). Conclusion Bairesi Pills can promote the increase of tyrosinase content, promote the proliferation of active melanocytes, so as to promote the generation of melanin, hair decolorization score is also significantly reduced, on the C57BL/6 mice model of vitiligo has a good therapeutic effect, and may have the same therapeutic effect as Vitiligo Capsules.
[Key words] Vitiligo; C57BL/6 mice model; Hydroquinone; Uygur medicine
白癜风是一种常见的色素脱失性皮肤病,以皮损内黑素细胞数目减少甚至消失或黑素细胞功能障碍,皮肤、黏膜或毛发的色素脱失为特征,在全球范围内患病率为1%~2%[1-2]。男女患者和所有种族/民族的发病率没有差异[3],以青少年最为多见[4],50%左右白癜风在20岁前发病[5]。白癜风的发病率目前呈逐年上升趋势[6],其发病机制至今未明,各种疗法的无效率可高达50%[7]。有文献报道白癜风的发病与自身免疫、遗传因素、黑色素细胞自身破坏、神经化学因子、心理因素、外伤、微量元素、环境因素等有关[8]。虽然白癜风基本不影响患者的身体健康和生理活动,但会影响患者的生活质量[9]。白热斯丸由驱虫斑鸠菊、盒果藤、干姜等几种生药组成。具有熟化和清除异常黏液质、温肤着色的功效。本试验通过建立C57BL/6小鼠白癜风模型,观察白热斯丸对黑素细胞增生、黑色素的生成和酪氨酸酶增加的影响,探讨其治疗白癜风的作用机制。
1 材料与方法
1.1 材料
1.1.1 受试药物 白热斯丸[新疆制药厂(试制),批号:180217];白癜风胶囊[天津宏仁堂药业有限公司(市售),批号:G06011]。
1.1.2 动物 C57BL/6小鼠,重量18~22 g,雌雄各半,购于新疆医科大学动物中心,鼠全价颗粒饲料,饲养于新疆维吾尔医药研究所。
1.1.3 仪器 TDL-5-A离心机(上海安亭科学仪器厂)、MULTISKAN FC酶标仪(赛默飞世尔上海仪器有限公司)、DM4000光学显微镜(德国莱卡)、RM2245切片机(德国莱卡)。
1.1.4 试剂 小鼠酪氨酸酶酶联免疫吸附测定试剂盒(ELISA)(江莱生物,批号:JL20441)。
1.2 实验方法
购入C57BL/6小鼠后,饲养于SPF级动物实验室,动物适应环境3 d,第4天,松香/蜡混合物脱去各小鼠背部毛2 cm×2 cm,24 h后开始造模,造模周期为50 d,C57BL/6小鼠32只,依次编号后根据随机数字表按皮肤白斑大小分为空白对照组、模型对照组、白癜风胶囊组和白热斯丸治疗组,各组雌雄各半共8只。空白对照组受试区涂抹灭菌蒸馏水,剂量为0.5 mL/d,bid;模型对照组、白癜风胶囊组白热斯丸组受试区涂抹2.5%氢醌软膏,剂量为100 mg/(kg·d),bid;从第21天开始,白热斯丸治疗祖和白癜风胶囊组灌胃给药30 d,隔1天进行皮肤情况拍照。实验期间密切观察小鼠皮肤颜色变化。
1.3 观察指标
1.3.1 肉眼观察模型对照组皮肤变化 毛发脱色评估[10],每天观察毛发脱色情况,将脱色部位分为涂药区域和非涂药区域,每个区域总分为5分,每只小鼠共10分。小鼠毛发脱色评分标准:0分为毛发无脱色;毛发脱色面积0≤1分≤10%;毛发脱色面积11%≤2分≤25%;毛发脱色面积26%≤3分≤50%;毛发脱色面积51%≤4分≤75%;毛发脱色面积76%≤5分≤100%。
1.3.2 小鼠血清酪氨酸酶含量 用酪氨酸酶标准溶液绘制酪氨酸酶标准溶液回归曲线,获得回归方程,对各组给药结束后,小鼠摘眼球取血,取小鼠血清,测定酪氨酸酶含量。
1.3.3 小鼠皮肤含黑色素毛囊计数 C57BL/6小鼠黑色素分布以毛囊分布为主,单位面积有色毛囊的计数可以直观的反应皮肤黑色素分布的水平[11]。取1 cm×1 cm的皮肤组织苏木精-伊红(HE)染色后,进行皮肤组织学观察、毛囊计数,用光镜观察50个毛囊,计算其中有黑色素的毛囊数所占比例。
1.4 统计学方法
采用SPSS 22.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组比较采用ANOVA分析(F检验),两两比较采用LSD法,计数资料采用百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 空白对照组小鼠脱色情况
空白对照组小鼠涂抹灭菌蒸馏水50 d后,未出现脱色。
2.2 模型对照组脱色情况
模型對照组用药部位在实验第12天开始出现脱色毛发点(图1A);第21天全部小鼠的抹药部位出现脱色(图1B),且脱色范围逐渐扩大;躯干没有用药的部位第29天开始出现毛发脱色情况(图1C)。
2.3 白热斯丸对实验性白癜风模型血清酪氨酸酶含量的影响
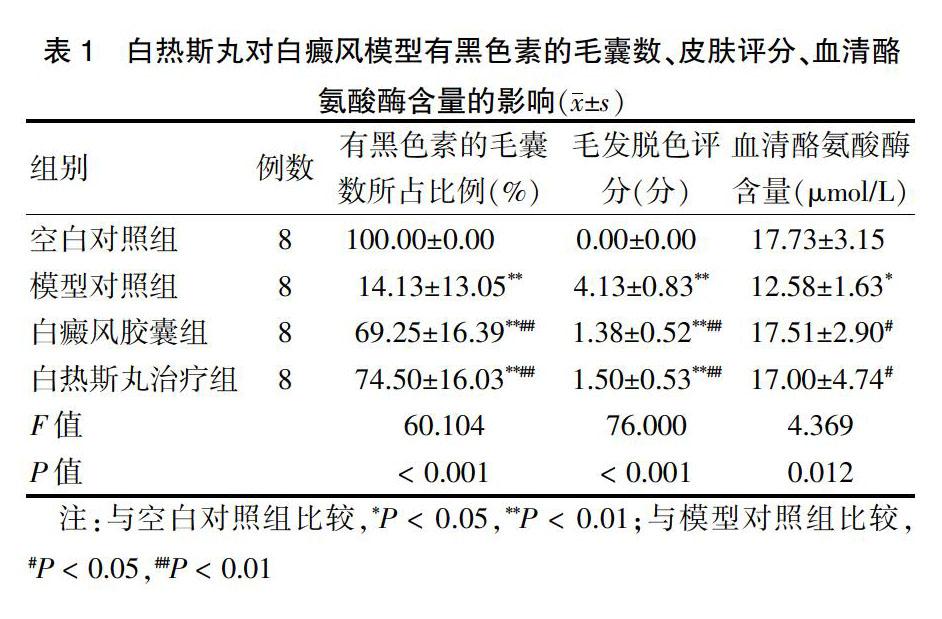
四组有黑色素的毛囊数所占比例、毛发脱色评分、血清酪氨酸酶含量比较,差异均有统计学意义(均P < 0.05);与空白对照组比较,模型对照组有黑色素的毛囊数所占比例、血清酪氨酸酶含量降低,毛发脱色评分增大,差异均有统计学意义(P < 0.05或P < 0.01);与空白对照组比较,白癜风胶囊组和白热斯丸治疗组有黑色素毛囊数所占比例减小,毛发脱色评分增大,差异有高度有统计学意义(P < 0.01),但两组血清酪氨酸酶含量与空白对照组比较,差异无统计学意义(P > 0.05);与模型对照组比较,白癜风胶囊组和白热斯丸治疗组有黑色素的毛囊数所占比例、血清酪氨酸酶含量增大,毛发脱色评分减小,差异均有统计学意义(P < 0.05或P < 0.01)。白热斯丸治疗组有黑色素毛囊数所占比例、毛发脱色评分、血清酪氨酸酶含量与白癜风胶囊组比较,差异无统计学意义(P > 0.05)。见表1。
表1 白热斯丸对白癜风模型有黑色素的毛囊数、皮肤评分、血清酪氨酸酶含量的影响(x±s)
注:与空白对照组比较,*P < 0.05,**P < 0.01;与模型对照组比较,#P < 0.05,##P < 0.01
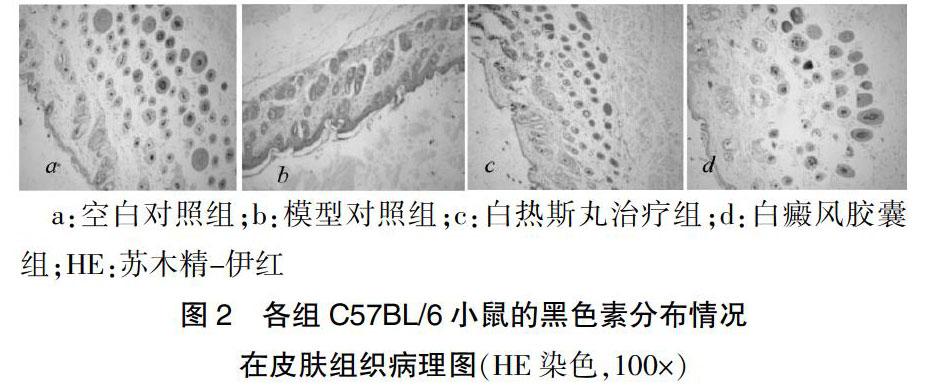
2.4 皮肤病理组织学和黑色素分布情况
空白对照组(见图2a)皮肤表皮棘层及基底层细胞均含黑色素颗粒。模型对照组(见图2d)皮肤表皮棘层明显增厚,角质层明显增生,基底层细胞及棘层细胞几乎见不到黑色素,毛囊内黑色素明显减少。白热斯丸治疗组(见图2c)和白癜风胶囊组(见图2d)基底层细胞及棘层细胞中黑色素增加明显,毛囊内黑色素明显增多。
3 讨论
白癜风维医学被称为“白热斯”“阿拉艾提”“皮赛”[12]。阿维森纳为古代著名维吾尔医,在11世纪时曾撰写《医典》,书云:白癜风是因脓性黏液质过度旺盛,阻碍力的功能,削弱排除力,而患者体内所产生代谢物质无法排出体外所致[13]。维医将白癜风分为甜味、咸味、酸味、涩味、淡味、凝固样黏液质型白癜风等6型[14]。异常黏液质是引起白癜风的主要原因,异常黏液质在性质上包含过度湿和过度寒[15],体内异常黏液质的过盛导致异常黏液质沉着在皮肤底部,阻碍皮肤的正常代谢,使营养成分不能完全输送到肌肤部位,使黑色素细胞不能正常生成发育,从而造成皮肤脱色,出现白癜风灶。
维医治疗白癜风药物种类繁多,有一批疗效确切、副作用小的药物主要是通过熟化及清除异常黏液质,改善血液循环及支配器官功能,提高自然力,自然恢复已被紊乱的免疫功能,实现身体免疫功能的平衡,从而治疗白癜风[16]。本实验使用的C57BL/6小鼠是白癜风研究中使用最为广泛的实验动物之一,适合于研究毛囊黑素细胞及白癜风复色相关的研究[17-19],本实验应用白热斯丸对白癜风小鼠模型连续治疗30 d,结果显示,白热斯丸治疗组脱毛区皮肤白斑较模型对照组减轻,光镜下发现治疗组基底层细胞及棘层细胞中黑色素增加明显,毛囊内黑色素明显增多。酪氨酸酶是黑色素生物合成过程中的关键酶[20],酪氨酸酶是一种铜结合金属酶,在黑素生成过程中,催化酪氨酸生成多巴胺和多巴醌等一系列过程,进而促进黑素细胞产生黑色素[21]。黑素细胞的减少或消失是白癜风的基本病理变化[22]。本实验结果也提示白热斯丸能明显增强酪氨酸酶的活性(P < 0.05),可使白癜风模型小鼠血清酪氨酸酶含量升高,说明白热斯丸能改善白癜风病变,对白癜风有一定的治疗作用并促进皮肤黑色素的生成。本实验结果表明,与空白对照组比较,模型对照组、白癜风胶囊组和白热斯丸治疗组有黑色素的毛囊数所占比例减小,毛发脱色评分增大,差异均有统计学意义(P < 0.05或P < 0.01);与模型对照组比较,白癜风胶囊组和白热斯丸治疗组有黑色素的毛囊数所占比例增大,毛发脱色评分减小,差异均有统计学意义(P < 0.05或P < 0.01)。白热斯丸治疗组有黑色素毛囊数所占比例、毛发脱色评分与白癜风胶囊组比较,差异无统计学意义(P > 0.05)。这说明白热斯丸治疗虽然对白癜风有较好的治疗作用,但不能痊愈。
[参考文献]
[1] 石海霞,张汝芝.自噬在白癜风发生发展中的作用[J].国际皮肤性病学杂志,2017,43(5):293-296.
[2] 毛秋霞,贾苇雪,肖学敏,等.节段型白癜风的研究进展[J].国际皮肤性病学杂志,2015,41(6):388-391.
[3] Grimes PE,Miller MM. Vitiligo:Patient stories,self-esteem,and the psychological burden of disease [J]. Int J Womens Dermatol,2018,4(1):32-37.
[4] 王春又,游弋,葛兰,等.白癜风免疫发病机制的研究进展[J].医学综述,2017,23(18):3638-3641,3646.
[5] 米吉提·吾普尔,热孜万古丽·乌买尔.白癜风免疫机制研究进展[J].中国中西医结合皮肤性病学杂志,2016,15(2):130-132.
[6] 刘哲,曲生明,巫毅,等.白癜风的免疫学发病机制及吡美莫司治疗白癜风的研究进展[J].中国老年学杂志,2017, 37(10):2588-2592.
[7] 刘景卫.中药干预联合点阵激光对白癜风皮损特异性标记基因表达影响的相关研究[J].中医临床研究,2017,9(23):13-15.
[8] 热孜万古丽·乌买尔,米吉提·吾普尔.结合维医理论论述白癜风病因与治疗研究进展[J].亚太传统医药,2017, 13(3):16-18.
[9] 叶伊琳,唐洁,刘琴,等.复方补骨脂搽剂对豚鼠白癜风模型作用的实验研究[J].北京中医药大学学报,2014,37(4):252-254,272,封3.
[10] Forman L. A nole on the depigmentary properties of monobenzyle-ther of hydroquinone [J]. Br J Dermatol,1953,65(11):406-409.
[11] 杨欣.复方白芷酊治疗白癜风作用的实验及临床研究[D].武汉:湖北中医药大学,2015.
[12] 斯拉甫·艾白,玉素甫·买提努尔.白癜风的维吾尔医诊断与治疗[M].乌鲁木齐:新疆人民出版总社,2012:1.
[13] 王培杰,王璞.维医药“毒”涵义辨析[J].中医药导报,2017,23(10):44-45.
[14] 斯拉甫·艾白,吐爾逊·乌甫尔,居来提·阿不都瓦衣提,等.基于维吾尔医理论关联分析白癜风辨证分型与成熟及清除疗法[J].新疆医学,2018,48(2):139-142.
[15] 古再丽努尔,巴哈尔古丽,王兴伊.维吾尔医特色疗法治疗白癜风的研究概况[J].中国民族民间医药,2017, 26(20):57-59,67.
[16] 米吉提·吾普尔,热孜万古丽·乌买尔,玉苏普·买提努尔,等.白癜风研究进展[J].中国民康医学,2018,30(15):82-84,91.
[17] 沈丹蓓,孙建方.白癜风相关研究领域中常用的动物模型[J].外医学:皮肤性病学分册,2004,30(4):226-228.
[18] 解翠林,石年,付曼妮,等.激光照射联合卤米松乳膏外用治疗白癜风的效果[J].中国医药导报,2018,15(34):93-96.
[19] 陈美莲,林运霜,陈樱桃,等.辨证施护联合梅花针叩刺治疗白癜风的效果观察[J].中国医药科学,2019,9(3):187-189.
[20] 章玲玲,许文,许爱娥.葛根素促进黑素细胞黑素合成及其机制的初步探讨[J].中华皮肤科杂志,2016,49(5):338-341.
[21] 潘兴华,陈志龙,黄丽娜.黑素细胞及黑素的生成与调节[J].生理科学进展,1998(2):85-57.
[22] 罗卫,蔡瑞康,朱美材,等.自体黑素细胞培养移植治疗白癜风的长期随访观察与研究[J].临床皮肤科杂志,2015,44(2):78-80.
(收稿日期:2019-02-23 本文编辑:顾家毓)

