红景天苷/壳聚糖水凝胶对大鼠脂肪间充质干细胞抗氧化应激损伤的影响
程宇 郑杰 陈浩 李健兰 黄玲 姚耀聪 陈灿

[摘要] 目的 探究紅景天苷/壳聚糖水凝胶对大鼠脂肪间充质干细胞抗氧化应激损伤的影响。 方法 将细胞株分为Control组,H2O2组(模型组),低、中、高浓度实验组,对模型组和各实验组进行氧化应激造模。通过不同温度观察水凝胶温敏性,使用光镜观察细胞形态,CCK-8法检测细胞活力,CM-Dil Dye标记细胞进行计数及3D形态观察。 结果 水凝胶在4℃为溶胶态,37℃为凝胶态。光镜下中浓度实验组细胞形成明显集落。第0、1天各组细胞活力比较,差异无统计学意义(P > 0.05)。第3、7天,模型组细胞活力低于Control组,各实验组细胞活力均高于模型组,差异有统计学意义(P < 0.05)。第0、1天各组细胞数量比较,差异无统计学意义(P > 0.05)。第3、7天,模型组细胞数低于对照组,各实验组细胞数均高于模型组,差异有统计学意义(P < 0.05)。3D图像观察到中浓度实验组细胞随时间增长从球形逐渐呈树枝状生长。 结论 红景天苷修饰的水凝胶促氧化应激损伤的大鼠脂肪干细胞存活。
[关键词] 壳聚糖水凝胶;红景天苷;脂肪间充质干细胞;氧化应激
[中图分类号] R114 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0004-04
Effect of salidroside/chitosan hydrogel on oxidative stress injury in rat adipose tissue derived mesenchymal stem cells
CHENG Yu ZHENG Jie CHEN Hao LI Jianlan HUANG Ling YAO Yaocong CHEN Can
Department of Cardiology, Affiliated Hospital of Guangdong Medical University, Guangdong Province, Zhanjiang 524000, China
[Abstract] Objective To investigate the effect of salidroside/chitosan hydrogel on oxidative stress injury in rat adipose tissue derived mesenchymal stem cells. Methods The cell lines were divided into Control group, H2O2 group (model group), low, medium and high concentration experimental group, while oxidative stress modeling was performed on the model group and each experimental group. The temperature sensitivity of the hydrogel was observed at different temperatures, the cell morphology was observed by a light microscope, the cell viability was detected by the CCK-8 method, while the cells were labeled with CM-Dil Dye for counting and 3D morphological observation. Results The hydrogel was in a sol state at 4℃ and in a gel state at 37℃. The cells in the medium concentration experimental group formed obvious colonies under the light microscope. There was no statistically significant difference in cell viability between the groups on days 0 and 1 (P > 0.05). On days 3 and 7, the cell viability of the model group was lower than that of the Control group, while the cell viability of each experimental group was higher than that of the model group, and the differences were statistically significant (P < 0.05). On days 0 and 1, there was no statistically significant difference in the number of cells in each group (P > 0.05). On days 3 and 7, the number of cells in the model group was lower than that in the control group, while the number of cells in each experimental group was higher than that in the model group, and the differences were statistically significant (P < 0.05). The 3D images observed that the cells in the medium concentration experimental group grew from spherical to dendritic with time. Conclusion Salidroside-modified hydrogel promotes survival of rat adipose stem cells injured by oxidative stress.
[Key words] Chitosan hydrogel; Salidroside; Adipose-derived mesenchymal stem cells; Oxidative stress
随着再生医学发展,干细胞在心肌梗死治疗中表现出巨大的潜力[1]。大鼠脂肪间充质干细胞(rASCs)因来源广泛、低免疫原性、高分化潜能等优点,已广泛用于基础和临床研究[2]。但移植干细胞存活率及滞留率仍然是阻碍干细胞进一步发展的难题[3]。壳聚糖水凝胶(CS-gel)为良好的生物相容性天然高分子材料[4],具有抗菌、调节免疫力,促进伤口愈合等作用以及温敏特性,故广泛用于生物组织工程和药物释放领域[5-6]。红景天苷(SAL)是红景天中主要酚苷之一,具有抗衰老、抗氧化、抗炎等广谱药理活性[7-8]。关于SAL修饰的壳聚糖水凝胶(SAL/CS-gel)负载rASCs抗氧化应激研究鲜有报道,本实验旨在探究不同浓度SAL修饰的CS-gel对其承载的rASCs抗氧化应激影响。
1 材料与方法
1.1 材料
1.1.1 实验细胞株 rASCs株购自广州赛业生物科技有限公司。
1.1.2 实验主要试剂和设备 红景天苷标准品(美国Sigma,货号:05410590);过氧化氢(H2O2)和Cell Counting Kit-8(上海碧云天生物技术公司,货号:S0051、C0039);壳聚糖(Cs)和β-甘油磷酸钠(上海阿拉丁公司,货号:D106347、C105801);Cell TrackerTM CM-DiI Dye(美国赛默飞,货号:C7001);激光共聚焦扫描显微镜(日本奥林巴斯,型号:FV3000)。
1.2 方法
1.2.1 实验分组 实验分为五组:Control组,H2O2组(模型组),低、中、高浓度实验组。Control组包含CS-gel + rASCs;H2O2组包含CS-gel + rASCs+H2O2;低中高浓度实验组包含SAL/CS-gel+rASCs+H2O2。
1.2.2 SAL/CS-gel制备 CS-gel实验步骤参照文献[9],壳聚糖溶于0.1 mol/L醋酸溶液,高温高压灭菌。β-甘油磷酸钠溶于3 mL双蒸水,85℃孵育30 min,0.22 μm滤孔过滤除菌。壳聚糖溶液和β-甘油磷酸钠溶液5.5∶2.0比例混合,冰浴2 h,逐滴添加4.54%碳酸氢钠溶液,至pH达到7.0~7.2。加入二甲基亚砜溶解的SAL溶液,使SAL终浓度各自为50、100、200 μmol/L,分别在4℃、室温、37℃条件下观察SAL/CS-gel凝胶时间。
1.2.3 CCK-8检测细胞活力 配制细胞凝胶混合液,接种至96孔板,50 μL/孔,形成凝胶态后,加入完全培养基50 μL/孔。置于细胞培养箱,培养24 h,给予模型组和实验组500 μmol/L H2O2处理,分别在0、1、3、7 d,加入CCK-8液[无胎牛血清培养基(1∶9)],置于细胞培养箱孵育4 h,酶标仪450 nm处测量吸光度OD值。
1.2.4 CM-Dil Dye标记rASCs法 全程无菌、避光操作,二甲基亚砜稀释CM-Dil Dye为浓度1 mg/mL的储存液,用无血清培养基稀释为1 μmol/L工作液。取对数生长期rASCs,200 μL工作液重悬(4~5)×106个细胞,置于培养箱孵育5 min,4℃水浴箱孵育15 min,1000 r/min离心5 min,收集细胞并PBS洗两次。加入溶胶态水凝胶并形成细胞凝胶混合物。接种到共聚焦皿500 μL/皿,形成凝胶后,再加入等体积完全培养基。培养1 d后,给予实验组和模型组H2O2处理,分别在第0、1、3、7天激光共聚焦拍摄观察3D细胞形态并细胞计数。
1.3 统计学方法
采用GraphPad Prism 5.0软件制作图表,计量资料以均值±标准差(x±s)表示,采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果
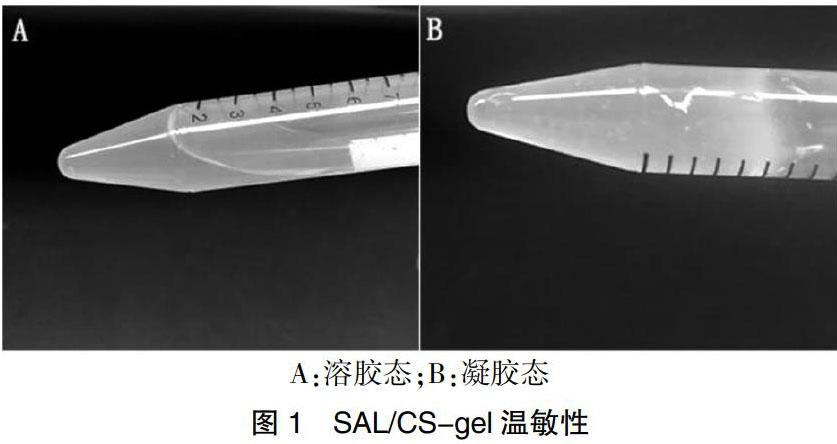
2.1 SAL/CS-gel温敏性
SAL/CS-gel在4℃为溶胶态,室温静置30 min后呈凝胶态,37℃静置5 min后呈凝胶态,提示SAL/CS-gel具有温敏特性。见图1。
2.2 SAL/CS-gel中细胞明场形态
第0天,各组细胞均呈散在短梭形或椭圆形,体积略小,折光点强。随着时间推移,对照组细胞呈散在长梭形,出现分枝,少量聚集成团。模型组细胞数量明显减少,第7天,出现碎裂圆点,仅存少数细胞且形态各异。SAL处理后,100 μmol/L濃度组细胞呈显著集落生长,且分枝明显。随着时间增加,50 μmol/L和200 μmol/L组浓度,细胞数缓慢减少,并呈现散在梭形或圆形,可见细胞碎片。见图2。
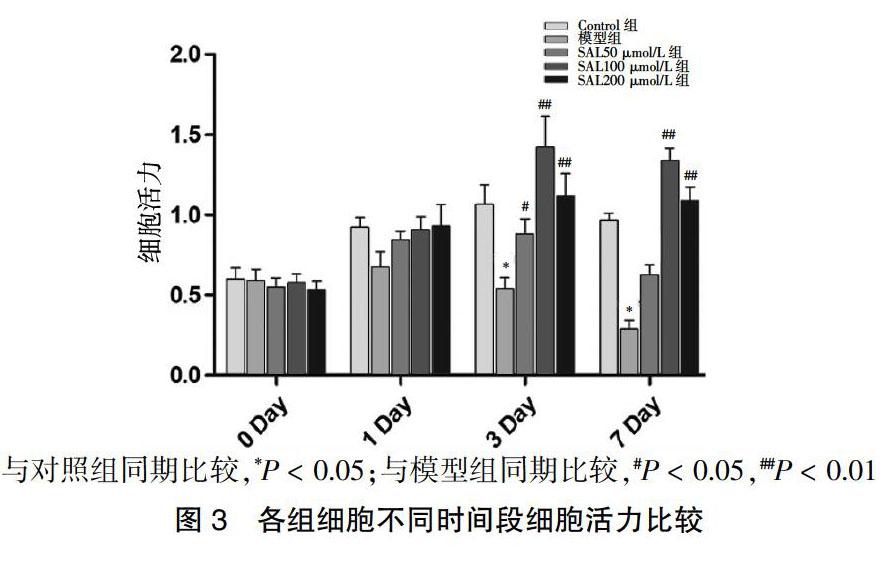
2.3 各组细胞不同时间段细胞活力比较
第0、1天各组细胞活力比较,差异无统计学意义(P > 0.05)。第3、7天模型组细胞活力低于对照组,SAL各浓度组细胞活力均高于模型组,差异有统计学意义(P < 0.05或P < 0.01)。见图3。
与对照组同期比较,*P < 0.05;与模型组同期比较,#P < 0.05,##P < 0.01
2.4 观察CM-Dil Dye标记的细胞存活和3D形态
2.4.1 CM-Dil Dye标记的细胞存活 第0、1天各组细胞数量比较,差异无统计学意义(P > 0.05)。第3、7天模型组细胞数低于对照组,各SAL浓度组细胞数均高于模型组,差异有统计学意义(P < 0.05)。见图4。
2.4.2 观察细胞3D形态 SAL 100 μmol/L组,第1天细胞横截面呈散在圆形或椭圆形,膜光滑完整,3D成像细胞呈球形,见图5A、B。第3天3D成像细胞呈树枝状,且体积增大,呈集落生长。见图5C、D。
3 讨论
心肌梗死仍然是全世界非传染性疾病死亡的主要原因之一[10],心肌因缺血、缺氧而坏死,严重影响心功能,甚至危及生命。目前主要采取再灌注疗法,减少心肌梗死面积、挽救濒死心肌细胞[11],但对缺血组织恢复血液供应和氧气供应后,因过量自由基产生,使氧化/抗氧化动态平衡失调,导致再灌注损伤。因此,寻找新型治疗手段迫在眉睫[12]。已有研究显示[13],rASCs移植用于改善心肌梗死损伤,一方面是通过干细胞直接分化为心肌样细胞;另一方面,通过旁分泌作用于受损心肌细胞[14]。本研究通过采用温敏水凝胶作为干细胞支架拟用于心肌梗死辅助治疗,然而氧化应激微环境不仅影响心肌细胞,也同时影响移植干细胞。例如缩短干细胞滞留时间、诱导干细胞凋亡,从而削弱干细胞对损伤组织的修复作用[15]。而有研究显示[16],H2O2诱导脂肪干细胞氧化应激损伤,是通过产生大量活性氧簇、丙二醛以及抑制抗氧化酶活性、激活凋亡通路,从而引起脂肪干细胞存活率和滞留率降低。因此,寻找不影响水凝胶生物特性且能增强干细胞抗氧化能力的物质成为现今研究热点。SAL提取于传统中药红景天,其抗氧化活性主要部位是酚羟基。已有研究显示[17-18],SAL通过激活PI3K/Akt/Nrf2通路减轻缺血再灌注大鼠神经细胞凋亡,提示SAL作为植物化学物质可激活抗氧化应激通路。而本实验观察到,随培养时间延长,对照组细胞活力呈逐渐增高到降低过程,但细胞数量无明显变化。提示rASCs适应水凝胶环境后无明显增殖,与贴壁培养具有强细胞增殖活性rASCs区别显著[19]。值得注意的是,不同材料支架对ASCs培养会向不同方向分化。如脂肪颗粒包埋ASCs向脂肪细胞分化、淫羊藿苷对与复合支架共培养ASCs促成骨分化等[20-21],提示rASCs在SAL/CS-gel中可能存在向终末细胞分化。氧化应激处理后,模型组细胞活力和细胞数量随时间明显降低,光镜观察到细胞碎裂,提示壳聚糖水凝胶对氧化应激损伤的rASCs无保护作用。而本研究结果显示,第3、7天,SAL 100 μmol/L组rASCs细胞活力显著高于模型组,差异有统计学意义(P < 0.05),提示SAL/CS-gel具有抗rASCs氧化应激损伤作用。
目前SAL/CS-gel中干细胞不可重回收,无法对干细胞表型及细胞内在变化进行检测,为进一步明确SAL修饰的水凝胶调控干细胞存活机制,探寻可回收干细胞生物材料十分必要。且氧化应激因不同病理环境、作用时间长短、发生程度等存在多种调控机制,故完善多种抗氧化应激指标,如活性氧簇、超氧化物歧化酶等,可以进一步证实SAL/CS-gel抗氧化能力。综上所述,SAL修饰的壳聚糖水凝胶可以有效促进rASCs在氧化应激环境下存活,从而为rASCs移植后发挥持久作用奠定了基础,为设计功能性生物材料提供新思路。
[参考文献]
[1] 蒋鎏骏,徐清波.心血管干细胞在心血管再生医学研究中的现状与展望[J].中国科学:生命科学,2019,49(8):965-976.
[2] Dong H. The potential value of Adipose Tissue-Derived(rAT)Mesenchymal Stem Cells(MSCs)[J]. Turkish Neurosurgery,2017,26(1):127-139.
[3] Mu?觡oz MF,Argüelles S,Guzman-Chozas M,et al. Cell tracking,survival,and differentiation capacity of adipose-derived stem cells after engraftment in rat tissue [J]. J Cell Physiol,2018,233(10):6317-6328.
[4] 宁显宾,逄锦峰,丁照义,等.壳聚糖/β-甘油磷酸钠水凝胶与显影剂的体外实验研究[J].北华大学学报:自然科学版,2017,18(5):609-614.
[5] 李岳,傅世铨,黎广平,等.温度敏感的水凝胶与富血小板血浆复合体对大鼠前交叉韧带部分损伤愈合的作用[J].中国运动医学杂志,2017,36(12):1072-1075,1111.
[6] 孙斌.可注射温敏壳聚糖/胶原/甘油磷酸钠水凝胶应用于骨组织工程的初步研究[D].北京:中国人民解放军军医进修学院,2011.
[7] 齐江莉,李泱,解亚楠,等.红景天苷对力竭大鼠心肌收缩力的影响[J].解放军医学杂志,2018,43(6):472-477.
[8] 黄菲菲,李耀浙,张婷,等.红景天苷通过抑制氧化应激防治大鼠低氧性肺动脉高压[J].中国病理生理杂志,2018, 34(3):500-506.
[9] 刘爱红,孙康宁,李爱民.壳聚糖-甘油磷酸钠温敏凝胶的制备与表征[J].材料导报,2010,24(14):116-119.
[10] Emily V. Global Health Observatory Data Repository [J]. Med Ref Serv Q,2020,39(1):67-74.
[11] 龚艳君,霍勇.急性ST段抬高型心肌梗死诊断和治疗指南(2019)解读[J].中国心血管病研究,2019,17(12):1057-1061.
[12] 孔令恒,陈玉龙,孙娜,等.抑制CaMKⅡ减轻线粒体氧化应激可改善离体心脏缺血再灌注损伤[J].南方医科大学学报,2018,38(2):181-186.
[13] 张格格,杨媚,李艳君,等.Tbx18能使兔脂肪干细胞向心肌样细胞分化[J].现代生物医学进展,2016,16(10):1812-1815,1994.
[14] 高宇平,林媛媛,李学文,等.低氧诱导大鼠脂肪干细胞旁分泌对心肌的保护作用[J].中国组织工程研究,2018, 22(9):1344-1349.
[15] 王佃亮,李燕妮.間充质干细胞移植治疗作用机制[J].转化医学杂志,2019,8(5):257-261.
[16] 王哲,张殿宝,杨向红.microRNA-223对糖基化终产物诱导人脂肪间充质干细胞凋亡和氧化应激影响的体外研究[J].中国动脉硬化杂志,2017,25(1):1-6.
[17] 赖文芳,洪海棉,张小琴,等.红景天苷通过激活PI3K/AKT/NRF2通路减轻MCAO大鼠的神经细胞凋亡[J].中华中医药杂志,2016,31(5):1883-1886.
[18] 李慧,孙乐栋.红景天苷抗衰老和抗氧化药理机制研究新进展[J].中国医药导报,2018,15(7):51-54,81.
[19] 赵建辉,李龙,杨阳,等.人脂肪干细胞的体外培养鉴定及分化特性[J].中国美容医学,2011,20(8):1232-1237.
[20] 杨天赤,李卫华,王震.淫羊藿苷对与复合支架共培养脂肪干细胞成骨分化的影响[J].现代中西医结合杂志,2020,29(1):30-33.
[21] 贾玉磊.人脂肪干细胞协同颗粒脂肪移植的实验研究[D].石家庄:河北医科大学,2014.
(收稿日期:2020-01-12 本文编辑:王晓晔)

