昆明地区慢性乙型肝炎患者替诺福韦酯耐药突变位点情况调查
普 冬,李晓非,余婷婷,王红英,张润武,李丽华,白 经,丁彩梅,李冬玲,杨永锐
(昆明市第三人民医院检验科,云南昆明 650041)
乙型肝炎病毒(hepatitis B virus,HBV) 感染是导致慢性肝炎、肝癌和肝硬化的重要因素。一直在我国人群中具有较高的感染率,据云南省CDC2016年底的最新调查,我省年均发病率为51.99/10 万,昆明市为高发区,累计报告病例居第一。核苷酸类似物作为HBV 感染的常规治疗药物之一,面临一个严峻的问题,即核苷类似物的耐药性[1],耐药的发生极大地降低了慢性乙型肝炎患者的治疗效果。替诺福韦酯(tenofovir disoproxil fumarate,TDF) 是美国肝病学会(AASLD) 和欧洲肝病学会(EASL) 推荐的一线强效抗病毒药物[2]近年来,我院部分患者已经开始使用该药进行治疗,因此对替诺福韦酯耐药相关的位点的突变情况,进行监测对慢性乙型肝炎的治疗与预后具有重要的意义。基因测序是公认的突变检测的金标准,因为测序检测的是乙肝耐药易突变区域的完整序列,是判断病毒核酸碱基突变与否的最直接和最可靠的方法[3]。本研究通过Sanger 测序(双脱氧末端终止法),对昆明地区2 707例HBV DNA 阳性的慢性乙肝患者,HBV P 基因区进行了测序和分析,探讨TDF 在本地区慢性乙型肝炎患者中,不同HBV 基因型和替诺福韦酯耐药相关的位点的突变情况,及其HBV-DNA 量和HBeAg 之间的关系。以期为临床工作者在慢性乙型肝炎使用替诺福韦酯治疗方面提供一定的参考依据。
1 资料与方法
1.1 一般资料
选取昆明市第三人民医院2017年5月至2019年3月期间,住院及门诊就诊的2 707例慢性乙型肝炎患者血清标本,男1905例,女802例,年龄14~78 岁,平均46 岁。诊断均符合2015 版《慢性乙型肝炎防治指南》[4]。
1.2 主要试剂和仪器
1.2.1 HBV-DNA病毒DNA/RNA 提取试剂盒(磁珠吸附法) 提取试剂盒,购自苏州天隆生物科技有限公司;HBV-DNA 纯化试剂盒购自西安天隆生物科技有限公司;乙型肝炎病毒分型和耐药测序试剂盒购自广州立菲达安诊断产品技术有限公司;血清HBsAg 测定试剂购自罗氏诊断公司;血清ALT 定量测定试剂购自该公司;CFX96 自动实时荧光定量PCR 仪购自美国伯乐公司;3500Dx测序仪购自美国ABI 公司;AU5400 型生化分析仪购自日本奥林巴斯公司;M odular E170 全自动电化学发光免疫分析仪购自瑞士罗氏诊断公司。
1.2.2 标本采集采集慢性乙型肝炎患者空腹不抗凝静脉血3 mL,离心10 min,3 000 r/min,分离血清置1.5 mL离心管中,-20℃储存备用。
1.2.3 HBV DNA 定量检测采用实时荧光定量PCR 方法对乙肝病毒载量进行检测,检测灵敏度为1×102IU/mL,具体操作严格按说明书进行。
1.2.4 乙肝病毒分型和耐药基因位点检测从血清标本中提取乙肝病毒DNA,通过PCR 扩增HBV P 区RT 段序列,扩增产物纯化后,在ABI 3500DX测序仪上直接进行Sanger 测序(双脱氧末端终止法)。测序具体操作严格按说明书进行。通过序列比对分析乙肝病毒基因型和HBV P 区核苷类药物耐药相关位点的突变情况,具体包括:rt169、rt173、rt180、rt181、rt184、rt194、rt202、rt204、rt236、rt250 等。
1.2.5 耐药位点与不同药物的关系:(1)rtM204I/V/S 和rtL180M:为拉米夫定、替比夫定与恩曲他滨的主要耐药位点;(2) rtA181T/V/S 和rtN236T/V:检出这两个耐药位点中的任一个位点阳性即可判断阿德福韦酯耐药,检出其它位点视为不确定的、证据不充分、尚需进一步证实的耐药位点;替诺福韦酯是比较新的上市药物,目前还没有针对TDF/TAF 相关长期用药的耐药研究报道,但rtN236T/V、A194T 和rt A181T/V 位点突变会引起替诺福韦酯酯不敏感,是主要的替诺福韦酯耐药相关位点;(3) rtM204 和rtL180M 与((rtV173L、rt I169T、rtM250V、rtT184/G、rtS202I/G) 5 种突变中的任意一种或两种组合,就可判断恩替卡韦耐药,rtM204V 和L180M 单独突变则引起恩替卡韦不敏感。
1.2.6 耐药敏感性判读针对不同药物的耐药位点分类及检出情况,参照《2017年欧洲肝病年会乙型肝炎病毒感染临床实践指南要点》[5]判读,见表1。

表1 常见的HBV 基因型耐药与药物敏感性Tab.1 Common HBV genotype resistance and drug sensitivity
1.2.7 血清HBsAg 测定采用瑞士罗氏诊断公司M odular E610 全自动电化学发光免疫分析仪对血清HBsA g 进行测定,样品检测结果为:S/CO≥1.0为阳性。
1.2.8 血清ALT 定量测定采用日本奥林巴斯AU5400 型生化分析仪检测血清ALT,正常范围上限为40 U/L。
1.3 统计学处理
采用统计软件SPSS 对检测数据进行分析。比较核苷酸类药物耐药标本的计数,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 替诺福韦酯耐药相关位点变异慢性乙肝患者基因型发布情况
本研究2707例慢性乙肝患者中,共有52例(1.92%,52/2707) 患者检测到替诺福韦酯耐药相关位点的突变,变异率为1.92%。52例患者中HBV 基因型以C 型为主占65.38%(34/52),B 型次之占34.62% (18/52),D 型没有发现。B 基因型和C 基因型HBV 感染率分别为34.62%(18/52)和65.38%(34/52),基因型分布与昆明地区的总体分布一致,昆明地区HBV 基因型以C 型为主占62.43% (1690/2707),B 型 次 之 占 37.31%(1010/2707),D 型也有发现占0.26% (7/2707),但与国内相关研究报告[6]比较,本地区的HBV 基因型分布状况有独立特征。52例替诺福韦酯耐药相关位点变异的慢性乙肝患者,其基因型和基本资料见表2。
2.2 52例检测到替诺福韦酯耐药相关位点突变的检出结果
检出与替诺福韦酯(TDF) 耐药相关位点突变(A194T、N236T、A181T/V),耐药不敏感性I(1.92%,52/2707)。其中A181T/V 位点单独突变率最高(19.23%),N236T 位点单独突变率次之(15.38%),A194T 位点单独突变率最低(9.61%);检出与替诺福韦酯(TDF) 耐药突变相关的位点(A194T、N236T、A181T/V) 和次要/ 补偿耐药位点(I169T、M204V/I、L180M 等) 的二个位点混合突变26例,主要是:A181T/V+N236T,10例(19.23%);A181T/V+M204V/I,8例(15.38%),同时也检出2例三个位点混合突变,分别为:A181T/V+N236T+V173,1例(1.92%);A181T/V+M204V/I+L180M,1例(1.92%),见表3。
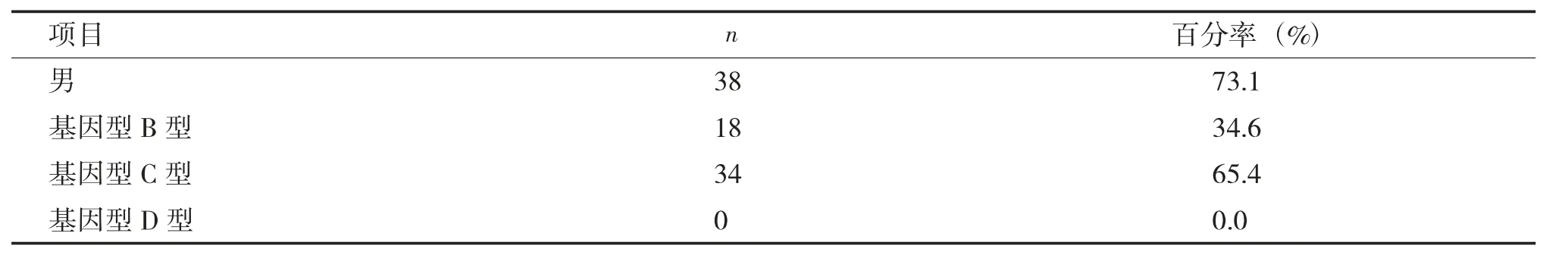
表2 52例替诺福韦酯耐药相关位点变异慢性乙肝患者基因型和基本资料Tab.2 Genotype and basic data of 52 chronic hepatitis B patients with tenofovir resistance mutation
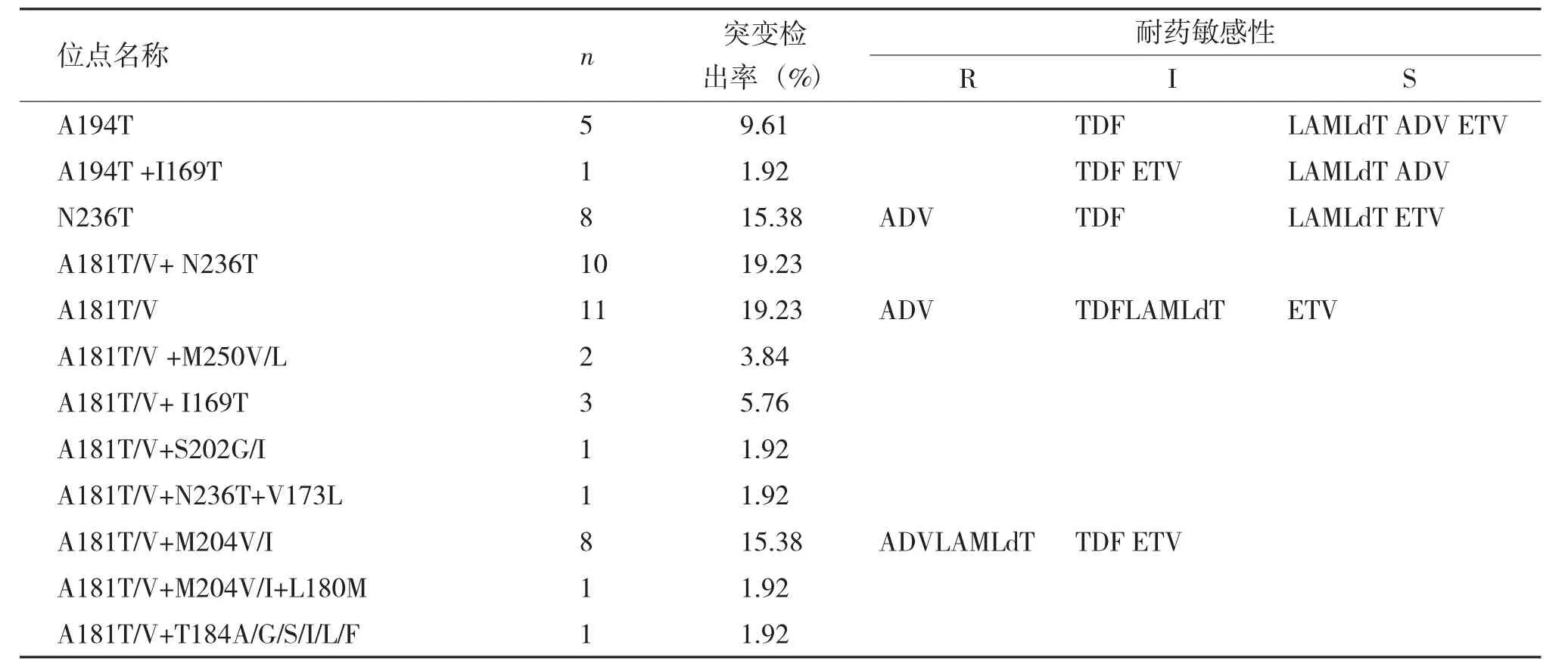
表3 52例慢性乙肝患者替诺福韦酯耐药相关位点突变的检出结果Tab.3 The result of tenofovir resistant mutation sites in the 52 chronic hepatitis B patients
2.3 替诺福韦酯耐药相关位点变异与HBV-DNA量的相关性分析
对24例检出与替诺福韦酯(TDF) 耐药相关位点(A194T、N236T、A181T/V) 单独突变的慢性乙肝患者,按照HBV-DNA 水平分为:低于检测线(<102IU/mL),低水平(102~104IU/mL);中水平(105~107IU/mL);高水平(≥107,IU/mL)4 个组,各组分别有2例(3.84%)。16例(30.75%),4例(7.69%),2例(3.84%)。替诺福韦酯耐药相关位点单独变异在各组间的检出率差异有统计学意义(P<0.05),见表4。其中HBV-DNA 中,低水平两组的各耐药位点的突变检出率较高。而对HBV-DNA 中,低水平为102~104IU/mL 和105~107IU/mL 两组进行HBV 耐药突变差异分析,发现各耐药位点在这两组间的突变检出率差异无统计学意义(P>0.05),见表4。

表4 替诺福韦酯耐药相关位点变异检出率与HBV-DNA 量的关系[n(%)]Tab.4 The relationship between tenofovir resistance mutation rate and HBV-DNA level [n(%)]
2.4 不同HBeAg 状态下替诺福韦酯耐药相关位点的变异率
替诺福韦酯耐药相关位点变异与HBeAg 的关系24例检出与替诺福韦酯(TDF) 耐药相关位点(A194T、N236T、A181T/V) 单独突变的慢性乙肝患者中,e 抗原阳性者9例(37.50%),e 抗原阴性者15例(62.50%)。替诺福韦酯耐药相关位点A181T/V 变异在HBeAg 阳性组的突变检出率较高,其差异有统计学意义(P<0.05),见表5。
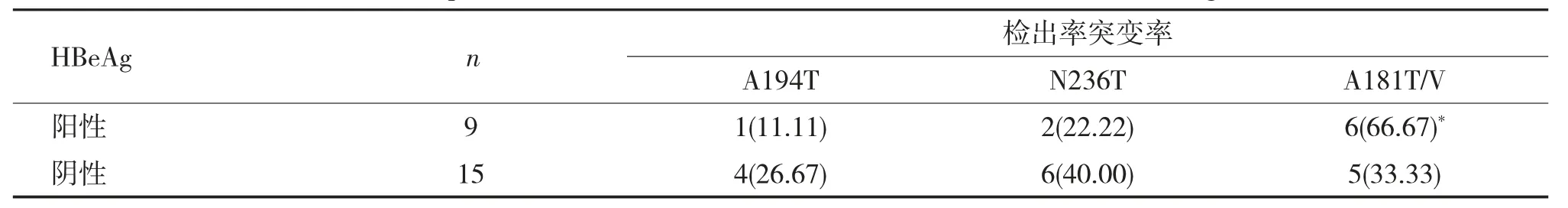
表5 替诺福韦酯耐药相关位点变异率与不同HBeAg 状态的关系[n(%)]Tab.5 The relationship between tenofovir resistance mutation rate and HBeAg level [n(%)]
2.5 不同ALT 状态下替诺福韦酯耐药相关位点的变异率
替诺福韦酯耐药相关位点变异与ALT 的关系24例检出与替诺福韦酯(TDF) 耐药相关位点(A194T、N236T、A181T/V) 单独突变的慢性乙肝患者中,ALT 值超过正常范围上限(40 U/L) 者10例 (41.67%),ALT 值属于正常范围者14例(58.33%)。替诺福韦酯耐药相关位点A181T/V 变异在ALT 值异常组的突变检出率较高,其差异有统计学意义(P<0.05),见表6。
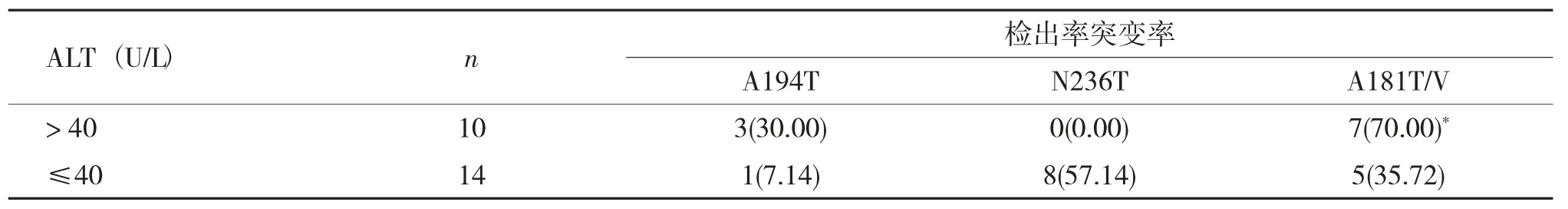
表6 替诺福韦酯耐药相关位点变异率与不同ALT 状态的关系[n(%)]Tab.6 The relationship between tenofovir resistance mutation rate and ALT level [n(%)]
3 讨论
目前替诺福韦酯治疗慢性乙肝患者的疗效已得到肯定,被国内外权威肝病治疗指南推荐为慢性乙型肝炎抗病毒治疗的一线药物,因替诺福韦酯作为治疗慢乙肝的新药,其作用机制及优势较为显著[7],又属于强效低耐药基因屏障药物,目前尚无明确的耐药性报道。虽然口服核苷类治疗有明确的抑制HBV 的作用,但由于HBV 复制过程中有反转录过程,而反转录酶不具DNA 聚合酶的3’~5’校正功能,患者长期使用单种核苷酸类药物,再加上HBV 复制很快,极容易引起HBV 针对此药物的耐药突变[8]。而替诺福韦酯作为一种核苷酸类药物,对其耐药相关位点变异的发生,在不同HBV 基因型和HBV—DNAh 载量,以及不同HBeAg 和ALT 状态下的情况进行调查分析。
有研究表明[6],HBV 基因型分布存在一定的地域性差异,我国南方以B 型为主,北方以C 型为主,D 型主要见于西藏和部分少数民族地区。本研究提示检测到替诺福韦酯耐药相关位点的突变52例患者中,B 基因型和C 基因型HBV 感染率分别为34.62% (18/52) 和65.38% (34/52),基因型分布与昆明地区的总体分布一致,昆明地区HBV基因型以C 型为主占62.43% (1690/2707),B 型次之占37.31% (1010/2707),D 型也有发现占0.26%(7/2707) 与以上研究结论相比较,本地区的HBV 基因型分布状况有独立特征。可能是昆明地区人口流动的增加,传播途径特点等因素改变,造成基因型呈多样化的趋势,流行分布正在发生变化。本研究中D 型也有发现占0.26%(7/2707),与国内相关研究[9],在新疆、云南和福建发现了D型分布的发现一致。目前有研究[10]表明替诺福韦酯对HBV 基因型B,C 型慢性乙型肝炎的治疗效果差异无统计学意义。但也有李火炎等人[11]的研究指出,针对不同基因型HBeAg 阳性慢性乙型肝炎患者,治疗效果也存在一定的差别,本研究提示检测到替诺福韦酯耐药相关位点的突变52例患者中,HBV 基因型以C 型为主占65.38%(34/52),这就提示临床在使用替诺福韦酯治疗时,需要对其治疗效果是否存在差异进一步的研究。
本研究中2707例患者中,共有52例(1.92%,52/2707) 患者检出与替诺福韦酯(TDF)耐药相关位点突变(A194T、N236T、A181T/V),耐药不敏感性I(1.92%,52/2707),其中A181T/V位点单独突变率最高(19.23%),有研究表明,A181T/V 变异病毒对大部分抗HBV 核苷(酸) 类药物均呈现一定程度的耐药性,对恩替卡韦的敏感性降低12~15 倍[12],A181T 突变的病毒株对恩替卡韦仍旧敏感[13]。另有体外实验还发现,A181T/V 或N236T ADV 耐药株对TDF 的敏感性下降3~4 倍[14]。虽然替诺福韦酯尚未发现耐药株,但这类突变发生的比例相对较高,提示了产生替诺福韦酯耐药不敏感性(1.92%) 的问题,是应该引起临床进一步追踪研究的。另外,检出A194T位点单独突变率最低(9.61%),有研究表明,194位丙氨酸至苏氨酸的替换(rtAl94T) 与TDF 耐药相关[15],出现该耐药后对ETV 仍敏感[16],与替诺福韦酯(TDF) 耐药突变相关的位点(A194T、N236T、A181T/V) 和次要/补偿耐药位点(I169T、M204V/I、L180M 等) 的二个位点混合突变26例,主要是:A181T/V+N236T,联合变异10例,A181T/V+M204V/I,8例,同时也检出2例三个位点混合突变,原因有待进一步研究。虽然有研究发现,TDF 治疗LAM 或LdT 耐药的患者较ADV 更有效,挽救疗法时TDF 单药即足够[17]。然而本研究结果显示,相关替诺福韦酯(TDF) 耐药位点(A194T、N236T、A181T/V) 的突变,会导致ETV和TDF 的耐药不敏感性,这与ISuzuki 等[18]新近研究结果一致,其报道一组耐药CHB 患者联合使用ETV+TDF 治疗后出现病毒学了突破,因此临床对耐药患者进行TDF 挽救治疗时,需要进行密切随访和评估。
替诺福韦酯酯耐药相关位点单独变异HBV-DNA 载量的中,低水平两组的各耐药位点的突变检出率较高。与荣海燕等[19]的研究结果相似,当HBV-DNA 量达到中等水平时,突变株和野生株形成一种平衡状态,突变株检出率不再发生变化。本研究结果发现,A181T/V 单独突变的检出率较高,并且主要在HBV-DNA 载量的中,低水平两组病例中,可能与文献[20]研究结果一致,该突变会引起病毒在肝细胞内的积聚和HBV DNA 载量的下降,这将影响临床上仅仅依据血清HBV DNA 水平诊断病毒学突破的结果,提示临床需加强关注。而对HBV-DNA 载量的中,低水平为102~104IU/mL 和105~107IU/mL 两组进行HBV 耐药突变差异分析,发现各耐药位点在这两组间的突变检出率无统计学差异(P>0.05),但是HBV-DNA 载量呈反复低水平波动的患者,其病理损伤和预后都是不可预料的,现有报道也很少,未来需要更关注此类人群。
检出与替诺福韦酯(TDF) 耐药相关位点(A194T、N236T、A181T/V) 单独突变的24例慢性乙肝患者中,e 抗原阳性者9例 (37.50%),A181T/V 变异在HBeAg 阳性组的突变检出率较高6例(66.67%),其差异有统计学意义(P<0.05),e抗原阳性组的总突变检出率及(TDF) 耐药相关位点突变检出率与e 抗原阴性组无显著差异,表明这两者不具有相关性。HBeAg 可以反映HBV 复制具有传染性,替诺福韦酯作为一种核苷酸类药物,其可以有效的抑制乙型肝炎病毒多聚酶,但是与替诺福韦酯(TDF) 耐药相关位点突变的检出,提示存在替诺福韦酯的耐药不敏感性,治疗效果可能也会存在一定的差别,李忠斌等[21]经研究发现,经其它核苷类药物耐药的慢性乙型肝炎患者换用替诺福韦酯治疗后应答欠佳,同时检测到耐药突变的HBV 突变株在使用替诺福韦酯治疗期间仍存在,提出其它核苷类药物与替诺福韦酯可能存在交叉耐药位点,因此笔者应该对其进行深入的研究。替诺福韦酯耐药相关位点A181T/V 变异在ALT 值异常组的突变检出率较高,其差异有统计学意义(P<0.05),见表6。在平时的检测和诊断中应引起足够重视。
替诺福韦酯属于新型强效低耐药基因屏障药物,被国际权威肝病治疗指南推荐用于慢性乙型肝炎抗病毒治疗的一线药物,临床疗效卓越,目前尚无耐药性报,并且替诺福韦酯在本地区尚未广泛应用,缺乏研究资料。本研究使用基因测序法对昆明地区慢性乙型肝炎患者,基因型和替诺福韦酯耐药相关位点,进行了准确有效的检测,并分对替诺福韦酯耐药位点突变与HBV-DNA 载量和HBeAg 之间的关系进行分析研究,了解本地区慢性乙肝患者替诺福韦酯耐药突变情况具有独立特征,国内外学者对于应用替诺福韦酯治疗疗效,意见尚不统一,如VAN B0M M E L 等[22]研究得出结论:在其它核苷类药物耐药患者中,替诺福韦酯治疗敏感性仅轻度降低,可作为进一步被选择的药物。可见,只有通过更深入研究,才能更加明确替诺福韦酯疗效,从而更好地指导临床制定个体化抗病毒治疗方案,更加关注治疗效果不好的或者是治疗反应很差的患者,为精准医疗提供有力的客观依据。

