Wnt通路中卷曲蛋白4和分泌型卷曲相关蛋白1在儿童急性淋巴细胞白血病中的表达
周 碧 王文鹏 周 敏 李 宣 高吉照
急性淋巴细胞白血病(acute lymphoplastic leukemia,ALL)是儿童时期最常见肿瘤性疾病,占15岁以下肿瘤患者总数的25%,近20年来发生率不断增加,其发病可能与免疫、感染、辐射和遗传等因素相关,具体机制尚不明确[1,2]。目前临床以长程化学药物治疗为主,病程中不可避免合并脏器损伤、血流感染等,且部分患儿化疗后不缓解、缓解后或骨髓移植后或嵌合抗原受体T细胞免疫治疗后复发,问题的解决需要新型治疗方案。Wnt通路尤其是Wnt/β-catenin信号通路与多种肿瘤的发生、进展关系密切[3]。笔者前期已对通路因子β-catenin、Wif-1和DVL的表达进行研究,证明Wnt/β-catenin通路参与了儿童ALL的发生[4~6]。本研究通过分析骨髓单核细胞中Fz4和sFRP1的表达,进一步探索Wnt通路与儿童ALL的关系,寻求新的治疗靶点。
资料与方法
1.研究资料:留取徐州医科大学附属医院儿科血液与肿瘤病区与徐州医科大学附属儿童医院血液与肿瘤科就诊的免疫性血小板减少(immune thrombocytopenia,ITP)患儿和ALL患儿骨髓,ITP诊断依据《儿童原发性免疫性血小板减少症诊疗建议》[7],ALL患儿入组条件:①骨髓细胞形态学初诊ALL;②依据《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[8]评估及治疗且第33天骨髓达完全缓解;③确诊前未使用激素及其他免疫抑制剂;④排除其他恶性疾病。实验设计及操作流程获徐州医科大学附属医院医学伦理学委员会批准及患儿监护人书面知情同意。
2.实验分组:随机选取符合条件ALL患儿50例,分别留取治疗前及治疗后第33天患儿骨髓作为初发组和缓解组,收集20例ITP患儿骨髓作为对照组。将初发组50例ALL患儿按危险度分为高危(high risk,HR)组、中危(intermediate risk,IR)组和低危(low risk,LR)组。
3.主要试剂与设备:TRIzol(美国Invitrogen公司),cDNA第一链合成试剂盒(日本TaKaRa公司),rabbit anti-GAPDH(中国江苏凯基生物技术股份有限公司),羊抗兔IgG-HRP,兔抗-SFRP1(英国Abcam公司),兔抗-Frizzled 4(中国博奥森生物科技有限公司),Western blot法检测试剂盒(KGP1201,中国凯基生物技术股份有限公司),One Step TB GreenTMPrimeScriptTMreal-time PCR Kit Ⅱ (SYBR Green,日本TaKaRa公司),荧光定量PCR循环仪(美国ABI公司),Trans-Blot Turbo全能型蛋白转印系统(美国 Bio-Rad公司),凝胶成像系统(G:BOXChemiXR5,英国 Syngeni公司)。
4.留取患儿骨髓2.5ml,肝素抗凝,密度梯度离心法分离单个核细胞,-80℃冰箱冻存待用。
5.Real-time PCR法检测骨髓单个核细胞中Fz4和sFRP1 mRNA的表达:参照TRIzol说明书提取总RNA,取已提取RNA样本至495μl,1×TE Buffer 中,测定260nm和280nm处吸光度(A)值;A260/A280结果在1.8~2.1,抽提的RNA纯度符合实验要求。依据cDNA第一链合成试剂盒说明书行反转录合成cDNA。Fz4上游引物5′-CGTGACCAAGATGCCCAACCT-3′,下游引物5′-CGTACTGGATGAGCGGTGTGAA-3′,89bp;sFRP1上游引物5′-AGCTTGTGCTGTACCTGAAGAATGG-3′,下游引物5′-CATGATGAGGAAGTGGTGGCTGAG-3′,80bp;GAPDH上游引物5′-AGATCATCAGCAATGCCTCCT-3′,下游引物5′-TGAGTCCTTCCACGATACCAA-3′,90bp。PCR扩增反应体系:2×real-time PCR Master Mix 10μl,模板(cDNA稀释10倍)1μl,上下游引物(10μmol/L)各1μl,0.1%DEPC水7μl。反应条件:95℃预变性5min;95℃变性15s,60℃退火20s,72℃延伸40s,共40个循环;95℃变性15s,骤冷至60℃,制作熔解曲线。使用ABI 7500 System SDS Software软件,比较Ct值分析相对定量结果,mRNA相对表达量采用2-△△Ct表示。
6.Western blot法检测骨髓单个核细胞中Fz4和sFRP1蛋白的表达:取分离所得骨髓血单个核细胞约1×107个,加入约100μl RIPA裂解液冰上裂解30min,4℃ 12000r/min离心5min,收集上清液,采用BCA法测定各样品中蛋白的浓度。取等量(200μg)各样品行10% SDS-PAGE电泳,电泳结束后将目的条带半干转至NC膜上,转膜结束后,取出NC膜并作好标记,用TBST洗膜10min×3次。将膜放入含一抗(用Western一抗稀释液稀释)的平皿中,4℃摇床振荡孵育过夜;第2天取出,室温振荡30min,吸弃一抗,TBST洗10min×3次;用5%脱脂奶粉封闭液稀释二抗,室温摇床振荡反应1~2h;二抗反应结束后,回收二抗。用TBST洗膜5~10min×3显色,使用G:BOX chemiXR5成像,使用Gel-Pro32软件对结果进行灰度分析。

结 果
1.基本资料:50例ALL患儿,年龄6个月~13岁,患儿中位年龄4岁,其中男性26例、女性24例;20例ITP患儿,年龄5个月~14岁,患儿中位年龄3岁,其中男性9例、女性11例。各组年龄和性别构成比比较差异均无统计学意义(P>0.05)。初发组包括HR患儿12例、IR患儿11例和LR患儿27例。
2.初发组、缓解组和对照组中Fz4、sFRP1 mRNA和蛋白的表达结果:初发组Fz4 mRNA和蛋白相对表达量均明显高于缓解组和对照组(P<0.05),sFRP1 mRNA和蛋白相对表达量均明显低于缓解组和对照组(P<0.05);缓解组、对照组中Fz4和sFRP1 mRNA、蛋白表达比较,差异均无统计学意义(P>0.05),详见表1、图1。
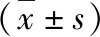
表1 各组Fz4和sFRP1 mRNA和蛋白的相对表达量
与初发组比较,*P<0.05

图1 各组两因子蛋白表达
3.初发组Fz4和sFRP1 mRNA和蛋白表达的相关性分析:初发组中,Fz4、sFRP1 mRNA和蛋白相对表达量呈负相关(P<0.05),详见表2。

表2 Fz4和sFRP1表达的相关性分析
4.不同危险度分组中Fz4和sFRP1 的表达水平:初发组中,高、中危组Fz4 mRNA和蛋白相对表达量均高于低危组(P<0.05),高、中危组sFRP1 mRNA和蛋白相对表达量均低于低危组(P<0.05),详见表3,图2。
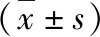
表3 各危险度分组中Fz4和sFRP1 mRNA和蛋白的表达
与高危组比较,*P<0.05;与中危组比较,#P<0.05
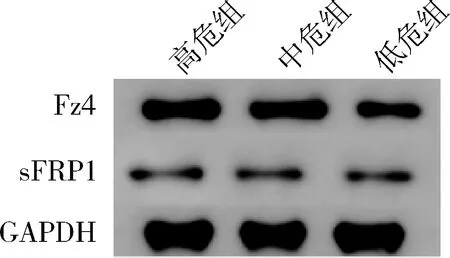
图2 不同危险度分组两因子蛋白表达
讨 论
Wnt通路是重要细胞信号转导通路之一,在多细胞真核生物中广泛存在,Wnt信号传递涉及多因子、多环节、多种调控,目前已知Wnt通路有4条,分别是经典Wnt通路(canonical Wnt/β-catenin pathway)、平面细胞极性通路、Wnt/Ca2+通路、调节纺锤体的方向和非对称细胞分裂的胞内通路[9]。Wnt/β-catenin通路的研究较为广泛,其异常激活与多种肿瘤的发生、发展、转移和预后有关[3]。
Wnt通路成分复杂,进化保守,信号级联传递,Fz是Wnt配体的核心受体,在胞膜水平,Wnt配体与Fz的半胱氨酸富集区(cysteine rich domain,CRD)特异性结合并激活通路,发挥“开关”的作用[10,11]。sFRP位于胞外,其30%~50%的CRD与Fz同源,但较Fz缺少跨膜域和胞质域,故sFRP可竞争性结合Wnt配体或与Fz结合形成CRD二聚体,阻止Wnt信号进一步转导,是通路的天然抑制剂[12]。
本研究发现,初发患儿中sFRP1 mRNA和蛋白表达均低于缓解和ITP患儿,Fz4 mRNA和蛋白均高于缓解和ITP患儿,两因子在ALL缓解和ITP患儿表达差异无统计学意义;初发组患儿Fz4和sFRP1 mRNA、蛋白表达均呈负相关。研究表明,正常人骨髓单个核细胞不能扩增出sFRP1的甲基化特异性引物,而ALL细胞株Molt-4和Jurkat中sFRP1呈完全甲基化状态,且去甲基化药物能够恢复sFRP1表达,并逆转疾病进展[13]。本研究发现,ALL儿童中sFRP1因启动子异常甲基化而失活,sFRP1表达降低,不能与Fz4结合形成CRD二聚体或竞争性结合Wnt配体,Fz4表达增加,Wnt信号活性增强,进一步激活下游肿瘤靶基因如Cyclin D1、c-Myc、Axin2、Msl1的转录,最终导致儿童ALL的发生[14~16];诱导化疗通过去甲基化恢复了sFRP1的表达,故完全缓解ALL患儿和ITP患儿,sFRP1和Fz4的表达差异无统计学意义。
危险度分层是儿童ALL预后独立危险因素,不同危险度分层患儿接受化学药物治疗的强度亦不同[17]。本研究发现初发高危、中危ALL患儿sFRP1 mRNA和蛋白表达均低于低危患儿,初发高危、中危ALL患儿Fz4 mRNA和蛋白表达均高于低危患儿,初发高危、中危ALL患儿两因子表达差异无统计学意义,可能因为不同危险程度ALL患儿sFRP1基因CpG岛甲基化倾向性不同,低危组患儿sFRP1基因具有更高的表达活性,具体机制尚需进一步研究[18]。
综上所述,研究认为,Wnt通路中Fz4表达升高、sFRP1表达降低参与了儿童ALL的发病,两因子的表达定量对疾病的评估和治疗有重要临床指导意义。

