miR-497-5p-ENAH对肝癌细胞侵袭运动的影响
慕刚刚 朱益洁 于红刚 李红艳
肝细胞癌(hepatocellular carcinoma,HCC)在我国是最常见的恶性肿瘤之一,发生率和病死率呈上升趋势,肝癌早期发现困难,目前5年生存率只有10.1%[1,2]。对于肝癌发生的机制研究、靶向治疗分子的研究仍是目前研究的重点。
ENAH(enabled homolog)是Ena/VASP蛋白家族一员,Ena/VASP在调控细胞侵袭和转移过程中的形态改变、细胞黏附等发面发挥关键作用[3]。ENAH调控于肌动蛋白,参与癌细胞运动、细胞间黏附、极化发生。之前研究发现ENAH在多种恶性肿瘤中呈现高表达,包括结直肠癌、宫颈癌、胃癌及胰腺癌等,而且ENAH与肿瘤高侵袭性、恶性预后明显相关[4~6]。ENAH是多个肿瘤信号通路的关键靶基因,例如Wnt/β-Catenin信号通路轴、PPARγ信号轴[7]。Enah可以分化为不同亚基蛋白,例如在原发肿瘤中高表达而在转移癌缺乏的亚基,具有侵袭性的亚基蛋白(Mena++、MenaINV)[8]。
本研究发现肝癌组织中ENAH呈现高表达,ENAH与肝癌患者预后有显著相关性,其上游has-miR-497-5p可下调肝癌细胞ENAH的表达,并且通过下调ENAH来抑制paxillin介导的细胞极化、黏着斑成熟及细胞运动。
材料与方法
1.实验对象:收集2018年1月~2019年6月于笔者医院肝癌切除标本(癌及癌旁组织),本研究通过武汉大学人民医院医学伦理学委员会的批准。
2.细胞及试剂:人肝癌细胞HepG2购自中国科学院典型培养物保藏委员会细胞库,HepG2培养用DMEM(10% FBS,5%双抗),37℃孵育箱传代培养。试验用试剂包括抗体有ENAH、GAPDH购自美国Santa Cruz公司,paxillin及磷酸化paxillin -tyr 31抗体购自美国Invitrogen公司,羊抗兔IgG(H+L)、F(ab′)2 Fragment(Alexa Fluor®555 Conjugate)、Acti-stainTM488 Fluorescent Phalloidin购自美国CST公司;miRNA Taqman 探针、Taqman miRNA Multiplex RT Assays 试剂盒均购自美国Applied Biosystems公司。
3.Oncomine数据库:Oncomine是开放的癌症基因芯片数据库和整合数据挖掘平台。本研究设置条件为Analysis Type: Liver cancer vs. Normal Analysis;Data Type: mRNA;over-expression,Gene: ENAH。通过在线分析ENAH在不同肿瘤中及肝癌中的表达差异。
4.The Human Protein Atlas数据库:该数据库也称人类蛋白表达图谱,是研究蛋白在人体正常组织、癌组织和癌细胞系中免疫组化染色状态,可进行肿瘤组织蛋白差异表达分析,并且可进行基因与肿瘤的生存分析。本研究中,对ENAH蛋白在人肝癌组织中免疫组化分析,ENAH与肝癌患者预后进行生存分析。
5.组织蛋白提取及免疫印迹:肝癌、癌旁组织标本经剪碎、研磨,裂解液充分裂解,提取总蛋白,并经过BCA法测定蛋白浓度。免疫印迹过程:取20μg蛋白加入SDS-PAGE上样孔,并电泳分离后电转移至NC膜,采用10% BSA溶液封闭后用一抗4℃孵育过夜,TBST清洗后加入HRP标记的二抗孵育4~6h(4℃),经ECL法显色后X线胶片曝光并采集图片。
6.组织RNA提取及测定:术后30min内通过液氮罐收集新鲜的临床肝癌、癌旁组织,-80℃冰箱较长期保存备用。参照Trizol RNA提取试剂盒提取组织总RNA,DEPC水溶解,测定RNA纯度和浓度,并取1μl RNA经凝胶电泳测定完整性,进行后续RT-PCR。
7.RT-PCR反应: 依据相关试剂盒操作说明书的步骤操作,应用Primer premier 6.0 软件设计hsa-miR-497-5p 的上游引物、下游引物、反转录引物序列,本研究采用U6为内参。反转录反应体系为:RNA 2μl,引物 1μl,dNTP mix 1μl, U6反转录引物1μl,反转录酶1μl,RNA酶抑制剂0.5μl,无酶水 9.5μl,设定条件:16℃ 15min,16℃ 15min,42℃ 60min,85℃ 5min,4℃ 5min。qT-PCR采用SYBR法测定miR-6838-5p的Ct值,U6为内参照,反应体系为:混合物(25μl): 引物 2μl,ddH2O 8.5μl,SYBR 12.5μl,cDNA 2μl,条件:95℃ 30s,1个循环,95℃ 5s,60℃ 30s,40个循环。
8.免疫荧光:将(2~3)×104个/毫升 miR-497-5p mimic转染后的HepG2单细胞悬液接种在盖玻片上,经细胞培养至单层。细胞进行免疫荧光试验,PBS洗涤3次,4%甲醛固定15min,0.3% Triton-X 100/PBS透膜15min,5% BSA/PBS+血清封闭1h。加入1∶100稀释的兔抗paxillin一抗溶液,4℃孵育过夜;,再用1∶1000羊抗兔IgG(H+L),F(ab′)2 Fragment荧光二抗及1∶200的Acti-stainTM488 Fluorescent Phalloidin抗体孵育1h,DAPI染核,置于Olympus 正置荧光显微镜下观察。
9.免疫组化染色及评分:手术切除新鲜肝癌及癌旁组织,经10%多聚甲醛固定48h后,常规制作石蜡切片,常规HE,首先进行抗原修复,修复温度99℃、修复时间30min,然后进行免疫组织化学染色(ENAH抗体购自美国Santa Cruz公司)。评分:组织切片免疫组织化学评分=染色强度分×阳性细胞着色比例分,结果分为阴性:不着色,弱着色,着色细胞<25%;阳性:中等着色,着色细胞25%~50%;强阳性:强着色,着色细胞>50%。

结 果
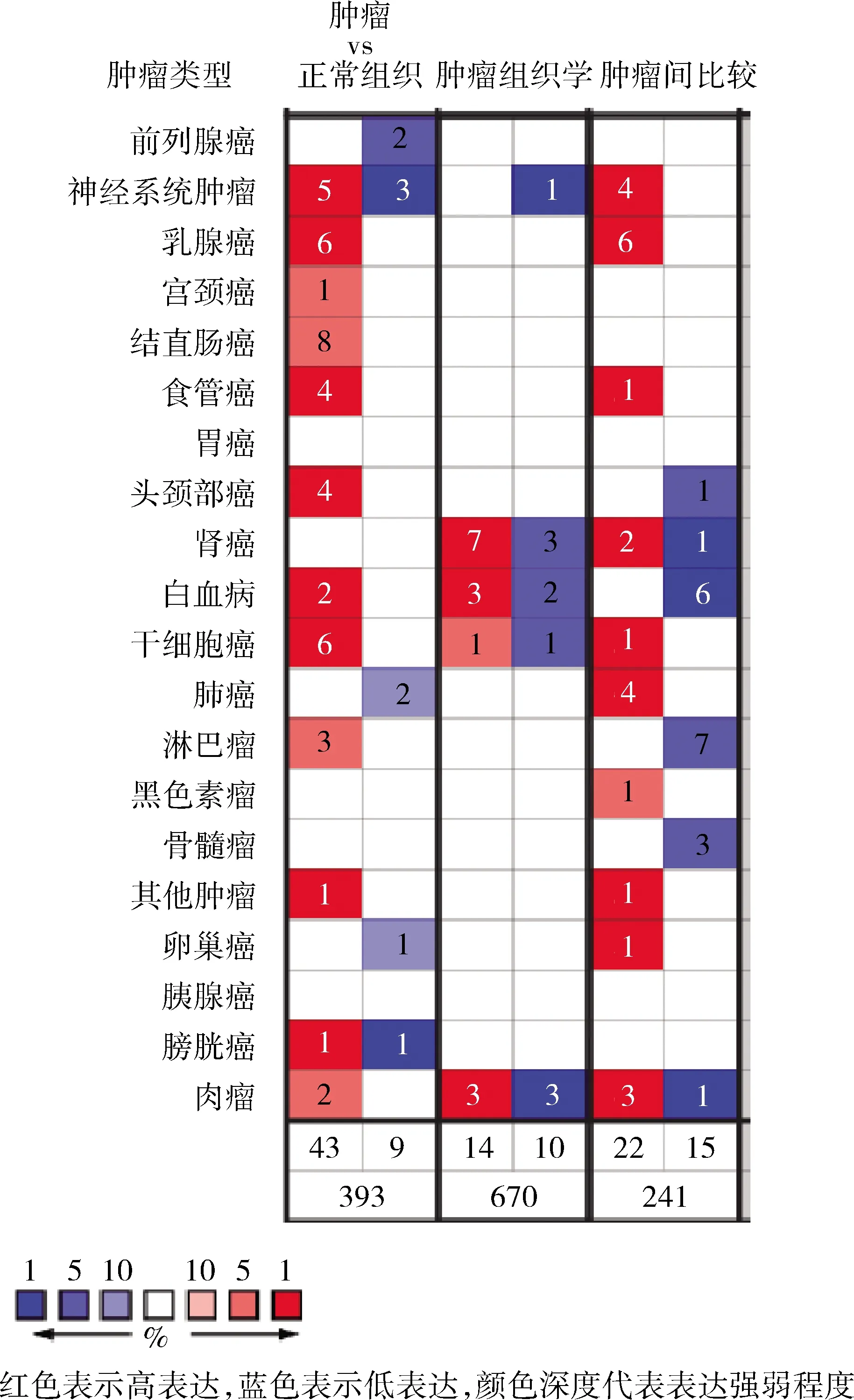
图1 Oncomine数据库中ENAH蛋白在所有肿瘤中的差异表达分析
1.Oncomine数据库分析ENAH在人体各肿瘤中的差异表达:Oncomine数据库中设定搜索条件“gene:ENAH,P-VALUE:1×10-4;FOLD CHANGE:2;GENE RANK:Top 10%;DATA TYPE:all”,ENAH蛋白在大多数肿瘤中呈现高表达趋势,仅在部分膀胱癌、肺癌、卵巢癌中呈现低表达,这表明ENAH的表达存在不同肿瘤间差异性。本研究关注的肝癌组织中,ENAH在6个肝癌数据集均呈现明显高表达(图1)。
2.Meta分析ENAH在肝癌中差异表达:通过Oncomine在线分析,设定筛选条件“Gene:ENAH,Analysis Type: Cancer vs Normal Analysis;Cancer Type: Liver Cancer;Data Type: mRNA;P-VALUE:1×10-4;FOLD CHANGE:2;GENE RANK:Top 10%”。共有5个数据库满足筛选:Chen liver(cancer:105例,normal=75,P=2.26×10-25),Roessler liver(cancer:22例,normal=21,P=3.06×10-12),Mas liver(cancer:38例,normal=19,P=6.27×10-8),Roessler liver 2(cancer:225例,normal=220,P=2.67×10-81),Wurmbach liver(cancer:35例,normal=10,P=6.23×10-8)[9~12]。通过Meta分析证实ENAH在上述5个数据库中呈过表达趋势,ENAH mRNA显著高于对照组,P=3.11×10-8,Median Rank 146.5(图2)。

图2 Oncomine数据库分析ENAH在肝癌中的表达差异
3.ENAH在肝癌组织中病理表达:Human Protein Altas数据库,通过免疫组化在线分析ENAH蛋白在肝细胞癌、胆管细胞癌组织中的表达及胞内定位。采用ENAH抗体(No.HPA028696),免疫组化提示大部分肝细胞癌、胆管细胞癌组织中ENAH表达呈现中、高等强度(肝癌组织 vs 癌旁肝组织:强阳性11 vs 0,阳性23 vs 8,阴性5 vs 29,P<0.05)。IHC提示ENAH蛋白在肝癌细胞内主要分布在胞质、胞膜,这与ENAH主要调控细胞运动相关的肌红蛋白有关(图3、表1)。
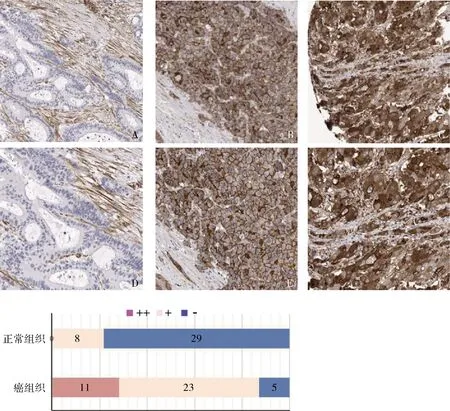
图3 ENAH在肝癌组织中的IHC分析A、D.正常肝组织;B、E.胆管细胞癌;C、F.肝细胞癌;A~C.放大倍数为40倍;D~F.放大倍数为100倍

表1 通过免疫组化染色分析ENAH在肝癌组织中表达差异
4.肝癌的ENAH生存分析:收集新鲜肝癌组织、癌旁组织,裂解提取总蛋白,通过Western blot法试验同样证实ENAH蛋白在肝细胞癌、胆管细胞癌中呈现显著高表达, 显著高于癌旁的正常肝组织(图4A)。同样,与正常肝细胞L-O2比较,其他不同肝癌细胞中ENAH均呈现明显的过表达。通过分析TCCG数据库的已有数据,对ENAH进行生存分析,ENAH低表达患者的预后佳(P<0.05)。

图4 ENAH在肝癌组织中表达及生存分析A.肝癌及癌旁组织中的ENAH蛋白表达;B.肝癌细胞系中ENAH蛋白表达差异;C.ENAH蛋白表达与肝癌患者预后的生存分析。N.正常肝组织;T.肝癌组织,*P<0.05
5.has-miR-497-5p抑制ENAH表达及paxillin介导的细胞极化、黏着斑形成:通过软件Targetscan预测ENAH的调控microRNA为miR-497-5p,ENAH的3′UTR第198-204碱基位点与miR-497-5p结合。在肝癌组织中,提取总RNA后通过RT-PCR分析发现肝癌中miR-497-5p水平明显低于癌旁肝组织。在肝癌细胞HepG2中,通过miR-497-5p inhibitor和miR-497-5p mimic分别抑制、增强细胞的miR-497-5p的表达,miR-497-5p mimic诱发的miR-497-5p高表达,间接抑制细胞间黏着斑结构蛋白paxillin的31位点酪氨酸磷酸化(图5)。
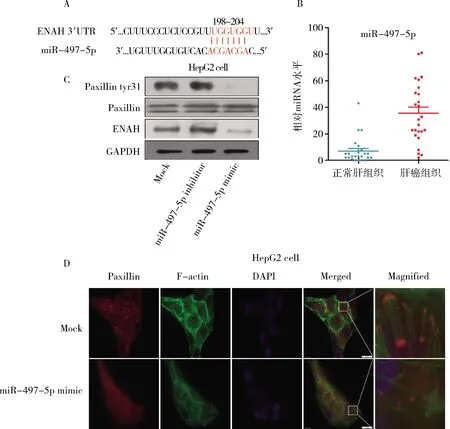
图5 has-miR-497-5p抑制ENAH表达及paxillin介导的细胞极化、黏着斑形成(绿色荧光,×400)A.miR-497-5p与ENAH结合位点;B.肝癌组织与正常肝组织的miR-497-5p水平比较;C.miR-497-5p抑制HepG2细胞ENAH蛋白表达、paxillin酪氨酸磷酸化;D.miR-497-5p抑制paxillin介导的HepG2细胞骨架微结构极化、细胞黏着斑形成及成熟
为进一步观察miR-497-5p对细胞骨架微结构、黏着斑形成及成熟的影响,将HepG2细胞进行铺片培养,miR-497-5p mimic转染干预细胞miR-497-5p的表达,免疫荧光观察细胞骨架微结构改变(F-actin为标志蛋白)、细胞间黏着斑形成及成熟(paxillin为标志蛋白)的变化。miR-497-5p mimic抑制miR-497-5p,细胞的paxillin磷酸化受抑制,细胞间黏着斑形成及成熟受限,黏着斑以小为主,散布在胞质、胞膜,与之对应的细胞骨架微结构较紊乱,无明显方向性及集束、聚集发生。而对照组的HepG2细胞中,F-actin标志的细胞骨架微结构发生明显聚集、极化,并向较大的成熟黏着斑聚集、附着,细胞的运动能力明显高于miR-497-5p mimic干预组。
讨 论
ENAH系Ena/VASP蛋白复合物(enabled/vasodilator stimulated phosphoprotein)家族成员,ENAH结合EVL、VASP蛋白形成肌动蛋白调控单位,定位于细胞引导端、黏着斑及伪足,而且通过偶联Integrin α5亚基的胞质C末端,促进细胞侵袭、运动[13]。在多种肿瘤的研究中,已经证实ENAH呈明显过表达趋势,包括肝细胞癌、胃癌、结直肠癌、唾液腺癌、胰腺癌、乳腺癌[14~19]。HU的肝癌研究表明,肝癌细胞中ENAH过表达与肿瘤的分化、进展、预后密切相关,本研究中也证实ENAH在肝癌细胞、胆管细胞癌中明显高表达,而且高表达ENAH提示肿瘤侵袭力增强和更差的预后,前期发现ENAH过表达促进肿瘤EMT、肝纤维化的进展。本研究生存分析也证实,高表达ENAH肝癌患者预后更差,后期研究可以探索ENAH作为肝癌预后的生物学预测标志物。
前期研究指出ENAH主要影响细胞肌动蛋白极化、促进细胞突出或伪足形成、EGF诱导的细胞运动,进而调控细胞的黏附和运动[13]。本研究发现,通过miR-497-5p抑制肝癌细胞内ENAH的表达,间接抑制了HepG2细胞的细胞骨架微结构中肌动蛋白的极化、细胞间黏着斑的成熟及细胞运动。一项ENAH在胃癌的研究表明,ENAH通过激活MAPK(Erk1/2)、AKT信号通路、NF-κB信号通路调控胃癌细胞的增殖、运动,同样ENAH也可促进癌细胞上皮细胞间叶样转变(EMT),ENAH被敲低表达后,癌细胞EMT相关标志蛋白发生改变:E-cadherin蛋白下调,Vimentin和Fibronectin表达上调,细胞EMT化受到明显抑制。癌细胞的EMT经典调控信号通路包括TGF-β、Wnt/β-catenin和Notch信号通路轴,而敲低ENAH可以有效抑制上述信号通路的激活,并且在结肠癌、乳腺癌、肝癌细胞中都得到不同程度的验证[20,21]。
microRNAs(miRNAs)是一类小分子非编码RNAs,主要抑制基因的转录表达,参与细胞分裂、血管生成、代谢的生物学调控,而且调控肿瘤的发生、进展[22]。miR-497-5p位于染色体17p13.1的位置,系miR-15/16/195/424/497簇的一员,该microRNA簇家族5′端包含AGCAGC序列,在细胞中高度保守。miR-497 目前进行了多种肿瘤的观察研究,在血管肉瘤、子宫内膜癌、非小细胞肺癌、结肠癌、乳腺癌中已证实miR-497发挥抑癌基因的作用,例如miR-497通过Bcl-2诱导乳腺癌细胞的凋亡,在卵巢癌中miR-497抑制PXN2蛋白表达,抑制肿瘤侵袭,通过调控Raf-1HE CCND1的蛋白表达抑制乳腺癌细胞的增殖和侵袭运动。本研究中肝癌组织中miR-497-5p水平显著低于正常肝组织,miR-497-5p能够抑制ENAH的表达,最终抑制肝癌细胞HepG2的细胞极化、黏着斑形成及成熟,抑制细胞的运动、侵袭。
生物信息学是一门新兴学科,它整合了生物学、数学、计算机不同学科的优势,对肿瘤大样本数据进行整合挖掘,数据包括高通量基因、蛋白组学、转录组学数据等。分析肿瘤中基因、蛋白、转录、甲基化等生物调控微小单元的变化,并预测肿瘤表达的差异基因等,从而找出肿瘤治疗的新靶点。本研究中涉及的Oncomine、Human Protein Atlas数据库包括了世界上最大的TCGA、病理数据库,包含了目前为止最大的肝癌临床样本量,所有数据来源于基因芯片,研究方法一致,因此结论具有极高的可信度。本研究通过生物信息学计算,筛选出肝癌与正常肝组织的差异表达基因ENAH,并对其病理表达、预后生存分析,验证了其调控microRNA has-miR-497-5p抑制ENAH表达,并间接抑制肝癌细胞的细胞骨架微结构极化、细胞间黏着斑的形成及成熟,最终抑制肝癌细胞的运动、侵袭。

