S100A4和S100A6在成骨细胞和破骨细胞分化中表达及意义
袁赤亭 洪 盾 朱丽君 李紫嫣
骨质疏松是不同原因引起的,以单位体积内骨量减少为特点的代谢性骨病变。临床表现以骨骼疼痛、易于骨折为特征;病理解剖可见骨小梁变细、 断裂、 稀疏萎缩,骨皮质多孔、变薄[1]。骨是复杂的组织,不断地通过破骨细胞吸收旧骨和成骨细胞形成新骨,保持动态平衡。破骨细胞介导的骨吸收和成骨细胞介导的骨形成是决定骨量两个重要的因素;如两者失衡,会导致骨质疏松、骨软骨病、骨硬化病等骨相关疾病[2]。
研究报道S100蛋白与成骨细胞分化方面有着密切关系[3]。S100蛋白在1965年被首先发现,因其在中性饱和硫酸铵中溶解率100%而命名,相对分子质量为9~13kDa,是一种钙结合蛋白家族,只在脊椎动物中表达。具有两个EF手模序结构,分别位于羧基端和氨基末端;氨基末端EF手是这个家族所特有的,由于S100蛋白家族成员具有不同结构,导致具有不同功能[4]。研究发现S100蛋白既具有细胞内功能,也有细胞外功能作用[5]。Duarte等[6]研究发现S100A4蛋白在成骨诱导分化及矿物质吸收过程中起负性调节作用。Hong等[7]研究发现S100蛋白随着地塞米松浓度作用而表达升高,主要发现S100A4和S100A6等。S100A4和S100A6在骨代谢方面是研究的焦点,但S100A4和S100A6蛋白对骨代谢的作用机制未阐明,有待于进一步研究和探索。因此本研究探讨S100A4和S100A6 mRNA与成骨和破骨细胞分化的相关性研究。
材料与方法
1.实验材料与试剂:EDTA(上海捷瑞生物工程有限公司),胰酶(美国Sigma-Aldrich公司),TRIzol(美国Life Technologies公司),7300 real time PCR 系统(美国Applied Biosystems公司),SYBR Green Masrer Mix(瑞士Roche公司),引物(上海捷瑞生物工程有限公司),反转录试剂盒(瑞士Thermo Scientific公司)。
2.MC3T3-E1细胞培养:将MC3T3-E1细胞培养在10%小牛血清的а-MEM培养液的培养瓶中,置于5%CO2及37℃保湿的温箱中,定期换液,等细胞生长到密度为90%左右,吸出细胞培养液,用灭菌PBS清洗3次,加入适量含0.02%EDTA的0.25%胰酶消化30~60s后,加入适量培养基终止消化,反复吹打细胞,使其细胞分散,将其移至离心管后,室温1000r/min 5min,吸出上清液,加入适量培养基后,将其吹打成细胞悬液,以1∶2接种到新培养瓶中,置于5%CO2及37℃保湿的温箱中培养。
3.茜素红染色:MC3T3-E1细胞被分成成骨诱导组和对照组,等培养瓶中MC3T3-E1细胞生长密度为90%左右时,用 PBS 轻缓清洗细胞表面3次,胰酶消化、培养基终止、离心、收集,向离心管中加入适量新鲜培养基,吹散细胞后混匀,按1×105/ml密度接种到6孔板上,在有或无成骨诱导液的培养基中培养3、7、14和21天。弃去培养基,PBS清洗3次,用90%冰乙醇固定、PBS清洗3次,加入茜素红染液,置于37℃温箱中孵育10min。用无菌PBS轻缓清洗细胞表面3次,静置5分钟/次;显微镜下观察、拍照,收集、整理。
4.碱性磷酸酶染色:MC3T3-E1细胞被分成成骨诱导组和对照组。等培养瓶中MC3T3-E1细胞生长密度为90%左右时,胰酶消化、培养基终止、离心,向离心管中加入适量新鲜培养基,吹散细胞后混匀,按1×105/ml密度接种到6孔板上,在有或无成骨诱导液的培养基中培养3、7、14和21天。弃去培养基,用无菌PBS轻缓清洗细胞表面3次,静置5分钟/次;用碱性磷酸酶试剂盒中固定液固定1min。用无菌PBS轻缓清洗细胞表面3次,静置5分钟/次;加入碱性磷酸酶染色液,置于37℃温箱中孵育45min。用无菌PBS轻缓清洗细胞表面3次,静置5分钟/次;显微镜下观察、拍照,收集、整理。
5.总RNA提取和real time RT-PCR:等培养的MC3T3-E1细胞密度及状态均良好时,弃去培养基,用无菌PBS轻柔清冼细胞表面3次,用含有血清的新鲜培养基终止消化,在室温下离心(1000r/min、5min),再用无菌PBS清洗后离心,收集细胞。总RNA提取用TRIzol方法,具体提取过程根据试剂说明书。通过测量在260nm和280nm处吸光度RNA浓度和纯度。根据反转录试剂盒说明书,用提取的1μl 总RNA反转录得到cDNA。通过7300 real time PCR 系统检测目的基因mRNA表达情况,引物的设计详见表1。PCR扩增是通过20μl混合体系(1μl cDNA和0.05μmol/L引物,10μl SYBR Green Masrer Mix)中完成,反应温度条件如下:58℃反转录在2min,95℃反转录酶失活10min,40个循环扩增(95℃ 15s,60℃ 1min),根据熔解曲线分析判断PCR结果的特异性。通过7300 real time PCR系统收集PCR结果数据。
6.RAW264.7细胞培养:将RAW264.7细胞培养在10%小牛血清的a-MEM培养液的培养瓶中,置于5%CO2及37℃保湿的温箱中,等细胞生长到密度为90%左右,吸出细胞培养液,用灭菌PBS清洗3次,加入适量含0.02%EDTA的0.25%胰酶消化30~60s后,显微镜下观察,等见到细胞单层收缩突起出现空隙时,加入适量培养基终止消化,反复吹打细胞,使其细胞分散,将其移至离心管后,室温1000r/min 5min,吸出上清液,加入适量培养基后,将其吹打成细胞悬液,以1∶2接种到新培养瓶中,置于5%CO2及37℃保湿的温箱中培养。

表1 目的基因引物等相关情况
7.TRAP染色:RAW264.7细胞分成破骨细胞诱导组和对照组,按1×105/ml密度接种到6孔板上。RAW264.7细胞在有破骨细胞诱导液(50ng/ml RANKL和25ng/ml M-CSF)的培养基中培养1、3和5天时,去掉上清液,用 PBS 轻缓清洗细胞表面3次,加入多聚甲醛固定20min,然后TRAP避光染色2h,用 PBS 轻缓清洗细胞表面3次,显微镜下观察、拍照,收集、整理及统计图片。
8.总RNA提取和real time RT-PCR:RAW264.7细胞分成破骨细胞诱导组和对照组,按1×105/ml密度接种到6孔板上。RAW264.7细胞在有破骨细胞诱导液(50ng/ml RANKL和25ng/ml M-CSF)的培养基中培养1、3和5天时,收集各时间段细胞,引物的设计详见表1,通过real time RT-PCR的方法检测S100A4、S100A6及TRAP mRNA等表达情况,收集、整理和统计数据(表2)。

表2 目的基因引物相关情况

结 果
1.茜素红染色结果:成骨诱导组MC3T3细胞诱导3和7天时未出现钙结节,14天时出现散在较小不典型结节,21天时出现数量较多以及直径较大典型钙结节。对照组培养过程中始终未出现典型钙结节(图1)。

图1 MC3T3-E1细胞诱导3、7、14及21天时茜素红染色结果(×100)A.成骨诱导组;B.对照组
2.碱性磷酸酶染色结果:成骨诱导组MC3T3细胞诱导3天时基本上无阳性,7天时少数散在细胞阳性,14天时阳性细胞较多及表达较高,21天时出现阳性细胞较多,但较14天时阳性率及阳性强度减弱。对照组MC3T3-E1细胞培养过程中无阳性反应(图2)。

图2 MC3T3-E1细胞诱导3、7、14及21天时ALP染色结果(×100)A.成骨诱导组;B.对照组
3.MC3T3-E1细胞成骨诱导中细胞real time RT-RCR结果:与未加诱导液组作为对照,MC3T3-E1细胞诱导3、7和14天时,S100A4 和RANKL mRNA表达逐渐减弱,而诱导21天时S100A4 和RANKL mRNA表达比14天时要增加;S100A6 mRNA表达在诱导7和14天时较低,在3和21天时表达逐渐较高;ALP 和RUNX2 mRNA在3、7和14天时表达逐渐增加,之后出现减弱趋势;OPG mRNA 表达逐渐减弱。S100A4、S100A6、OPG、RANKL、ALP及RUNX2在各时间段比较差异均有统计学意义(P<0.05,图3)。

图3 S100A4、S100A6、OPG、RANKL、ALP和RUNX2 mRNA表达结果A.S100A4;B.S100A6;C.OPG;D.RANKL;E.ALP;F.RUNX2
4.TRAP染色结果:RAW264.7细胞在分化5天时,出现典型TRAP染色结果(图4)。
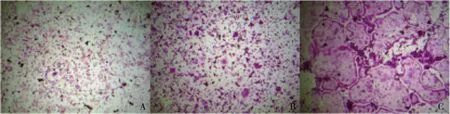
图4 RAW264.7细胞分化TRAP染色结果(×100)A.1天;B.3天;C.5天
5.RAW264.7细胞分化中real time RT-RCR结果:与未加诱导液对照,随着RAW264.7细胞逐渐分化, TRAP mRNA表达逐渐增加,S100A4 mRNA表达逐渐增加,S100A6 mRNA表达逐渐下降。S100A4和TRAP 3天和5天比较,差异有统计学意义(P<0.05),而S100A6在1天和3天比较,差异有统计学意义(P<0.05,图5)。

图5 S100A4、S100A6 和 TRAP mRNA在破骨细胞形成各时间段时表达结果A.S100A4;B.S100A6;C.TRAP
讨 论
原发性骨质疏松是骨吸收和骨形成平衡受到破坏,骨吸收明显增加,是一种全身代谢性疾病,包括绝经后、老年性和特发性等3种,是一种以骨量减少及骨组织结构变化,导致骨脆性增加及骨折风险增加的全身代谢性骨病。随着生活水平提高,老龄化越来越严重,骨质疏松患病率不断升高而备受人们的重视[8,9]。原发性骨质疏松是由多种基因-环境因素等微小作用积累的共同结果,但具体发病机制尚未完全阐明,主要表现为破骨细胞功能增强或成骨细胞功能减弱,导致骨骼形成减少或骨骼破坏增加而引起骨质疏松。
研究发现S100蛋白可能参与调节骨形成或骨吸收[10]。Yoshida等[11]研究发现S100蛋白可增加可溶性RAGE,从而直接或间接参与sRANKL诱导的破骨细胞生成。Kato等[12]用siRNA抑制牙周韧带细胞中S100A4蛋白后,发现骨钙素(osteocalcin)和骨保护素(osteoprotegerin)等成骨相关因子表达减弱,矿物质化受到抑制,推测S100A4蛋白与牙周韧带细胞成骨分化及矿物质化有关。本研究通过检测S100A4和S100A6 mRNA在成骨细胞和破骨细胞分化中表达的变化,探讨S100A4和S100A6骨形成与骨吸收的关系。
本研究中茜素红染色和ALP染色结果提示MC3T3-E1细胞成骨诱导分化成功,然后在转录水平检测了S100和成骨相关因子等表达情况。与对照组比较,ALP 和RUNX2 mRNA在诱导3、7和14天时表达逐渐增加,之后出现减弱趋势。根据本实验ALP mRNA表达结果和实验时间点跨度的选择,考虑诱导10天左右时ALP mRNA表达可能出现最高峰,这样与理论水平基本一致;RUNX2是一类参与调控成骨的特异性转录因子,在成骨细胞分化中早期阶段高表达,到晚期出现下降趋势,与本实验结果相符合[13,14]。
本实验发现诱导早期时细胞中OPG mRNA表达均比对照组高,但呈逐渐下降趋势,晚期表达与对照组比较差异无统计学意义;成骨诱导早期RNAKL表达趋势与OPG一样,晚期表达出现升高趋势;OPG属于肿瘤坏死因子受体家族成员,在成骨细胞中高表达[15];理论上OPG在成骨细胞分化中表达逐渐升高,但实际上OPG表达和分泌受到其他基因的正负调控,以及MC3T3-E1细胞分化过程中可能会分泌下调OPG表达的细胞因子或其他成分,从而出现OPG表达变化量在减少;对照组晚期出现钙结节,提示部分MC3T3细胞已经分化为成骨细胞,导致OPG表达升高,因此在诱导晚期出现诱导组和对照组OPG表达差异无统计学意义;RANKL表达在一定程度上受到OPG及其他成骨相关因子影响,因此本实验OPG和RANKL结果与实际情况相符合。最后,笔者发现S100A4 mRNA在诱导3、7和14天时表达逐渐减弱,之后出现增加趋势,但与对照组比较,仍是下降趋势。S100A6 mRNA在诱导3天和21天较高,在诱导7天和14天较低,无明显时间依赖性变化。本研究S100A4结果与Duarte等[6]研究发现S100A4蛋白在成骨细胞分化及矿物质吸收过程中起负性调节作用的结果基本相符合。而S100A6蛋白在成骨诱导分化中目前暂无相关文献报道。因此根据实验结果,笔者推测S100A4蛋白参与调控成骨诱导分化过程,而S100A6蛋白可能与成骨诱导分化过程中某个时期相关。
本实验进一步检测S100A4和S100A6 mRNA在RAW264.7细胞分化过程中表达情况。笔者发现TRAP在RAW264.7细胞诱导破骨细胞过程中表达逐渐增加,具有时间依赖性;TRAP是破骨细胞形成的相关因子,主要由破骨细胞分泌,代表破骨细胞活性,在分化晚期表达最高,因此TRAP结果与实际情况相符合。与未加诱导液比较,S100A4 mRNA在破骨细胞形成过程中表达逐渐升高,在分化晚期差异有统计学意义;S100A6 mRNA 在破骨细胞形成过程中表达逐渐下降,但始终比对照组高,在分化早期差异有统计学意义。Yoshida等[11]研究发现S100蛋白可增加可溶性RAGE,从而直接或间接参与sRANKL诱导的破骨细胞生成。综合研究结果和相关文献报道,本研究推测S100A4和S100A6蛋白可能参与调控破骨细胞过程。
综上所述,S100蛋白可能参与调控绝经后骨质疏松症的发病机制。本研究从转录水平上检测S100A4和S100A6蛋白在成骨细胞和破骨细胞形成中表达结果,笔者推测S100A4蛋白既参与调控成骨过程,又参与调控破骨过程;而S100A6可能仅参与调控破骨过程,今后将进一步探讨S100A4和S100A6蛋白对绝经后骨质疏松的作用机制,以及在临床上验证S100A4和S100A6蛋白在骨质疏松标本中表达及意义。

