脂联素对脓毒症小鼠脑损伤的保护作用及机制
张占琴 王 强
脓毒症是一种由机体对感染的反应失调引发危及生命的多器官功能障碍的致死性疾病[1]。据流行病学报道,脓毒症患者约占总住院患者的2%,在重症监护病房(intensive care unit,ICU)中其所占比例为30.2%,病死率高达55.7%[2]。脓毒症患者常常出现神经系统并发症,其与患者疾病的严重性和预后密切相关[3]。脓毒症脑病(sepsis-associated encephalopathy,SAE)是脓毒症最常见的中枢神经系统并发症,目前SAE的发生率尚无定论,国外有研究报道其发生率可高达70%[4]。SAE可发生在脓毒症的任何阶段,主要临床常表现为精神活动的延迟,注意力、定向力受损等,临床统计显示脑功能损伤和患者预后呈正相关, 转入ICU时存在昏迷的脓毒症患者病死率高达60%,SAE是预测患者病死率的独立风险因素,合并SAE显著增加脓毒症的治疗难度[5]。此外,Iwashyna等[6]对脓毒症存活患者进行长达3年的随访,发现依然有17%患者发生中、重度认知功能障碍。因此积极治疗SAE对降低脓毒症患者病死率及改善预后具有重要意义。
有研究表明,脂联素缺乏增加促炎性细胞因子表达,血清中低脂联素浓度与脓毒症的严重程度具有负相关性,然而脂联素是否具有改善脓毒症脑损伤的作用尚未可知[7]。脂联素可引起肌细胞线粒体数量增加,脓毒症患者普遍存在线粒体抗氧化能力下降和活性氧、自由基过度产生,最终导致线粒体氧化还原平衡失衡,而脂联素对脓毒症脑损伤的保护作用是否与改善线粒体功能有关,这一问题仍有待研究[8,9]。本研究应用脂联素对脓毒症模型小鼠进行干预,探讨脂联素治疗对脓毒症脑损伤发挥的效应,以期为脂联素应用于SAE患者提供实验理论依据。
材料与方法
1.实验动物:6~8周龄SPF级雄性C57BL/6小鼠,体质量22~25g,购自西安交通大学动物实验中心,购买后适应性喂养3天,予自由饮食饮水。所有动物实验遵循国家所制定的有关实验动物保护和使用的指南,并经西安交通大学实验动物伦理学委员会批准通过。
2.主要试剂:脂多糖(lipopolysaccharide,LPS)(Escherichia Coli O55:B5,美国Sigma 公司);脂联素(以色列ProSpec公司);活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide diamutase,SOD)检测试剂盒(上海碧云天生物技术有限公司);凋亡相关蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关蛋白(B-cell lymphoma 2-Associated X,Bax)、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved caspase-3)和β-actin一抗(武汉三鹰生物技术有限公司)。
3.分组、模型制备和标本采集:168只SPF级雄性C57BL/6小鼠,采用数字表法随机分为空白对照组(CON组)、脂联素对照组(APN组)、脓毒症模型组(LPS组)、脂联素干预组(LPS + APN组)。参照文献[10]方法采用腹腔注射LPS 15mg/kg制备脓毒症脑病模型,CON组腹腔注射等量0.9%氯化钠注射液,LPS组侧脑室注射等量0.9%氯化钠注射液,LPS+APN组造模后30min给予侧脑室注射APN 0.1μg/g。一部分小鼠(每组10只)造模24h后于麻醉下断头取大脑,迅速分离大脑组织,取左侧大脑海马切面置于40g/L多聚甲醛溶液中固定,右侧海马组织液氮速冻后转于-80℃ 冰箱保存待用。其余小鼠(每组16只)造模后2周采用旷场实验和跳台实验对小鼠进行行为学实验,实验完毕后处死小鼠。本研究中动物处置方法符合动物伦理学标准。
4.旷场实验:取一个长50cm×50cm×50cm的旷场,箱底划分为25个方格,造模后2周将小鼠(n=16)放入旷场中心方格内,在旷场上方安置摄像机,记录5min内小鼠跨格数和站立次数。每次实验后清理小鼠留在旷场中的粪便。共进行为期2天的测试,第1天为训练期,第2天为试验期。由于动物对于再次进入同一个熟悉场景具有适应性的特性,该测试对跨格数和站立次数的统计分析主要用来评估训练期的运动表现和试验期的非空间学习记忆能力。
5.跳台实验:造模后2周进行为期2天的跳台实验(n=16),训练期将小鼠放入跳台反射箱,适应3min后将其移上安全台,然后底部电栅栏通电,小鼠被电击2s后取出,并记录其从平台跳下来的时间,训练期内如果该动物未跳下平台则弃之不用。试验期(24h后)将动物再次放在平台上,观察3min,记录小鼠从平台跳下所需的时间,即跳台潜伏期。如果动物跳下平台时受到电击,再次放置于平台后动物可形成记忆而不跳下平台,跳台潜伏期常被用来作为评价学习记忆能力的重要指标。
6.苏木精-伊红(hemotoxylin and eosin,HE)染色观察皮质病理改变: 造模24h后分离大脑组织(n=5),取左侧大脑海马切面经40g/L多聚甲醛固定后,常规脱水、透明、石蜡包埋,海马组织切片后行HE染色,正置显微镜下采集数据并拍照。
7.海马线粒体ROS、MDA、SOD检测:造模24h后取右侧海马组织(n=5),按先前方法提取线粒体,裂解液重悬后BCA法测定蛋白水平后备用[11]。将线粒体悬液稀释至蛋白质量浓度为1mg/ml,取50μl线粒体悬液加入反应液,酶标仪行定量检测,按相应的说明书步骤操作,酶标仪读取吸光度值,按公式计算出数值后分别除以相应蛋白浓度即得各样本ROS、MDA、SOD水平。
8.海马Bcl-2、Bax、cyt-c、cleaved caspase-3蛋白表达的检测: 造模24h后取右侧海马组织(n=5),提取海马总蛋白制备上样样品,聚丙烯酰胺凝胶电泳后,将蛋白电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉室温封闭1h。相继孵育相应的一抗和二抗之后,经Bio-Rad凝胶成像系统扫描获得图像。

结 果
1.各组小鼠行为学特征:造模后2周采用旷场实验(n=16)和跳台实验(n=16)对4组小鼠进行行为学实验。在旷场实验中,跨格数和站立次数的统计用来反应动物开发新环境的运动能力。训练期各组小鼠间的跨格数和站立次数比较,差异无统计学意义(P>0.05)。与训练期比较,试验期CON组和APN组跨格数和站立次数显著减少(P<0.01),表明小鼠具有良好的记忆能力。与训练期比较,LPS组小鼠跨格数和站立次数并未有明显改变,脂联素干预(LPS+APN组)后,小鼠跨格数和站立次数减少(P<0.01)。在跳台实验中,训练期各组小鼠从跳台跳下来的时间比较,差异无统计学意义(P>0.05)。与训练期比较,试验期CON组和APN组跳台潜伏期显著延长(P<0.01),同样表明小鼠具有良好的记忆能力。在试验期,与CON组比较,LPS组跳台潜伏期延迟显著降低,提示记忆受损(P<0.01);与LPS组比较,脂联素干预(LPS+APN)组可显著延长潜伏期(P<0.05),详见图1。

图1 4组小鼠旷场实验和跳台实验行为学特征(n=16)A.旷场实验;B.跳台实验;与训练期比较,#P<0.01
2.各组小鼠海马形态学改变:选取海马CA1区进行形态学观察,CON组和APN组小鼠神经细胞形态结构清晰,细胞排列规则致密,神经元胞质丰富,胞核大而圆,核仁清楚(图2中A、B);LPS组可见细胞结构不清,神经元数量减少,神经元空泡样改变,核固缩、深染(图2C);与LPS组比较,LPS+APN组多数细胞结构清晰,神经元数量明显增多,发生空泡样变、核固缩以及深染的神经元减少(图2D)。

图2 4组小鼠海马形态学改变(n=5,HE染色,×400)A.CON组;B.APN组;C.LPS组;D.LPS+APN组
3.各组小鼠海马氧化损伤情况:与CON组比较,LPS组小鼠海马线粒体ROS和MDA水平升高,SOD活力下降,差异均有统计学意义(ROS:P<0.05;MDA:P<0.01;SOD:P=0.000);与LPS组比较,LPS+APN组线粒体ROS和MDA水平下降,SOD活力增强,差异均有统计学意义(ROS:P<0.05;MDA:P<0.05;SOD:P=0.000),详见表1。

表1 4组小鼠海马线粒体ROS、MDA和SOD表达情况
与CON组比较,*P<0.05,**P<0.01,***P=0.000;与LPS组比较,#P<0.05,##P=0.000
4.各组小鼠海马凋亡相关蛋白的表达情况:造模24h后取右侧海马组织检测凋亡相关蛋白表达,与CON组比较,LPS组小鼠海马Bcl-2表达下降(P=0.000),Bax和cleaved caspase-3表达升高(Bax:P=0.000;cleaved caspase-3:P<0.01);与LPS组比较,LPS+APN组小鼠海马Bcl-2表达升高(P=0.000),Bax和cleaved caspase-3表达下降(Bax:P<0.01;cleaved caspase-3:P<0.01),详见图3和表2。
讨 论
脂联素是良好的胰岛素增敏剂,抗炎调节剂和抗动脉粥样硬化分子,脂联素缺乏增加促炎性细胞因子表达,放大肥胖和脓毒症中促炎表型,补充脂联素后通过调控氧化/硝化应激反应减轻LPS所致脓毒症炎症性肺损伤和心肌损伤程度等,其可能成为改善脓毒症相关脏器功能损伤以及预后的潜在治疗靶点或药物[12,13]。SAE发生率高,治疗难度大,然而其病理生理机制尚不十分明确且未有突破性进展[5,14,15]。目前已经公认腹腔注射LPS能够普遍引起脑损伤,本研究采用腹腔注射LPS制备脓毒症模型,探索脂联素对脓毒症脑损伤的作用及机制。结果显示LPS组和LPS+APN组小鼠HE染色见空泡样变、核固缩以及深染等病理改变,提示LPS可引起脓毒症小鼠脑组织损伤。与LPS组比较,LPS+APN组空泡样变、核固缩以及深染等病理改变有所减轻,且使用脂联素干预后LPS+APN组小鼠在旷场和跳台实验中表现出的学习记忆能力有所改善,表明脂联素对脓毒症小鼠脑组织损伤具有一定的保护作用。
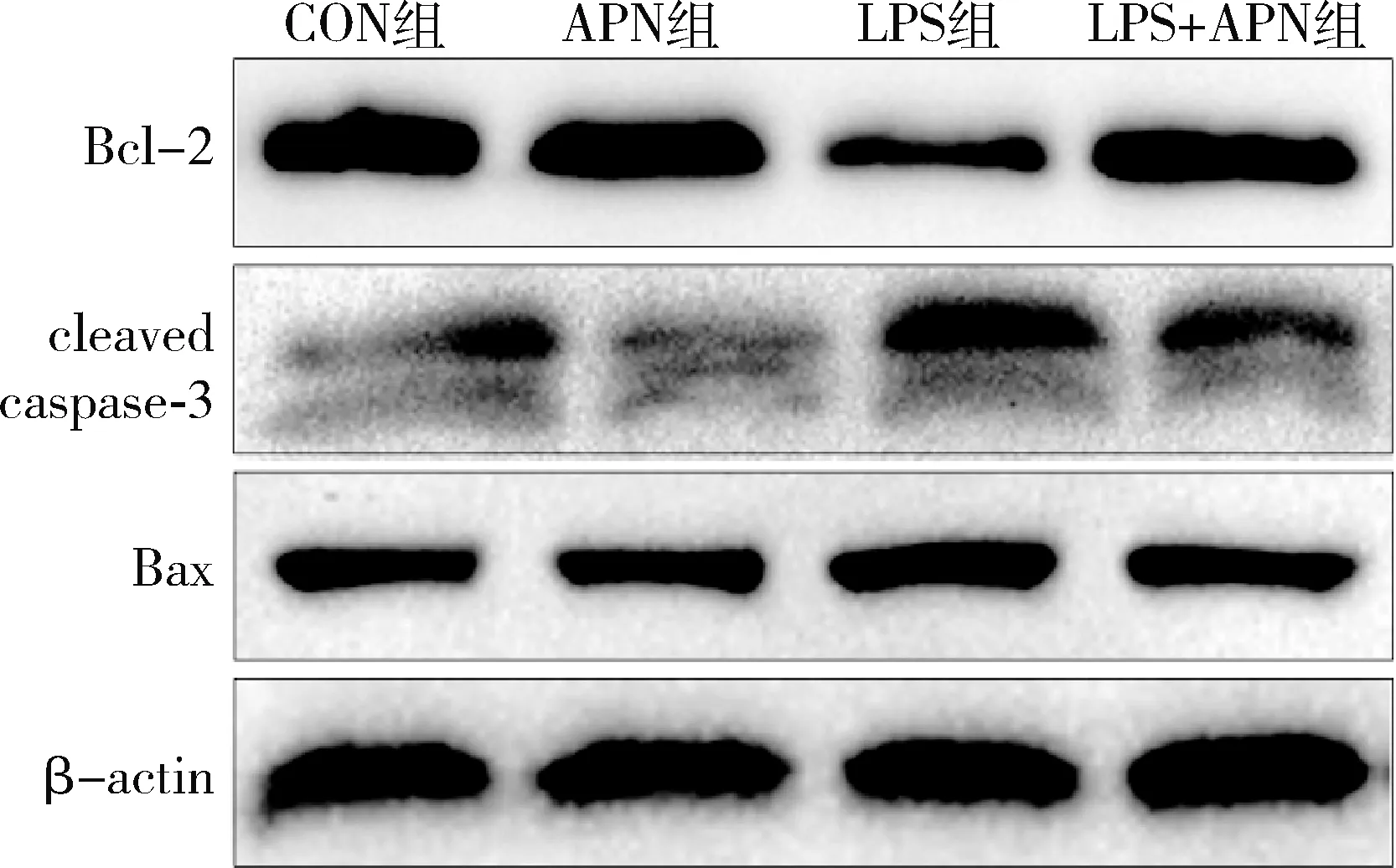
图3 4组小鼠海马内Bcl-2、cleaved caspase-3和Bax蛋白表达

表2 各组细胞中Bcl-2、cleaved caspase-3和Bax蛋白表达
与CON组比较,*P<0.05,**P<0.01,***P=0.000;与LPS组比较,#P<0.01,##P=0.000
已有研究表明ROS生成增多、氧化应激和细胞凋亡等与SAE的发生、发展密切相关[9,16]。线粒体作为细胞的能量工厂,不仅参与细胞能量供应、钙稳态调节、氧化应激、凋亡等生理过程,更为重要的是,汇聚于线粒体的各种细胞信号通路以及线粒体释放的各种关键因子,是决定细胞存活的最终通路[17]。脂联素通过脂联素受体1诱导细胞外Ca2+内流、激活Ca2+/CaMKKβ、AMPK和SIRT1和减少PGC-1α乙酰化,最终引起肌细胞线粒体数量增加,这些研究结果提示脂联素在改善线粒体功能方面具有重要作用[8]。本研究结果显示,脓毒症小鼠海马线粒体中ROS和脂质过氧化产物MDA生成增多,而抗氧化酶SOD活力下降,提示脓毒症脑组织损伤发生时线粒体氧化应激明显增强。APN干预后,海马线粒体中ROS和MDA水平降低,而SOD活力增强,说明脂联素可减少脓毒症小鼠海马线粒体氧化应激,从而发挥抗氧化保护作用。
线粒体是过量ROS产生后的主要促凋亡靶点,ROS大量产生引起线粒体膜脂质过氧化、线粒体膜上蛋白质和线粒体DNA氧化损伤,随后线粒体膜通透性增加和线粒体通透性转换孔开放使Ca2+、Cyt-c、凋亡诱导因子AIF等大量释放,激活pro-caspase-9进而触发caspases级联效应引起细胞凋亡[18]。过量的活性氧也可使线粒体电子传递链解偶联,下调ATP产生水平,上调促凋亡蛋白Bax的表达水平,最后使线粒体外膜破裂,导致细胞凋亡[19,20]。在本研究中,脓毒症小鼠海马凋亡细胞明显增多,且Bcl-2表达减少,而Bax和cleaved caspase-3表达增加,提示脓毒症脑损伤发生与线粒体凋亡通路激活有关,这与先前的其他研究结果一致[21,22]。虽然目前有相当多的证据表明脂联素及其受体在大脑中广泛表达,只有少数研究关注了脂联素在脑功能紊乱中的作用以及修饰脂联素信号通路的药物的治疗潜力,它们在脑疾病中的确切作用仍不十分清楚。本研究发现脂联素干预后,Bcl-2表达上调,而Bax和cleaved caspase-3表达减少,提示脂联素可通过抑制线粒体促凋亡通路激活在脓毒症脑损伤中发挥抗凋亡作用。
综上所述,本研究显示线粒体功能障碍和线粒体促凋亡通路激活可能参与了脓毒症脑损伤的发病过程,而脂联素则通过减少脓毒症小鼠海马线粒体氧化应激抑制线粒体促凋亡通路激活,从而在脓毒症脑损伤中发挥保护作用,为临床运用脂联素治疗SAE提供了实验依据。本研究只针对脂联素进行了探讨,而海马脂联素受体及其参与脂联素作用的具体分子机制仍不明确,有待于进一步研究。

