牙龈卟啉单胞菌感染的食管癌细胞外泌体中miRNA表达谱分析
朱梦玺,李洪超,王浩洁,徐娟娟,梁高峰,2,高社干,2
食管癌是一种发生在食管上皮组织的恶性肿瘤,是消化道中最具侵袭性的肿瘤之一,其发病率和死亡率分别居全球恶性肿瘤的第八位和第六位[1-3]。尽管对食管癌患者采用手术、放疗、化疗等综合治疗取得了一定的成效,但其预后较差,5 a生存率只有20%左右[4],极大地影响了人们的健康和生活质量。食管癌有两种主要的组织学亚型:食管鳞状细胞癌(esophageal squamous cell cancer,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC)。与西方国家不同,我国是ESCC的高发地区,尤其是华北太行山脉地区,每年食管癌新增的患病人数占世界总患病人数的50%,其中患有ESCC的人数高达90%以上[5]。然而食管癌的发病原因尚不清楚,据推测,其病因与摄入亚硝酸盐含量较高的腌菜和霉变食物,食用辛辣、滚烫的食物,吸烟、饮酒等不良的生活方式有关。近年来,越来越多的研究表明牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)与食管癌的发生发展密切相关。
P.gingivalis是一种口腔革兰氏阴性厌氧菌,可以入侵上皮细胞,干扰宿主的免疫应答和细胞周期,进而引起牙周疾病和慢性牙周炎[6]。最近,Gao S等确定了P.gingivalis存在于ESCC患者食管上皮,并证实了P.gingivalis感染与ESCC严重程度和不良预后之间呈正相关[7];Meng F等研究表明P.gingivalis可以促进ESCC细胞的增殖并诱导关键分子的表达[8]。然而P.gingivalis影响食管癌发生发展的具体机制尚不明确。
外泌体是细胞分泌的一类直径在30~100 nm、密度为1.13~1.19 g·mL-1的胞外囊泡,富含一些标志性蛋白(如CD9、CD63、CD81、TSG101、HSP70等),主要成分包括脂质、核酸、蛋白质等[9-10],广泛存在于多种体液中,如血清、血浆、唾液等[11-13]。作为细胞间的信息传递者,外泌体可与肿瘤微环境相互作用,从而介导肿瘤的发生发展。基于外泌体的这一特性,本研究通过高通量技术对P.gingivalis感染的KYSE-30细胞外泌体进行测序,并且从中分别选取10个上调和10个下调的miRNA,在miRDB、miRwalk、TargetScan、miRTarBase 数据库中预测其靶基因,并进行GO和KEGG富集分析,旨在研究P.gingivalis对食管癌细胞外泌体的miRNA表达谱及其相关信号通路的影响,并进一步探讨P.gingivalis与食管癌miRNA之间的关系,为研究P.gingivalis影响食管癌发生发展的相关机制奠定一定的理论基础。
1 材料与方法
1.1 细胞及菌株KYSE-30(人食管癌细胞系)购自中国科学院细胞库;P.gingivalis菌株 ATCC 33277购自美国模式生物培养库(American type culture collection,ATCC)。
1.2 细胞培养KYSE-30细胞及P.gingivalis感染的KYSE-30细胞在含有10% FBS(胎牛血清)、1%青霉素-链霉素的RPMI-1640培养液中培养,并放置于37 ℃、5% CO2的恒温细胞培养箱中常规培养。
1.3 细菌培养菌株ATCC 33277在含有5%羊血、1%氯化血红素和0.1%维生素K的GAM肉汤液体培养基中培养,并放置于37 ℃厌氧培养箱常规培养(85% N2、10% H2和5% CO2)。
1.4P.gingivalis感染KYSE-30细胞选取适量的活力较好的P.gingivalis菌液以MOI 10[14]的比例加入KYSE-30细胞培养基内,混匀即可(由于P.gingivalis为厌氧菌,在非厌氧环境中要尽可能快速操作以保证良好的细菌活力)。
1.5 外泌体的收集及Illumina HiSeqTM2500高通量测序分别收集KYSE-30细胞以及P.gingivalis感染的KYSE-30细胞的细胞培养液,采用超速离心法提取外泌体[15]。具体步骤如下:在4 ℃、2 000 g条件下低速离心10 min,去除细胞成分;将培养液上清在4 ℃、10 000 g条件下离心30 min,去除细胞碎片;取上一步的培养液上清,使用超速离心机在4 ℃、100 000 g条件下离心90 min,弃去上清液,用适量PBS(磷酸盐缓冲液)重悬外泌体。将上述所得的外泌体样品委托广州市锐博科技有限公司进行高通量测序,提取KYSE-30细胞外泌体以及P.gingivalis感染的KYSE-30细胞外泌体中的总RNA,并分离小片段RNA,构建文库,并在Illumina HiSeqTM2500平台进行测序。
1.6 miRNAs及关键靶基因的筛选从测序获得的miRNAs中分别筛选出10个上调的miRNA[log2(fold change) >1,P<0.05]和10个下调的miRNA[log2(fold change) <-1,P<0.05],将筛选出的miRNA 输入miRDB、miRwalk、TargetScan、miRTarBase 4个数据库中进行相关靶基因的预测,筛选出所预测靶基因的交集,使用STRING在线工具(https://string-db.org/)对靶基因做PPI网络分析,并使用Cytoscape 3.6.1软件的插件cytoNCA计算Degree、Betweenness、Closeness等属性值,并根据相关属性值筛选关键靶基因。
1.7 相关靶基因的GO和KEGG富集分析基因本体论(gene ontology,GO) 功能富集分析包括以下3种类型:分子功能 (molecular function,MF)、生物过程 (biological process,BP)、细胞组分 (cellular component,CC)。将上述所得到的靶基因输入Metascape在线分析工具[16](https://metascape.org/gp/index.html),根据P<0.01,最小计数为3,富集因子>1.5(富集因子是观察到的计数与偶然预期的计数之间的比率),进行GO功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG) 通路分析。
2 结果
2.1P.gingivalis感染的KYSE-30细胞外泌体中差异表达的miRNA根据高通量测序所获得的miRNA,以log2(fold change)>1,P<0.05为标准进行上调miRNA的筛选,log2(fold change) <-1,P<0.05为标准进行下调miRNA的筛选,各选10个miRNA并做miRNA上下调柱状图,结果如表1、图1所示,其中红色为上调miRNA,绿色为下调miRNA。
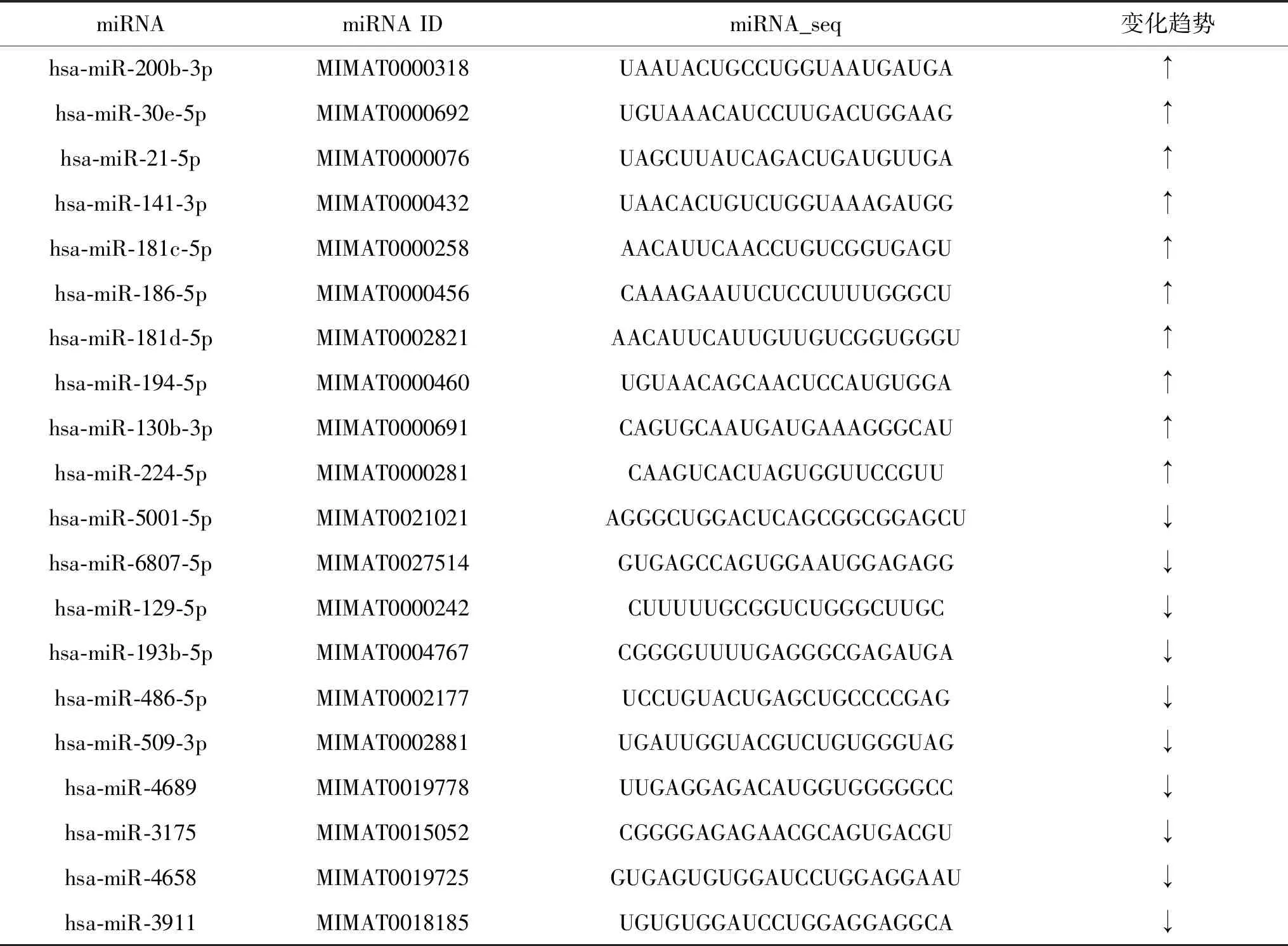
表1 20个差异表达miRNA的测序结果
注:“↑”表示上调,“↓”表示下调。
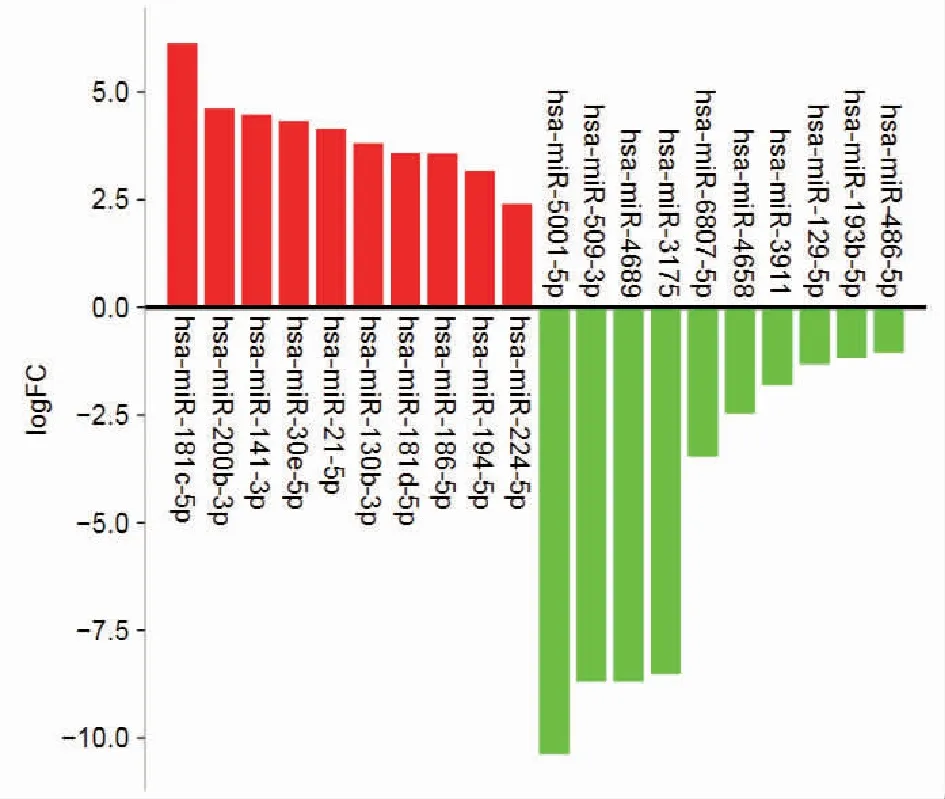
红色:上调miRNA,绿色:下调miRNA。图1 上调和下调的miRNAs
2.2 差异miRNAs与靶基因的相互作用将上述筛选出来的20个差异miRNA分别输入miRDB、miRwalk、TargetScan、miRTarBase 4个数据库中进行相关靶基因的预测,取4个数据库所预测的靶基因的交集,去掉重复项,共501个靶基因,绘制Venn图,结果如图2所示。使用STRING在线工具(https://string-db.org/)对靶基因做PPI网络分析,并使用Cytoscape 3.6.1软件的插件cytoNCA计算Degree、Betweenness、Closeness等属性值,并根据相关属性值筛选关键靶基因,其中关键靶基因的筛选如图3所示,筛选的关键靶基因如图4所示。
2.3 相关靶基因的GO和KEGG分析GO功能富集结果表明,差异miRNA相关靶基因共富集GO条目859条,其中分子功能占106条,生物过程占666条,细胞组分占87条,根据P值分别筛选出前20条通路(见图5-7),其中主要参与的分子功能(见图5)包括蛋白质结构域特异性结合、染色质结合、蛋白激酶结合、转录共调节因子活性、转录因子结合等;主要参与的生物过程(见图6)包括血管发育、超分子纤维组织、积极调控细胞迁移、蛋白质去磷酸化、水解酶活性的正调控、细胞形态发生参与分化等;主要参与的细胞组分(见图7)包括黏附连接、核体、皱褶、PcG蛋白复合物、细胞质区域等等。KEGG通路分析结果显示,差异miRNA靶基因富集的通路共有31条,富集程度较高的前20条通路(见图8)包括GnRH信号通路、TGF-β信号通路、Hippo信号通路、p53信号通路、Ras信号通路、mTOR信号通路、PI3K-Akt信号通路、细胞周期、细菌侵袭上皮细胞等。
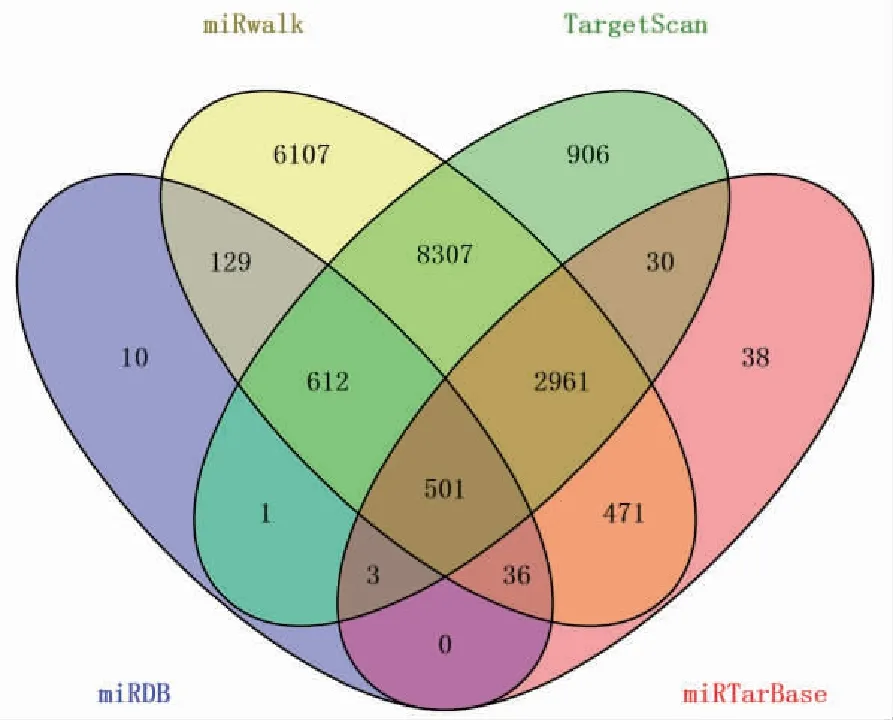
图2 根据4个数据预测的靶基因绘制的Venn图
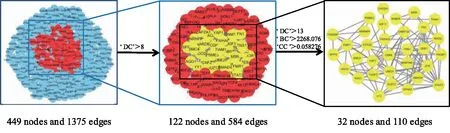
DC:Degree;BC:Betweenness Centrality;CC:Closeness Centrality。图3 关键靶基因的筛选示意图
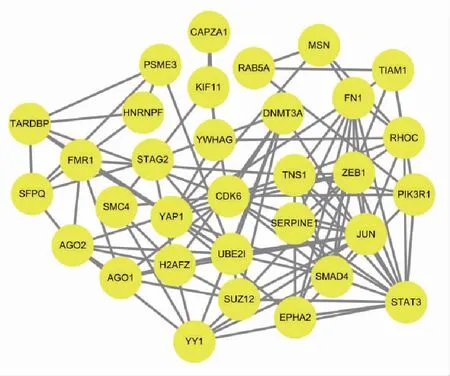
图4 筛选的关键靶基因
3 讨论
P.gingivalis是引起人类牙周炎的一种主要致病菌,相关研究表明,P.gingivalis感染能引起动脉粥样硬化、阿尔兹海默症。最近的研究发现P.gingivalis与食管癌密切相关[17],而且P.gingivalis有可能是食管癌的高危因素,然而P.gingivalis引起食管癌的相关机制尚有待进一步阐明。最近研究表明,肿瘤细胞来源外泌体在肿瘤的演进过程中发挥着重要作用[18]。作为一种纳米级(30~100 nm)的脂质双层膜囊泡,外泌体可携带多种功能性分子,如脂质、核酸、蛋白质等,在细胞间自由穿梭,介导细胞间的通讯和信号传递[19-20]。本研究通过高通量测序技术研究了P.gingivalis感染的KYSE-30细胞外泌体中的miRNA表达谱,得到一批差异表达的miRNA,通过对差异miRNA靶基因的预测及GO和KEGG富集分析,进一步研究P.gingivalis是如何影响食管癌的发生发展的。
经高通量测序获得的miRNA,以log2(fold change)>1,P<0.05及log2(fold change)<-1,P<0.05为标准分别筛选出10个上调和10个下调的差异表达的miRNA,并对其进行分析。通过miRDB、miRwalk、TargetScan、miRTarBase数据库对其相关靶基因进行预测,使用STRING以及Cytoscape 3.6.1软件的插件cytoNCA根据相关属性值筛选关键靶基因,并进行GO和KEGG分析。本研究初步筛选到的关键靶基因如图4所示,其中涉及STAT家族蛋白-STAT3以及与上皮-间质转化相关的重要调控因子-ZEB1,而邵艳等[21]的实验研究表明,STAT3与ZEB1在食管癌组织中的表达呈正相关,协同参与了食管癌的发展。这两种不同研究方式,得到的研究结果相吻合。因此可以推测,P.gingivalis可能通过影响食管癌细胞中STAT3和ZEB1蛋白的表达进而参与食管癌的发生发展。
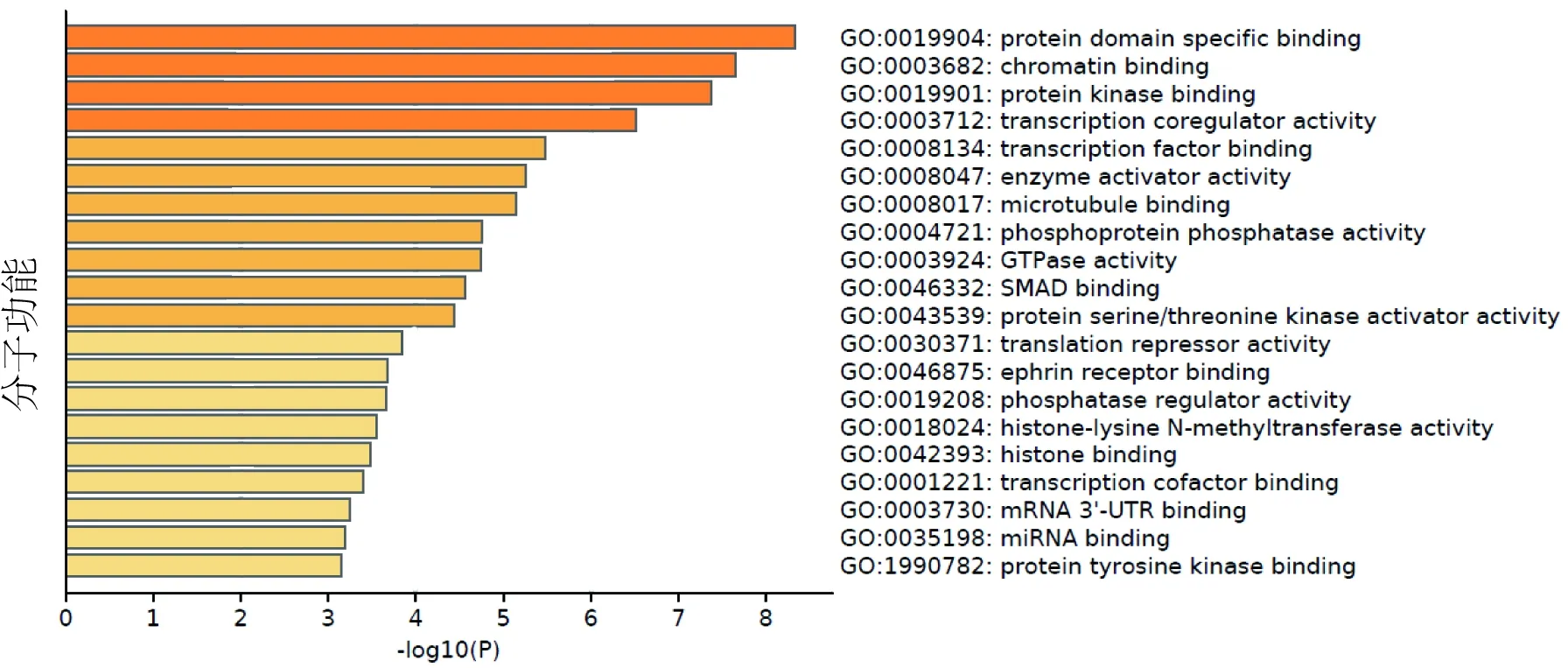
图5 GO富集分析-分子功能
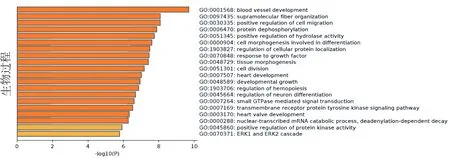
图6 GO富集分析-生物过程
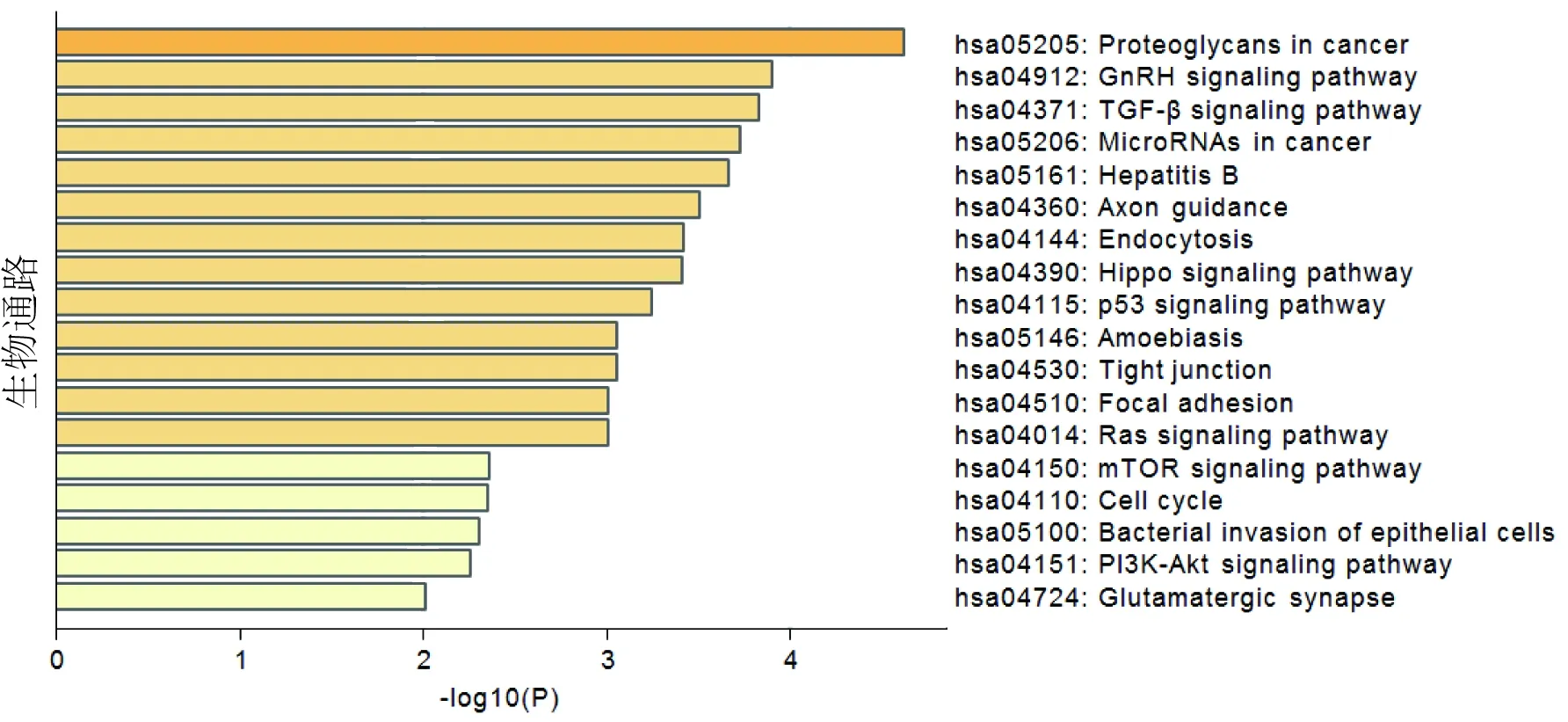
图8 KEGG 通路分析
此外, GO富集分析表明P.gingivalis感染的KYSE-30细胞中的外泌体中的差异miRNA相关靶基因参与血管生成、积极调控细胞迁移、蛋白质去磷酸化、细胞形态发生参与分化、小GTP酶介导的信号转导、跨膜受体蛋白酪氨酸激酶信号通路、ERK1和ERK2级联等生物学过程。众所周知,肿瘤的血管生成与肿瘤的生长及转移密不可分,根据GO分析可以推测,P.gingivalis可能通过参与食管癌血管的重建从而影响食管癌的进展。GO结果显示P.gingivalis感染的KYSE-30细胞中的外泌体中的差异miRNA相关靶基因可以积极调控细胞迁移,而本课题组前期通过实验表明TGF-β1/Smad2通路可能参与了P.gingivalis-Exo促进食管癌细胞的增殖、迁移和侵袭[22],这与GO富集结果相一致。根据生物信息学预测分析,发现P.gingivalis也可能通过影响SMAD4蛋白的表达进而参与食管癌的演进,作者后期将通过实验进一步验证这些结果。KEGG通路分析结果表明P.gingivalis感染的KYSE-30细胞中的外泌体中的差异miRNA相关靶基因的信号通路包括GnRH信号通路、TGF-β信号通路、Hippo信号通路、p53信号通路、Ras信号通路、mTOR信号通路、PI3K-Akt信号通路等。本课题组之前的研究结果也表明,P.gingivalis通过miR-194使GRHL3、 PTEN 的表达下调,进而使 PI3K-Akt的表达上调,从而促进ESCC细胞的增殖和迁移[14],其他通路作者后期也将进一步验证。
综上所述,本研究通过高通量技术对P.gingivalis感染的KYSE-30细胞中的外泌体进行测序,并对其差异表达的miRNA进行靶基因预测以及GO、KEGG富集分析,得到了一批差异表达的miRNAs及相关的信号通路。结果表明P.gingivalis可能通过影响食管癌外泌体miRNA的表达谱进一步调控相关的信号通路,参与食管癌的发生发展。
——外泌体与老年慢性疾病相关性的研究进展

