黑木耳多糖对非酒精性脂肪肝大鼠脂代谢的影响
张 赫,杨 柠,李家富,吴 迪,佟 月,沈 楠,张美超
(吉林医药学院:1.临床医学院,2.医学实验中心,吉林 吉林 132013)
非酒精性脂肪性肝(non-alcoholic fatty liver disease,NAFLD)是由除乙醇等其他明确损伤肝因素引起的,以肝细胞弥漫性脂肪变性为主的临床病理综合征。其病变过程是由非酒精性单纯性脂肪肝依次进展为非酒精性脂肪性肝炎、脂肪性肝纤维化和肝硬化,最终进展成肝细胞癌而死亡[1]。黑木耳多糖有D-甘露糖、D-半乳糖、D-木糖、D-葡萄糖及葡萄糖醛酸等多种重要成分,具有调节免疫力、抗血栓、抗氧化、调节血脂、降低动脉粥样硬化、降血糖等多种药理活性[2]。因此,本研究探讨黑木耳多糖对NAFLD大鼠脂代谢的影响,为黑木耳多糖调节脂代谢、改善肝脂肪变提供理论参考依据。
1 材料和方法
1.1 实验材料
黑木耳多糖(西安天瑞生物);洛伐他汀(郑州创美生物科技有限公司);脱氧胆酸钠(北京鼎国昌盛生物技术有限责任公司);胆固醇(北京鼎国昌盛生物技术有限责任公司);1,2-丙二醇(天津市大茂化学试剂厂);玉米油(长春市富民达榨油机械有限公司);奶粉(大庆乳品厂有限责任公司);蔗糖(天津市瑞金特化学品有限公司);总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒(南京建成生物工程研究所)。
1.2 主要仪器
PT-3502B酶标分析仪(北京普天新桥技术有限公司);电热恒温干燥箱(上海跃进医疗器械厂);全自动生化分析仪(德国贝克曼公司),普通高速离心机(德国Eppendorf);722分光光度计(上海分析仪器厂);PT-3502B酶标分析仪(北京普天新桥技术有限公司);电热恒温干燥箱(上海跃进医疗器械厂);普通高速离心机(德国Eppendorf);数显恒温水浴锅(金坛市江南仪器厂)。
1.3 高脂乳剂的配制
依据参考文献加以调整[3],分为水相和油相。水相:向烧杯里依次加入蒸馏水、蔗糖、脱氧胆酸钠及奶粉并搅拌均匀;油相:将先将1,2-丙二醇和玉米油倒入烧杯,将烧杯放入80 ℃恒温水浴箱内,再慢慢加入胆固醇,并用玻璃棒不停搅拌。最后将水相倒入油相,充分搅拌,即可得到脂肪乳胶。
1.4 动物分组及模型建立
Wistar雄性大鼠,体重为200~250 g(哈尔滨医科大学实验动物中心提供),适应性喂养7 d后开始进行实验。随机选取60只健康雄性大鼠适应性饲养1周,随机分为6组,分别为空白对照组,模型对照组,黑木耳多糖低、中、高剂量组(50、100、200 mg/kg)及洛伐他汀组(7.48 mg/kg)。除空白对照组外,其他组每日灌胃1次高脂乳剂(1 mL/100 g)。10 h后,给药组按1 mL/100 g分别灌胃相应药物,空白对照组及模型对照组灌胃同等体积的生理盐水,连续进行6周实验。
1.5 实验方法
实验结束前禁食不禁水8 h,称重大鼠,采用10%的水合氯醛腹腔麻醉大鼠,腹主动脉取血。一部分全血装入真空采血管,送检验科测载脂蛋白;另一部分装于离心管中,以2500 r/min离心15 min,分离获取适量血清,严格按照试剂盒规定检测并记录TG、TC、HDL-C、LDL-C的含量。
1.6 肝脏HE标本制备
分别取各组大鼠肝左叶相同部位、大小的肝组织,使用冰生理盐水洗净肝表面血迹,中性甲醛固定肝组织,石蜡包埋,常规切片及HE染色,光镜下观察各组大鼠肝组织的病变情况。
1.7 统计学分析

2 结 果
2.1 黑木耳多糖对大鼠肝湿重、肝指数的影响
与空白对照组相比,模型对照组大鼠肝湿重、肝指数均升高,其中肝湿重具有统计学意义(P<0.01)。与模型对照组相比,洛伐他汀组大鼠肝湿重、肝指数均下降(P<0.01);黑木耳多糖低、中、高剂量组大鼠肝湿重、肝指数均降低,其中,黑木耳多糖低、高剂量组肝湿重具有统计学意义(P<0.01),黑木耳多糖中、高剂量组肝指数具有统计学意义(P<0.01),且肝指数呈剂量依赖性下降,如表1所示。
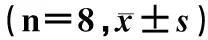
表 1 黑木耳多糖对大鼠肝湿重、肝指数的比较
与对照组比较,aP<0.01;与模型组比较,bP<0.01
2.2 大鼠肝组织形态学变化
如图1所示,空白对照组肝小叶结构完整,肝细胞形态正常;模型对照组肝小叶不完整,肝细胞可见明显的脂肪变,甚至见肝细胞坏死;洛伐他汀组肝小叶结构基本恢复正常,偶见肝细胞脂肪变;黑木耳多糖低、中、高剂量组肝小叶较为完整,偶见肝细胞脂肪变,组间变化不明显。
2.3 黑木耳多糖对载脂蛋白的影响
与空白对照组比较,模型对照组apoA1水平降低(P<0.01),apoB水平升高(P<0.01);与模型对照组比较,洛伐他汀组apoA1、apoB水平均降低(P<0.01);黑木耳多糖中剂量组apoA1水平降低(P<0.01),黑木耳多糖低、中、高剂量组apoB水平均降低,如表2所示。
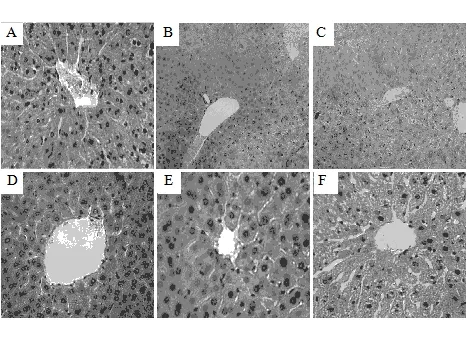
A:空白对照组;B:模型对照组;C:洛伐他汀组;D:黑木耳多糖低剂量组;E:黑木耳多糖中剂量组;F:黑木耳多糖高剂量组
图 1 黑木耳多糖对大鼠肝脏的影响

表 2 黑木耳多糖对大鼠载脂蛋白的影响
与对照组比较,aP<0.01;与模型组比较,bP<0.01
2.4 黑木耳多糖对大鼠血脂的影响
与空白对照组对比,模型对照组血清TG、TC含量均升高(P<0.01),LDL-C含量亦升高,HDL-C含量下降。与模型对照组对比,洛伐他汀组TG、TC含量均下降(P<0.05),LDL-C、HDL-C含量均升高;黑木耳多糖低、中、高剂量组TG、TC含量均下降(P<0.01),LDL-C水平下降,HDL-C组呈波动性改变,如表3所示。
3 讨 论
以往认为,肥胖是NAFLD病最常见的危险因素之一,且与脂肪肝形成最为密切。新近研究表明,并非肥胖程度越高越易诱发脂肪肝,体重指数正常的人群也可发生脂肪肝。与皮下脂肪性肥胖相比,内脏脂肪性肥胖与脂肪肝的形成密切相关。而肝指数是反映内脏脂肪性肥胖与脂肪肝关系的主要检测指标,与内脏脂肪性肥胖呈正相关。本研究发现:模型对照组大鼠肝指数较正常组明显升高,提示肝指数一定程度反映了肝脂肪变。洛伐他汀治疗有效。黑木耳多糖低、中、高剂量药物干预后,大鼠肝指数较模型组明显下降,且具有剂量依赖性,尤其中、高剂量组恢复肝指数程度相对明显。大鼠肝脏组织HE染色结果与此相似,黑木耳多糖低、中、高剂量组均具有明显的降低肝细胞脂肪变性程度的作用。结果表明黑木耳多糖具有改善肝细胞脂肪变性的药理作用。
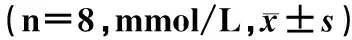
表 3 黑木耳多糖对大鼠血脂的影响
与对照组比较,aP<0.01;与模型组比较,bP<0.01
肝脂肪变是多种原因引起的肝细胞内脂质含量增多,特别是TG的堆积[4]。TC、TG、LDL-C的升高会促进脂肪肝的发展,HDL-C则会把动脉壁上及周围组织的胆固醇带到肝内代谢,阻止脂质在动脉壁和肝内积累,抑制脂肪肝的形成[5]。因此,脂代谢与TC、TG、LDL-C、HDL-C含量密切相关。本研究发现,洛伐他汀可使TG、TC水平下降,LDL-C、HDL-C水平升高;而黑木耳多糖低、中、高剂量组具有明显的降TG、TC水平,但降LDL-C作用不明显,而HDL-C呈波动性改变。这说明,黑木耳多糖的确可起到降血脂的目的,但其作用机制可能与洛伐他汀不同。
甘油三酯和胆固醇等的合成与分解主要在肝细胞中,线粒体为脂肪酸分解代谢β-氧化的主要场所,机体主要通过LDL-C受体途径和单核-吞噬细胞系统清除LDL-C等产物。但是,迄今为止,脂代谢异常的机制不明确。载脂蛋白在脂代谢过程中发挥着非常重要的作用。apoA1是肝脏产生HDL-C所需的载脂蛋白[6],逆转TC至肝脏也是经过apoA1实现的。apoB是肝脏产生LDL-C过程中所用的主要载脂蛋白,促进LDL-C将TC运送至外周血液。细胞膜上的LDL-C受体也可以经过apoB识别LDL-C并将LDL-C转入细胞内,所以apoB可以间接反映LDL-C水平[7]。本次研究发现:阳性药可降低apoA1、apoB的水平,而黑木耳多糖只有中剂量组表现出明显地抑制apoA1、apoB的水平[8]。以上说明,黑木耳多糖有部分通过载脂蛋白调控血脂代谢的作用。
总之,黑木耳多糖能改善脂肪变实验大鼠的一般状态,减轻肝内脂质沉积,改善肝脂肪变性程度,具有保护肝脏、调节血脂的作用,为NAFLD的干预及治疗提供新的理论依据。然而,黑木耳多糖对NAFLD大鼠血脂起效途径的具体机制仍需要进一步深入研究。

