鲤浮肿病毒RAA-LFD 检测方法的建立
吕晓楠,徐立蒲,张 文,曹 欢,王小亮,王 姝,王静波
(北京市水产技术推广站,北京 100176)
鲤浮肿病(Carp edema virus disease,CEVD),也称锦鲤昏睡病(Koi sleepy disease,KSD),是由一种痘病毒感染鲤、锦鲤引起的高度传染性流行病[1],其病原为鲤浮肿病毒(Carp edema virus,CEV)。患病鱼常出现烂鳃、凹眼、昏睡等症状,死亡率高达80%~100%,给水产养殖业造成严重经济损失[2-4]。该病已在全球迅速蔓延,我国在2016 年首次报道发生CEVD[5]。2018 年,CEVD 正式被农业农村部列为水生动物疫病监测对象,该病是我国一种新发水生动物疫病。
由于CEV尚无易感细胞系,其检测方法主要依赖于荧光定量PCR、套式PCR等分子生物学方法[6-9]。这些方法均需要对检测人员较高的技术要求,并难以满足非实验室等现场快速检测及基层普及应用。因此,有必要研究和建立快速、简便和适用于现场CEV 检测的新方法,以弥补现有方法的不足。
重组酶介导扩增法(Recombinase-aid amplification,RAA)[10]/重组酶聚合酶扩增法(Recombinase polymerase amplification,RPA)[11]等恒温核酸扩增技术的出现为CEV 快速诊断提供了新的手段。它们替代了PCR 高温变形循环过程,实现了在37 ℃~39 ℃常温条件下,快速、灵敏检测目的基因片段。依赖于特异性寡核苷酸引物或探针的侧向流试纸条(Lateral flow dipstick,LFD)的RAA/RPA具有灵敏度高、特异性强、检测时间短、肉眼读取结果、操作简便等优点。目前RAA/RPA快速检测方法已经应用于虾肝肠胞虫病(EHP)、传染性造血器官坏死病毒(IHNV)、对虾白班病毒(WSSV)和传染性皮下造血组织坏死性病毒(IHHNV)等水生动物病原检测领域[12-13]。SolimanH等采用RPA 技术建立了一种能够同时检测CEVD 和锦鲤疱疹病(KHVD)的试纸条[14],但该方法对我国流行CEVD 的检出效果尚不可知。
本研究以RAA 技术为基础,联合胶体金LFD 技术,建立一种在临床上能够快速、准确、特异地检测CEV 的方法,同时为鲤和锦鲤CEVD 的有效防控提供技术支持。
1 材料与方法
1.1 病毒株 鲤浮肿病毒(Carp edema virus,CEV)、锦鲤疱疹病毒(Kio herpesvirus,KHV)、金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus,GFHNV)、流行性造血器官坏死病毒(Epizootic haematopoietic necrosis,EHNV)、蛙虹彩病毒(Bohleiridovirus,BIV)、斑点叉尾鮰病毒(Channel catfish virus,CCV)由北京市水产技术推广站鉴定保存,对虾白斑综合征病毒(White spot syndrome virus,WSSV)、虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)标准品购自中国水产科学研究院黄海水产研究所。
1.2 主要试剂 RAA 基础型核酸扩增试剂盒、RAA 试纸条型核酸扩增试剂盒均购自杭州众测生物科技有限公司;DNA 抽提试剂盒、荧光QuantiNovaTMProbe PCR Kit 均 购 自QIAGEN 公 司;DNA 扩 增 试剂盒购自北京百泰克生物技术有限公司;LFD 购自杭州优思达生物技术有限公司,该试纸条设有抗FAM 抗体检测线和生物素化抗体质控。
1.3 质粒标准品的构建与鉴定 参照DNA 抽提试剂盒说明书,以提取的CEV 基因组DNA 为模板,根据CEV P4a 基因序列(MG550022.1),由北京天成新脉生物技术有限公司合成相应基因序列,克隆到pEASY-T1 载体,构建标准质粒pEASY-CEVP4a,经测序鉴定正确后,测定浓度并根据公式{质粒浓度(ng/μL)×10-9/[660×(质粒长度+载体长度)]}×6.023×1023=质粒拷贝数(拷贝/μL)换算为其拷贝数。
1.4 RAA 引物筛选 依据RAA 引物设计原则,以NCBI 数 据 库 中CEV P4a 基 因 序 列(MH645915.1、KX254001.1、KX254004.1、KX254003.1、KX253997.1、KX254001.1) 保守区域为靶位点,采用DNAMAN 6.0 软件进行序列比对分析,选取同源性高的片段,用Primer primer5.0 设计了4 对引物(表1)。利用标准质粒pEASY-CEVP4a(6×105拷贝/μL)作为模板,以RAA 基础型核酸扩增试剂盒对引物进行筛选。扩增反应参照试剂盒说明书进行,反应条件为37 ℃孵育30 min。反应结束后经1.5%琼脂糖凝胶电泳检测RAA 产物。按照RAA-LFD 引物及探针设计原则,选择扩增条带单一的1 对引物,对其下游引物和探针的5'端分别修饰6-羧基荧光素(6-FAM)和生物素(Biotin)。修饰后的引物及探针(CEV-2-nfo-F/R/P)用于后续RAA-LFD 方法的建立。以上引物及探针均由北京六合华大基因科技有限公司合成、标记,具体信息详见表1。
1.5 RAA-LFD 方法的优化及建立 所有优化试验均以标准质粒pEASY-CEVP4a(6×105拷贝/μL)为模板。采用方阵法对标记的引物(CEV-2-nfo-F/R)浓度(1 μmol/L、 5 μmol/L、 10 μmol/L、 50 μmol/L、100 μmol/L),反 应 温 度(25 ℃、34 ℃、37 ℃、40 ℃、45 ℃),反应时间(5 min、10 min、15 min、20 min、25 min)进行优化,反应体系参照RAA 试纸条型核酸扩增试剂盒。
所有优化试验的扩增产物均通过LFD 检测。为防止反应产物产生的气溶胶影响检测结果,本试验将50 μL RAA 反应产物直接放置于装置内,与装置自带液泡缓冲液充分混合后竖立在水平操作台上,3 min~5 min 后观察并拍照记录结果,选择阳性样品出现最强检测线和质控线而阴性样品不出现检测线仅出现质控线时的条件作为RAA-LFD 的优化条件。

表1 用于CEV 检测的引物及探针信息Table 1 Sequences of primers and probes for CEV detection
1.6 特异性试验 利用DNA 抽提试剂盒分别提取CEV、 KHV、GFHNV、EHNV、BIV、CCV、WSSV和EHP 的DNA,分别取100 ng 上述病毒DNA 为模板,利用已优化的条件进行RAA 扩增反应,在LFD上检测扩增产物,验证该方法的特异性。
1.7 敏感性试验 将构建的标准质粒pEASYCEVP4a 进行10 倍倍比稀释(6×108拷贝/μL~6×100拷贝/μL),分别以其为模板进行RAA-LFD、荧光定量PCR[8]检测,并比较两者的敏感性。RAA 扩增反应按照优化的反应条件进行,扩增产物经LFD 检测,确定该方法的敏感性。
1.8 重复性试验 选取6×105拷贝/μL 的标准质粒pEASY-CEVP4a 分为5 个标本同时检测。在第7 d 重复检测保存于-20 ℃的模板,利用已优化的条件进行RAA 扩增反应,在LFD 上检测扩增产物,分别进行批内和批间重复性试验。
1.9 临床样品检测 根据徐立蒲[2]报道的方法处理实验室保藏的60 份临床鲤和锦鲤(各30 份)组织样品(鱼的脑、脾、肾、鳃等)。利用DNA 抽提试剂盒提取样品核酸,应用本研究建立的CEV RAA-LFD方法和荧光定量PCR 方法[8]进行检测,比较两种方法的检测结果,并计算两者的符合率。同时利用SolimanH[14]建立的RPA 方法(简称SolimanH 法)对上述60 份临床样品进行检测。
2 结 果
2.1 引物的筛选结果 根据RAA 的引物设计原则共设计了4 对CEV 特异性引物,利用RAA 基础型核酸扩增试剂盒对引物进行筛选。结果显示,4 对引物均能够扩增出目的条带(图1),随机选择CEV-2-F/CEV-2-R 引物作为建立RAA-LFD 方法用的引物,并在下游引物和探针5'端分别标记FAM 和Biotin,用于后续LFD 检测扩增产物。
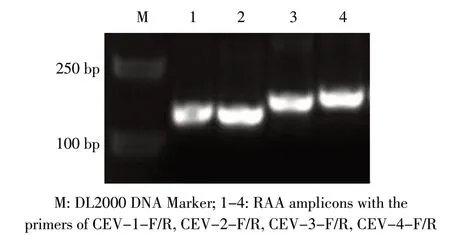
图1 CEV 的RAA 引 物 筛 选Fig.1 RAA primer screening for CEV detection
2.2 反应条件的优化结果 本研究对引物浓度、反应时间和反应温度分别进行了优化,综合各试验结果,最终确定引物浓度10 μmol/L、温度37 ℃、RAA反应10 min 作为最佳反应条件。
2.3 特异性试验 分别以KHV、GFHNV、EHNV、BIV、CCV、WSSV、EHP 的DNA 为模板检测RAALFD 方法的特异性。结果显示,仅以CEV 的DNA 为模板的RAA 扩增产物在试纸条上同时出现检测线和质控线,而其它病原的扩增产物仅出现质控线(图2),无检测线。表明该方法的特异性较强。

图2 检测CEV 的RAA-LFD 方法的特异性Fig.2 Specificity of the RAA-LFD assay for CEV detection
2.4 敏感性试验 采用10 倍倍比稀释的标准质粒pEASY-CEVP4a 作为模板,比较RAA-LFD 方法与荧光定量PCR 的敏感性。结果显示,RAA-LFD 检测方法对标准质粒pEASY-CEVP4a 的最低检出限为6×100拷贝/μL(图3A),与荧光定量PCR 的最低检出限相同(图3B)。表明本研究建立的RAA-LFD 具有较高的敏感性。
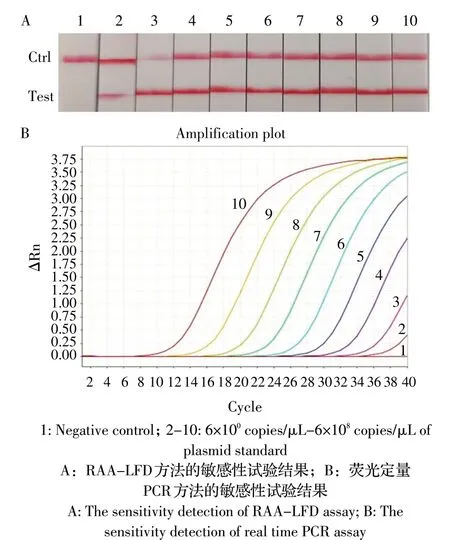
图3 检测CEV 的RAA-LFD 方法的敏感性Fig. 3 Sensitivity analysis of the RAA-LFD assay for CEV detection
2.5 重复性试验 选取了6×105拷贝/μL 的标准质粒pEASY-CEVP4a 进行组内和组间重复性试验,结果显示RAA-LFD 5 个平行样品目的片段均能够扩增,质控线和检测线均有条带产生。第7 d 进行组间重复性试验,CEV 得到了有效扩增,质控线和检测线均有条带产生。表明本研究建立的RAA-LFD法具有良好的重复性和稳定性。
2.6 临床样品检测 利用所建立的RAA-LFD 方法与荧光定量PCR 方法分别检测临床鲤和锦鲤组织样品60 份,结果显示RAA-LFD 检测出阳性样品49 份,阴性样品11 份;荧光定量PCR 检出阳性样品51 份,阴性9 份。两种方法的阳性符合率为96.08%。此外,SolimanH 法对同样60 临床样品检测出阳性样品21份,阴性样品39 份。
根据样品来源分析,对于30 份锦鲤来源的样品,本研究建立的RAA-LFD 和荧光定量PCR 阳性检出率均为26/30,而SolimanH 法的阳性检出率为21/30,SolimanH 法存在较大的漏检情况。SolimanH法更无法检出鲤来源的CEV 阳性样品,该方法阳性检出率为0。
综上表明,本研究建立的RAA-LFD 方法更适合应用于CEV 的现地检测。
3 讨 论
我国自2016 年徐立蒲等首次报道发生CEVD 以来,已陆续在北京、天津、广州、杭州、河南、云南等多地确诊了CEVD 的发生,其发病率显著高于鲤春病毒(SVCV)和KHV 等鲤和锦鲤的重大疫病病原[2-5,15],提示CEV 已经成为对我国鲤和锦鲤养殖业危害最严重的病原之一。因此,CEVD 的防治迫在眉睫。
建立准确、快速的现地检测方法,是有效防控CEVD 的保障。该病的临床症状和病理变化容易与KHVD 相混淆,尤其是CEV 与SVCV、KHV 发生混合感染时,更容易发生误诊,给CEVD 的临床诊断带来一定的困难。目前CEV 国内外没有统一的检测标准,通过实验室近年来的研究表明,现阶段对CEVD 的诊断主要采用流行特点、临床症状以及分子生物学检测相结合的方法。即当同池鱼仅鲤、锦鲤发病死亡,有烂鳃、凹眼、昏睡等症状时,荧光定量PCR 或套式PCR 检测CEV 阳性时,可判定发生CEVD。这与CEV 尚无易感宿主细胞、全基因序列和相应的蛋白等知之甚少有关。组织病理学和电镜观测病毒方法虽然直观有效,但是样品制备较为复杂,检测周期长;目前所有的分子生物学研究仅参考CEV P4a 部分基因,而Nest-PCR 方法(Oyamatus/CEFAS 建立)存在严重的漏检现象,且扩增产物电泳易产生气溶胶污染[3,6,16]。相比之下漏检率稍低的荧光定量PCR 则需要昂贵的检测设备和需要专业人员操作等。综上,上述方法均不适用于CEV 的现场快速检测。
RAA 是一种借助于重组酶、聚合酶和单链结合蛋白的新型等温扩增技术。与其它DNA 扩增技术相比,它不需要特殊设备即可在更短时间内和较低温度下扩增目的DNA 至可检测水平。LFD 技术是一种不需要昂贵和复杂仪器以及训练有素的人员即可操作的可视化检测工具。本研究联合两种技术,按照RAA 引物原则设计引物及探针,在其5'端分别进行6-羧基荧光素(6-FAM)和生物素(Biotin)标记,通过RAA 引物浓度、反应时间、温度等条件的优化,建立了一种适用于我国鲤和锦鲤养殖现场检测CEV的RAA-LFD 方法。该检测方法在34 ℃~40 ℃恒温反应10 min 即可实现对CEV 目的基因片段的有效扩增;操作简便,并与其它常见水生动物疫病病原DNA 无交叉反应;RAA 扩增产物直接用LFD 肉眼观察,最低检测限为6 拷贝/μL,敏感性与荧光PCR 相当;对60 份临床样本进行检测,两种方法符合率可达到96.08%,本研究建立的RAA-LFD 方法可用于CEV 的现地检测。
此外,本研究还采用SolimanH 法对我国鲤和锦鲤样品CEV 检测进行了评价。对实验室保藏的60 份临床样本RAA-LFD 检测中,锦鲤来源的CEV 阳性样本的检出率在70%;而鲤来源的CEV 阳性样本的检出率为0。综上表明SolimanH 法可能主要能够检测我国锦鲤CEV,而对于我国鲤的CEV 检测效果还有待进一步评价。从近年对CEV 的监测以及国内外已报道中发现Oyamatsu 构建的套式PCR 存在一定的漏检,而SolimanH 的RAA-LFD 引物也同样出自同样的片段,这提示P4a 的548 部分基因不够保守,本研究正是选取CEV P4a 保守部分(同荧光PCR 部分片段),优化建立快建方法,以满足我国鲤和锦鲤CEV 的现场快速检测需求,检测结果优于SolimanH法。此外,更加突显了开发或建立CEV 易感细胞系的迫切需求。
综上,本研究建立了CEV 的RAA-LFD 快速检测方法,操作简单、特异性好、灵敏度高,可直观地观察反应结果,特别适用在养殖现场等基层单位针对锦鲤进行CEV 快速检测,适合普及应用。该技术的应用将为CEVD 控制措施提供检测技术支撑。
——一道江苏高考题的奥秘解读和拓展

