花斑副沙鳅源致病性维氏气单胞菌的分离、鉴定及药物敏感性分析
高 通,王 均,汪开毓,贺 扬,樊 威,谢碧文,王永明,朱 婷,代小惠,张敏燕
(1. 内江师范学院“长江上游鱼类资源保护与利用”四川省重点实验室,四川 内江 641100;2. 四川农业大学 鱼病研究中心,四川 成都 611130;3. 四川省内江市农业科学院 水产研究所,四川 内江 641000;4. 四川农业大学 动物科技学院,四川 成都 611130)
鳅科是鲤亚目现有鱼类中的第二大科,在我国有18 个属约100 多个种或亚种,广泛分布于各大江河湖泊,因其具有较高的营养价值和经济价值,目前已经有多个种类被成功人工驯养。随着鳅科鱼类人工养殖的推广,疾病问题也日益凸显,目前已报道的疾病病原包括真菌、寄生虫、细菌和病毒等,其中细菌性病原危害最严重。然而,相比较于其它养殖鱼类,鳅科鱼类相关细菌性疾病研究报道较少。上世纪九十年代刘立人等初次报道由细菌性病原引起泥鳅的赤鳍病,随后黄军报道了泥鳅的细菌性肠炎,但未对其病原进行深入鉴定。郑曙明等最早对长薄鳅腐皮病的病原采用细菌分离培养、形态学观察和生理生化检测等方法进行了研究,确定了该病病原为嗜水气单胞菌和温和气单胞菌[1]。近年来,随着分子生物学技术的发展,越来越多鳅科鱼类的细菌性病原被鉴定报道,如泥鳅体表红点症的病原迟缓爱德华氏菌[2]、台湾泥鳅溃疡症的病原维氏气单胞菌[3]和似鲇高原鳅出血、溃疡症的病原温和气单胞菌[4]等。但是,随着鳅科鱼类的养殖种类逐渐增多,不同鳅科鱼类的病原也存在差异性,因此有必要全面了解不同鳅科鱼类的病原类别,为养殖鳅科鱼类的疾病防控奠定基础。
花斑副沙鳅(Parabotia fasciata Dabry)隶属鲤形目(Cypriniformes),鳅科(Cobitidae),副沙鳅属(Paramisgurnus),是一种在我国广泛分布的小型经济鱼类,属中国特有物种,与宽体沙鳅(Botia reevesae Chang)和中华沙鳅(Sinibotia superciliaris)等一并俗称为“花泥鳅”[5-6]。花斑副沙鳅其肉质鲜美,经济价值较高,同时具有一定观赏价值,但由于环境污染以及人工水利的修建,使其原有生境受到破坏,野生数量急剧减少[7]。为了保护生物多样性,从2011 年开始,“长江上游鱼类资源保护与利用”四川省重点实验室(以下简称重点实验室)开展了包括其移养驯化、人工繁殖、苗种培育和成鱼养殖等有关的产业化技术研究。但是,随着人工养殖技术的突破,疾病的危害也日渐凸显,如在人工养殖过程中苗种培育早期的车轮虫病,以及鱼苗孵化及各生长阶段出现的水霉病等[8]。但目前还未见关于其细菌性疾病感染的报道。
2017 年5 月,重点实验室养殖车间的花斑副沙鳅幼鳅出现大量死亡,主要症状为食欲减退、离群、游动缓慢或悬游,剖检后发现鳍条基部、鳃、肝脏和肾脏等器官广泛充血、出血,肠道发红伴随炎症。本研究通过病原分离、鉴定、回归试验、溶血性试验、毒力基因检测和药物敏感试验对该次发病花斑副沙鳅的病原进行了分析,确定了该致病菌的种类、致病性、毒力基因携带情况和药物敏感范围,为花斑副沙鳅产业化养殖过程中该疾病的防治提供了参考依据。
1 材料与方法
1.1 病料样品来源与实验动物 患病花斑副沙鳅来自“长江上游鱼类资源保护与利用”四川省重点实验室养殖车间,选取体表出血明显的患病鳅用于细菌接种。健康花斑副沙鳅由重点实验室提供,体质量5±0.5 g,于水族箱暂养7 d,暂养期间不投饵,连续充氧,水温25±2 ℃。
1.2 主要试剂 脑心浸液培养基(Brain Heart Infusion,BHI)购自北京欣经科生物技术有限公司;细菌生化微量鉴定管和药敏纸片购自杭州微生物试剂有限公司;2×Taq master mix 和细菌基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司。
1.3 病原菌分离纯化 按照无菌操作要求,采集患病花斑副沙鳅肝脏组织,在BHI 平板上划线,28 ℃恒温培养24 h~48 h,挑取形态一致的优势菌落,进一步划线纯化,获得纯培养菌株(XQS1),再转接到斜面培养基上,4 ℃保存备用。
1.4 分离菌的形态学观察及生理生化鉴定 将分离纯化细菌接种BHI琼脂平板,28 ℃培养24 h~48 h,观察细菌的生长特性与菌落形态,同时对菌体进行革兰氏染色,光学显微镜下观察形态特征。挑取单个菌落接种于微量生化管中,28 ℃下培养24 h~48 h,按照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》进行生理生化特性鉴定。
1.5 分离菌的溶血性检测 将灭菌的BHI 琼脂培养基冷却至50 ℃~60 ℃后,加入5%的兔血,混匀倒平板,待兔血琼脂培养基凝固后用打孔器打孔,并用2%的BHI 琼脂封底。然后将纯化的菌株XQS1 用生理盐水调整浓度至6.0×107cfu/mL,取50 μL接种至5%的兔血BHI 琼脂平板中,并以相同体积的生理盐水作为对照,28 ℃恒温培养24 h~48 h,观察溶血情况。
1.6 分离菌的人工感染试验 根据科赫法则(Koch’s postulates)原理,进行人工感染试验。将健康花斑副沙鳅饲养于玻璃水族箱内,每组20 尾,养殖用水为曝气自来水,试验期间连续充氧。由于花斑副沙鳅发病期间水温约25 ℃,因此暂养及试验期间水温控制在25±2 ℃。实验水质达到渔业水质标准。
将分离纯化的细菌XQS1 接种于BHI 平板,28 ℃培养48 h 后,用无菌生理盐水洗下并调整浓度为6.0×108cfu/mL、6.0×107cfu/mL、6.0×106cfu/mL。将80尾健康花斑副沙鳅随机分为3个实验组和一个对照组,实验组按照0.05 mL/尾的剂量腹腔注射健康花斑副沙鳅,对照组腹腔注射相同体积的无菌生理盐水。感染后连续观察两周,记录鱼的发病和死亡情况,并对死亡鱼或濒死鱼及时剖检和分离细菌。
1.7 分离菌的16S rRNA 和gyrB 基因扩增及序列测定分析 按照细菌基因组DNA 提取试剂盒说明书提取细菌总DNA 作为PCR 模板。采用细菌16S 通用引物[9]及gyrB 基因引物[10]进行PCR 扩增。PCR 反应条件为:94 ℃5 min;94 ℃1 min、54 ℃1 min、72 ℃2 min,30 个循环;72 ℃10 min。扩增产物经PCR产物纯化试剂盒纯化后,由上海生工生物工程技术服务有限公司测序。将分离菌株的16S rRNA 基因序列和gyrB 基因序列与GenBank 中已知核酸序列进行BLAST 分析,利用MEGA 6.0 软件包中的Neighbor-Joining 法构建系统进化树,重复抽样1000 次分析系统进化树各分支的置信度。
1.8 分离菌的毒力基因检测 以菌株XQS1 的DNA为模板,采用PCR 方法进行热稳定性肠毒素基因ast、毒性肠毒素基因act、热不稳定性肠毒素基因alt、气溶素基因aer、溶血素基因hlyA 5 种毒力基因检测。参考文献[11-12] 由上海生工生物工程技术服务有限公司合成扩增上述毒力基因的引物,PCR 扩增产物由上述公司进行序列测定。
1.9 分离菌的药物敏感试验 将患病花斑副沙鳅中分离的菌株XQS1,采用纸片法检测分离菌对17种常见抗菌药(表1)的敏感性。根据药敏纸片抑菌范围确定药物敏感情况。每种药物重复3 次。
2 结 果
2.1 分离菌的形态学观察及生理生化鉴定 从患病花斑副沙鳅肝脏组织中取样,在BHI 平板上划线,28 ℃恒温培养24 h 后,获得1 株优势菌,编号为XQS1,该菌在BHI 平板培养基上生长较快,形成圆形、表面光滑、边缘整齐、半透明状凸起的灰白色菌落,革兰染色后镜检发现该菌株为两端钝圆的革兰氏阴性短杆菌(图1)。挑取单个菌落接种于微量生化管中,28 ℃下培养24 h~48 h,按照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》进行生理生化特性鉴定。结果显示,14 个鉴定项目中,菌株XQS1 对运动性、MR、赖氨酸脱羧酶、蔗糖、七叶苷、D-葡萄糖、麦芽糖、VP、氧化酶、吲哚反应、以及柠檬酸盐等11 个鉴定项目呈阳性反应,对L-阿拉伯糖、H2S 产生以及丙二酸盐等3 个鉴定项目呈阴性反应。根据结果初步确定分离菌株XQS1应为气单胞菌属(Aeromonas)。
图1 菌株XQS1 革兰氏染色(标尺=10 μm)Fig.1 The gram staining result of XQS1(Bar=10 μm)
2.2 分离菌的溶血性检测结果 菌株XQS1 在兔血BHI 琼脂培养基上呈现β溶血现象(图2),表明该分离菌有较强致病性,可能为引起该次花班副沙鳅患病的病原。
2.3 分离菌的人工感染试验结果 利用分离菌株XQS1 感染后,腹腔注射组花斑副沙鳅在2 d~5 d 内发病死亡,5 d 后停止死亡,3 个浓度组6.0×108cfu/mL、6.0×107cfu/mL、6.0×106cfu/mL 累计死亡率分别为85%(17/20)、75%(15/20)、60%(12/20);对照组未发生死亡。人工感染发病鳅的主要症状表现为:串游或垂直悬停于水中,腹部严重出血、部分区域肌肉溃烂,肝脏、脾脏和肾脏严重充血或出血,腹腔内有带血样腹水,肠道发炎、出血,以上症状与自然发病鱼的症状相似;并从死亡鱼肝脏和肾脏中分离到一种革兰氏阴性短杆菌,且生理生化结果和分子生物学鉴定结果与菌株XQS1 一致,表明该细菌是引起该次花斑副沙鳅发病的主要病原菌。
2.4 分离菌的16S rRNA 基因和gyrB 基因PCR 扩增与系统进化树分析 以菌株XQS1 基因组DNA 作为模板,16S rRNA 基因序列经PCR 扩增和电泳检测后,显示其目的条带大小约为1 500 bp(图3A),PCR 产物经测序,其长度为1 408 bp。将序列与GenBank 中已知核酸序列进行BLAST 分析,结果显示:其与已知维氏气单胞菌16S rRNA 基因序列一致性为99%以上。然后下载相似性最高的细菌和其它种属细菌的16S rRNA 基因序列采用MEGA6.0 构建系统进化树(图3B),结果显示该菌株16S rRNA 基因与维氏气单胞菌聚为同一支。该结果初步表明,菌株XQS1 为维氏气单胞菌。
以菌株XQS1 基因组DNA 作为模板,gyrB 基因经PCR 扩增和电泳检测后,显示其目的条带大小约为1 200 bp(图4A),PCR产物经测序,其长度为1 128 bp;将序列与GenBank 中已知核酸序列进行BLAST 分析,结果显示:其与已知维氏气单胞菌gyrB 基因序列一致性为98%以上,构建系统进化树显示该菌gyrB 基因与维氏气单胞菌聚为同一支(图4B)。结合以上一系列研究结果,确定本研究分离菌株XQS1是维氏气单胞菌。
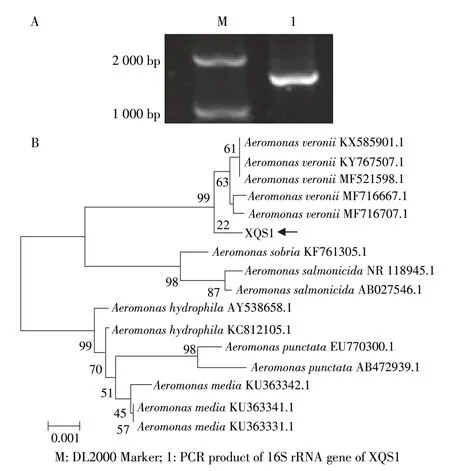
图3 菌株XQS1 16S rRNA 基因PCR 产物(A)及系统进化树(B)Fig.3 The PCR product(A)and phylogenetic tree(B)of 16S rRNA gene of XQS1
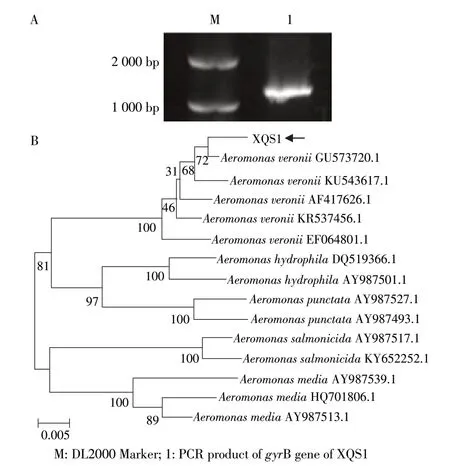
图4 菌株XQS1 gyrB 基因PCR 产物(A)及系统进化树(B)Fig.4 The PCR product(A)and phylogenetic tree(B)of gyrB gene of XQS1
2.5 分离菌的毒力基因检测结果 以分离菌株XQS1的DNA 为 模 板,采 用 维 氏 气 单 胞 菌ast、act、alt、aer、hlyA 5种毒力基因的引物进行PCR扩增,结果显示未扩增出ast基因,而另外4种毒力基因大小分别为232 bp、442 bp、431 bp和597 bp(图5),经测序鉴定与目的基因一致。表明XQS1 携带act、alt、aer、hlyA 4 种毒力基因,推测该菌株具有较强的毒力。
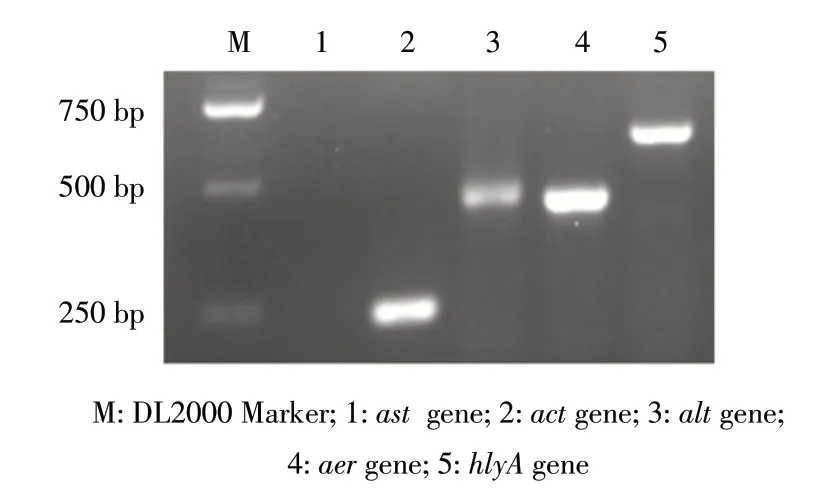
图5 菌株XQS1 毒力基因PCR 扩增结果Fig.5 The electrophoresis result of the virulence genes PCR products of XQS1
2.6 分离菌的药物敏感试验 对分离菌XQS1 进行了17 种药物敏感性试验。28 ℃培养24 h 后,测定抑菌圈直径并判定结果。结果显示:该菌株对多西环素、诺氟沙星、氧氟沙星和氟苯尼考敏感;对多粘菌素B 介于敏感与耐药之间;对其余抗生素均耐药(表1)。这表明菌株XQS1 具有较强的耐药性。

表1 菌株XQS1 药物敏感试验结果Table 1 The drug sensitivity test of XQS1
3 讨 论
本研究从患病花斑副沙鳅肝脏中分离到一株优势菌(命名为XQS1),根据科赫法则,通过人工感染试验确定了该菌株为引起该次花斑副沙鳅发病死亡的主要病原。随后,采用生理生化试验对菌株XQS1 进行了初步鉴定,结果显示:该菌株具有运动性,能够利用多种糖类,但不能利用L-阿拉伯糖,且不产生H2S。与之前报到的虹鳟源维氏气单胞菌[13]、异育银鲫源温和气单胞菌[14]、青鱼源嗜水气单胞菌[15]等气单胞菌属细菌生理生化鉴定结果相似。由于同一属中不同种细菌在生理生化方面可能相同,而且在不同的环境条件下生理生化结果也存在差异,因此生理生化鉴定结果只能推断XQS1 为气单胞菌属细菌。
为了进一步确定该致病菌种类,本研究采用16S rRNA 基因序列分析法进一步鉴定,结果显示该序列与已知维氏气单胞菌序列一致性达99%以上。系统发育分析结果显示,XQS1 与维氏气单胞菌聚于一簇,初步确定该致病菌为维氏气单胞菌。但由于16S rRNA 基因保守性较高、进化速度较慢,无法区分亲缘关系较近的细菌类群[16-17],而gyrB 基因的进化速率较16S rRNA 基因快,能够将同一属内亲缘关系较近的细菌种类区分开来[18-19]。因此,本研究采用gyrB 基因对XQS1 再次进行鉴定,并进行系统进化分析,结合传统生理生化鉴定结果,最终确定该致病菌为维氏气单胞菌。
近年来,国内外有关维氏气单胞菌病例的报道逐渐增多,相关研究表明维氏气单胞菌的毒力在逐渐增强,而毒力的强弱主要与菌株携带的毒力基因相关,目前已经报道的维氏气单胞菌的毒力基因包括:外膜蛋白、菌毛、鞭毛、气溶素、溶血素、肠毒素、蛋白酶以及一些黏附因子等[20]。本研究对分离的致病性维氏气单胞菌XQS1 进行ast、act、alt、aer 和hlyA 5 种毒力基因特异性PCR 检测,结果显示该菌株携带act、alt、aer、hlyA 4 种毒力基因。已有报道显示, aer 和hlyA 均属于外毒素,能够引起β溶血,致使宿主在感染致病性维氏气单胞菌后出现出血现象[12];alt 和act 均属于细胞毒性肠毒素,可刺激宿主的促炎反应,具有细胞毒性和溶血性[11]。本研究结果发现自然发病和人工感染花斑副沙鳅均表现出体表及内脏器官的广泛性出血,溶血性试验也显示该菌株能够使兔血呈β溶血。因此,推测致病性维氏气单胞菌XQS1 的强毒性可能与携带了这些毒力基因有关。然而本研究未在维氏气单胞菌XQS1中检测到ast,这可能与不同菌株携带毒力基因差异性有关[21]。
为指导该病的临床用药,本研究进行了药敏试验,结果显示维氏气单胞菌XQS1 仅对17 种抗菌药物中的多西环素、诺氟沙星、氧氟沙星和氟苯尼考敏感,对其它所选药物中度敏感或者耐药。结合本研究团队以往临床治疗经验,建议对发病花斑副沙鳅采用多西环素加维生素C 进行治疗。
本研究首次报道了维氏气单胞菌对花斑副沙鳅的致病性,对其携带的毒力基因进行了检测,并通过药敏试验筛选出了防治该病的敏感药物,为花斑副沙鳅人工养殖中该疾病的防治提供了理论参考,但该菌对花斑副沙鳅的具体致病机理还有待进一步研究。

