氨基酮戊酸光动力疗法对增生性瘢痕成纤维细胞前胶原基因表达的影响
卢娜,余南生,梁栋龙
(广州医科大学附属顺德医院,广东佛山528315)
增生性瘢痕因其严重影响美观及功能,常给患者造成不同程度的心理障碍,严重影响患者生活质量,所以国内外对增生性瘢痕的研究非常重视[1]。氨基酮戊酸光动力疗法(ALA-PDT)是近年来新兴的一种增生性瘢痕治疗方法,有疗效好、安全性高、患者耐受性好等诸多优势,已广泛应用于肿瘤性皮肤病、感染性皮肤病、皮肤美容等多个领域[2-3]。增生性瘢痕是一种以成纤维细胞增殖并产生过量的以胶原纤维为主要细胞外基质的皮肤纤维化疾病,其中胶原纤维以Ⅰ、Ⅲ型胶原纤维为主[4]。研究发现[5],有效抑制Ⅰ、Ⅲ型胶原纤维可明显降低瘢痕增生风险。本研究培养原代增生性瘢痕成纤维细胞,采用ALA-PDT进行体外实验,从细胞水平探讨其对成纤维细胞的影响,现报道如下。
1 材料与方法
1.1 材料 选取外伤后1~2年增生性瘢痕组织标本,来源于广州医科大学附属顺德医院皮肤科。增生性瘢痕经病理及临床诊断符合《现代瘢痕学》[6]诊断标准,为外伤后1~2年增生性瘢痕,且未曾接受糖皮质激素、激光等任何方式干预治疗。受试对象均签署知情同意书。标本切取后置DMEM培养液离心管中冰盒保存。
1.2 主要试剂 ALA、噻唑兰(MTT)试剂购自美国Sigma公司;胎牛血清(货号10099-141)、达尔伯克必需基本培养基(DMEM)培养液、25%胰蛋白酶消化液、磷酸盐缓冲液(PBS)均购自美国Gibco公司;Trizol、逆转录-聚合酶链反应(RT-PCR)逆转录试剂盒、TaqDNA聚合酶均购自日本TaKaRa公司。
1.3 方法
1.3.1 原代细胞培养 采用组织块贴壁法培养。弃去DMEM培养液,用0.25%氯霉素溶液和PBS反复冲洗血污,剪除表皮及皮下脂肪。PBS冲洗后将标本剪成约1 mm×1 mm×1 mm的组织块,PBS再次反复冲洗;加入胶原酶消化液消化1 h后,200目金属滤网过滤,滤液离心5 min,弃去上清,用10%胎牛血清的DMEM溶液,37℃、5%CO2培养箱培养。本研究取稳定传代的第4~8代细胞。
1.3.2 分组与实验 将稳定传代的第4~8代的瘢痕成纤维细胞接种于96孔板及6孔板,培养48 h后,分为7组加样培养,每个样本设3个复孔:空白对照组:单纯10%胎牛血清的DMEM溶液;另外6组分别给予 0.0625、0.125 、0.25、0.5、1、2 mmol/L 浓度梯度的ALA10%胎牛血清的DMEM溶液培养,CO2培养箱避光培养5 h后,每组采用LED激光器630 nm照射20 min后,培养24 h。
1.3.3 MTT检测 96孔板细胞用于MTT检测细胞增殖抑制率。向各孔滴加 20 μL MTT(5 g/L)后,继续培养4 h,静置后吸去上清,每孔滴加100 μL DMSO,低速振荡10 min,采用酶标仪490 nm吸光度检测,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-实验孔平均OD值/对照孔平均OD值)×100%。
1.3.4 RT-PCR法检测 6孔板细胞用于提取Ⅰ、Ⅲ前胶原mRNA。按Trizol法抽提各组细胞中总mRNA,Ⅰ、Ⅲ前胶原mRNA与内参基因GAPDH同管扩增,所用引物见表1。扩增条件为预变性:94℃,5 min;变性:94 ℃,30 s;退火:59 ℃,30 s;延伸:72℃,60 s;35个循环后,再次延伸。扩增后,产物用琼脂糖凝胶电泳,SYBR GreenⅡ核酸染料染色后,凝胶分析软件分析目标条带净吸光度值。

表1 实验用引物序列
1.4 统计学分析 本研究数据采用SPSS 22.0软件进行分析,计量资料以均数±标准差(±s)表示,并进行方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ALA-PDT对瘢痕成纤维细胞形态的影响 倒置显微镜下,增生性瘢痕成纤维细胞呈梭形,贴壁良好,胞核较大,胞质饱满,边界清晰。经LED激光器照射10 min后,空白对照组细胞形态较照射前无明显变化;经不同浓度ALA培养的成纤维细胞,细胞形态呈不同程度皱缩,ALA浓度在0.125~2 mmol/L范围内,ALA浓度越高,细胞越趋向类球样改变;同时,随着ALA浓度的增加,破裂细胞膜及细胞壁的数量增加,胞质溢出增加,细胞核缩小或碎裂程度增加,且胞浆内出现大小不等的颗粒。
2.2 ALA-PDT对瘢痕成纤维细胞增殖的影响 给予不同浓度ALA培养,LED激光器635 nm照射后,瘢痕成纤维细胞增殖受到不同程度抑制,随ALA浓度增加,OD值逐渐下降,抑制率逐渐增强,各组比较差异有统计学意义(P<0.05);当ALA浓度为0.5 mmol/L时,ALA-PDT对瘢痕成纤维细胞增殖抑制作用达到峰值,其后随ALA浓度增加抑制作用不再增强,见表2、图2。
2.3 ALA-PDT对瘢痕成纤维细胞Ⅰ、Ⅲ型前胶原mRNA的表达的影响 ALA-PDT作用后,对瘢痕成纤维细胞Ⅰ、Ⅲ型前胶原mRNA有明显的量效抑制作用,ALA-PDT对Ⅰ、Ⅲ型前胶原mRNA的抑制作用均在ALA浓度为0.5 mmol/L时达到峰值,ALAPDT对Ⅰ型前胶原mRNA抑制作用的起效浓度为0.25 mmol/L,在 0.25~0.5 mmol/L范围内,ALA-PDT对瘢痕成纤维细胞Ⅰ型前胶原mRNA的抑制作用随ALA浓度的增加而增高;ALA-PDT对Ⅲ型前胶原mRNA抑制作用的起效浓度为0.125 mmol/L,在0.125~0.5 mmol/L范围内,ALA-PDT对瘢痕成纤维细胞Ⅲ型前胶原mRNA的抑制作用随ALA浓度的增加而增高。见表3。
表2 ALA-PDT对瘢痕成纤维细胞增殖能力的影响 (±s)

表2 ALA-PDT对瘢痕成纤维细胞增殖能力的影响 (±s)
注:与空白对照组比较,*P<0.05。
ALA浓度(mmol/L) OD值 抑制率(%)2 0.731 5±0.013* 76.46±3.93 1 0.853±0.015* 75.78±2.73 0.5 0.954±0.017* 73.13±3.04 0.25 0.157±0.013* 55.51±2.84 0.125 0.203±0.024* 42.19±3.02 0.062 5 0.303±0.020* 14.03±4.26空白对照组 0.352±0.008 -F 9.832 13.275 P 0.357 0.024
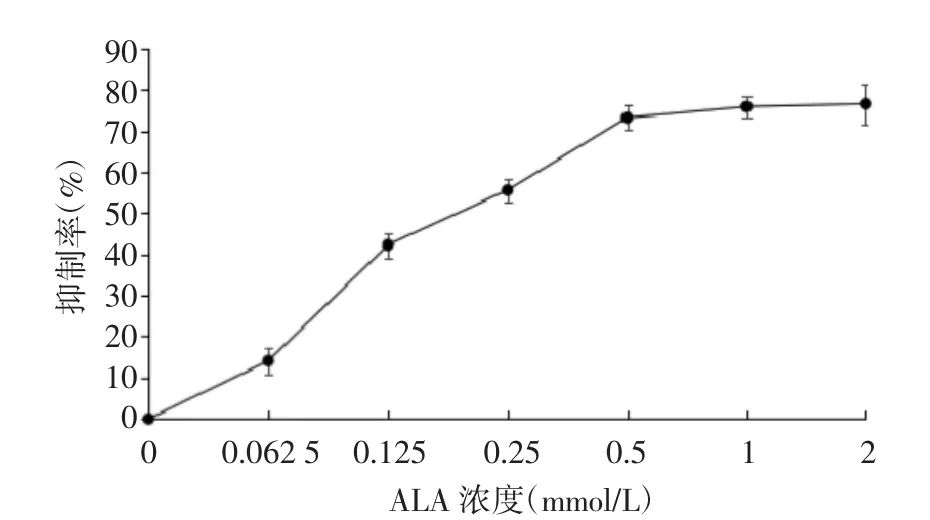
图2 不同浓度ALA对瘢痕成纤维细胞增殖能力的影响
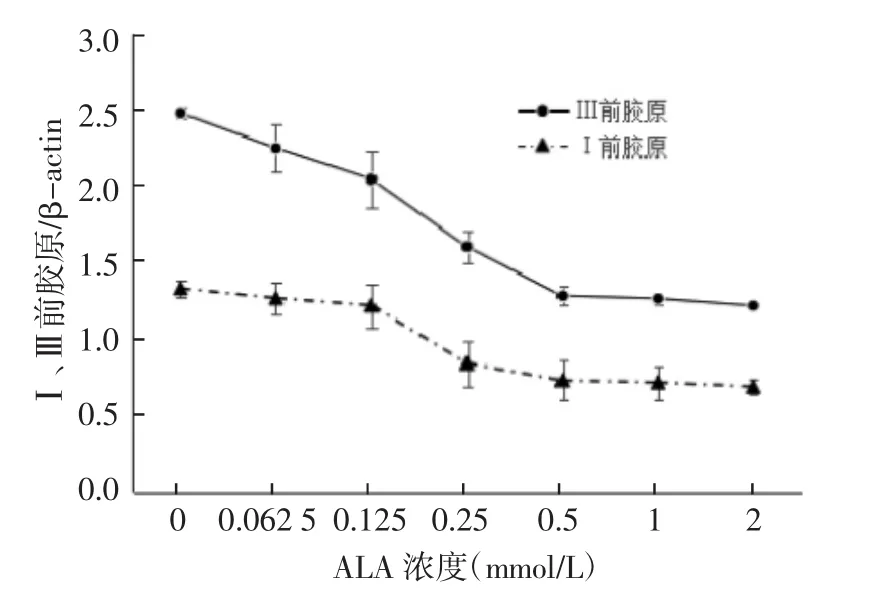
图3 ALA-PDT对瘢痕成纤维细胞Ⅰ、Ⅲ前胶原mRNA的表达的影响
表3 ALA-PDT对瘢痕成纤维细胞Ⅰ、Ⅲ前胶原mRNA的表达的影响 (±s)
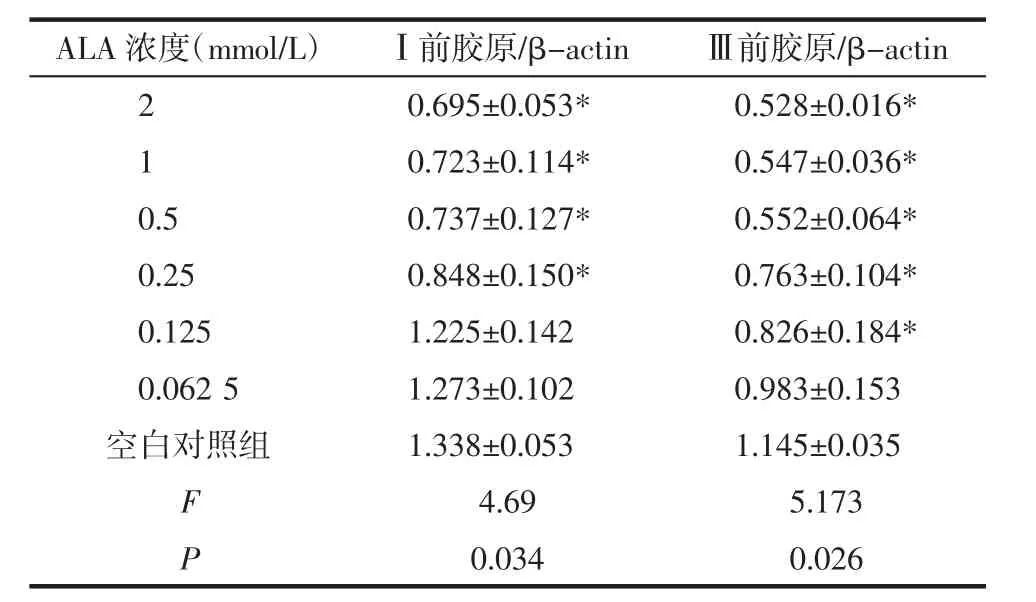
表3 ALA-PDT对瘢痕成纤维细胞Ⅰ、Ⅲ前胶原mRNA的表达的影响 (±s)
注:与空白对照组比较,*P<0.05。
ALA浓度(mmol/L) Ⅰ前胶原/β-actin Ⅲ前胶原/β-actin 2 0.695±0.053* 0.528±0.016*1 0.723±0.114* 0.547±0.036*0.5 0.737±0.127* 0.552±0.064*0.25 0.848±0.150* 0.763±0.104*0.125 1.225±0.142 0.826±0.184*0.062 5 1.273±0.102 0.983±0.153空白对照组 1.338±0.053 1.145±0.035 F 4.69 5.173 P 0.034 0.026
3 讨论
增生性瘢痕是组织在创面愈合过程中过度增生所形成的,其发生率较高,常发生于外伤、烧伤、手术及炎性反应后,因其严重影响美观及功能,有的患者甚至丧失生活自理能力,常给其造成不同程度的心理障碍,严重影响生活质量。研究发现,增生性瘢痕为局部皮肤组织的良性纤维增生所致,亦是组织损伤后产生病理性伤口愈合反应产物,胶原过量合成和沉积是增生性瘢痕形成的病理基础。研究证实[7],增生性瘢痕组织主要由胶原蛋白Ⅰ、Ⅲ及少量的其他胶原组成,且主要有成纤细胞合成。在成纤细胞的粗面内质网上,Ⅰ、Ⅲ胶原先以Ⅰ、Ⅲ前胶原mRNA为模板,翻译成Ⅰ、Ⅲ前胶原,其翻译速率受Ⅰ、Ⅲ前胶原mRNA的浓度限制。大量研究发现,有效抑制Ⅰ、Ⅲ前胶原mRNA表达,可有效降低Ⅰ、Ⅲ胶原的合成量,进而抑制增生性瘢痕的形成。
增生性瘢痕传统的治疗方法有外科手术、磨削、冷冻、压迫疗法、外用药物或者激素封闭等,但效果均不理想[8]。ALA-PDT为近些年新兴的皮肤性疾病局部疗法,其治疗原理主要是利用生长旺盛靶细胞比周围正常组织细胞有较高的积聚光敏剂的能力,适时照射特定波长的光产生一系列的生物化学反应,破坏生长旺盛靶细胞的生物膜,从而杀伤靶细胞。其治疗增生性瘢痕是利用生长旺盛的瘢痕成纤细胞比正常皮肤细胞积聚光敏剂能力较强的特性,给予成纤细胞照射非热能激光,并在光敏剂的参与下,光敏剂吸收光子能量跃迁至激发态,而激发态光敏剂再次将能量传递给氧,产生活性氧及自由基,造成瘢痕成纤细胞生物膜氧化损伤,最终诱导细胞凋亡与坏死[9-10]。瘢痕组织内成纤维细胞异常增生,根据PDT的原理,将此应用于瘢痕组织的治疗。ALA为第二代光敏剂,易被增生性瘢痕成纤细胞选择性吸收,在细胞内经ALA脱水酶及一系列酶促作用,转化为有强光敏作用的原卟啉Ⅸ(PpIX)等物质,在特殊光照射下产生活性氧及自由基损伤靶细胞[11]。朱志娟等[12]对体外瘢痕疙瘩给予不同浓度ALA发现,ALA浓度对瘢痕疙瘩成纤维细胞增殖及胶原蛋白Ⅲ的表达水平有影响,且随着浓度的增加及光照时间的增加而抑制作用增强。本研究结果显示,ALA-PDT作用后,增生性瘢痕的成纤维细胞的细胞形态发生明显改变。体外培养的瘢痕成纤维细胞,正常状态下呈梭形,贴壁良好,胞核较大,胞质饱满,边界清晰。经不同浓度ALA培养的成纤维细胞,细胞形态呈不同程度皱缩,ALA浓度>0.125 mmol/L后,细胞形态皱缩程度随浓度增加而增大,细胞越趋向类球样改变;同时,随着ALA浓度的增加,破裂细胞膜及细胞壁的数量增加,胞质溢出增加,细胞核缩小或碎裂程度增加,且胞浆内出现大小不等的颗粒,高倍镜下观察发现,成纤维细胞线粒体及内质网等结构出现明显形态损伤。提示,ALA-PDT对体外培养增生性瘢痕成纤维细胞的形态及生长有明显的抑制作用。本研究通过MTT试验发现进一步发现,在ALA浓度为0.125~0.500 mmol/L范围内,ALA-PDT对增生性瘢痕成纤维细胞增殖的抑制作用随ALA浓度增加而增强,并在ALA浓度为0.5 mmol/L时抑制作用达到峰值。提示ALAPDT在一定浓度范围内可有效抑制增生性瘢痕成纤维细胞的增殖,从而抑制瘢痕增生,同时,揭示了ALA对增生性瘢痕成纤维细胞抑制作用的最高有效浓度,为临床用药提供参考。
另外,本研究结果显示,ALA-PDT作用后,对瘢痕成纤维细胞Ⅰ、Ⅲ型前胶原mRNA有明显的量效抑制作用,且在一定范围内抑制作用随ALA浓度的增加而增强,与文献报告基本一致。同时,本研究发现,Ⅰ型前胶原mRNA及Ⅲ型前胶原mRNA对ALA的敏感性有所差异,前者在ALA浓度为0.25 mmol/L时发生明显改变,后者在ALA浓度为0.125 mmol/L时明显改变,但二者均在ALA浓度0.5 mmol/L时达到抑制峰值,与钱革等[13]研究结果一致。提示体外培养的增生性瘫痕成纤维细胞型前胶原Ⅲ较前胶原Ⅰ更易受到ALA-PDT作用影响,而ALA-PDT可能通过抑制Ⅰ、Ⅲ型前胶原mRNA的合成,进而抑制成纤维细胞的增殖。同时,本研究ALA-PDT对瘢痕成纤维细胞抑制结果与临床疗效研究一致。研究发现[14],ALA-PDT治疗增生性瘢痕的临床疗效较瘢痕疙瘩更佳。由于二者病理改变存在一定差异,增生性瘢痕组织以Ⅲ型胶原为主,而瘢痕疙瘩以Ⅰ型胶原为主[15],本研究中Ⅲ型前胶原mRNA更易受到ALA-PDT作用影响,印证了二者临床疗效的差异。目前尚无研究解释其机制,有待进一步研究。
综上所述,ALA-PDT对体外培养的增生性瘢痕成纤维细胞形态、增殖呈量效抑制作用,可降低Ⅰ、Ⅲ型前胶原基因水平,为增生性瘢痕的ALA-PDT治疗提供了实验参考。

