血清正五聚素蛋白-3水平与系统性红斑狼疮患者活动期的关系
许毅,贺文芳
(1.西安航天总医院,陕西西安710100;2.空军军医大学西京医院,陕西西安710032)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种慢性炎症性自身免疫性疾病,其特征为全身持续性炎性反应,可累及多个脏器[1]。由于SLE可呈现多种临床表现(如发热、皮疹、关节痛和肾、肺或脑受累及的症状)且其病程不可预测。因此,SLE的诊断及病情评估对临床医师是一个巨大的挑战。迄今为止,SLE的发病机制尚不清晰。有研究认为,SLE的发病机制可能是基于遗传变异和环境因素的组合,这些因素促进耐受性丧失或组织炎性反应[2]。目前,越来越多的证据表明炎性反应和相关分子在SLE的发病机制中起着关键作用。
正五聚素蛋白(Pentraxin,PTXs)是多功能保守分子的超家族。根据其初级结构可分为长链和短链PTXs[3]。C-反应蛋白(CRP)属于短链 PTXs家族,由白细胞介素(IL)-6刺激肝脏后产生。PTX3属于长链PTXs家族,主要由参与先天免疫的细胞如多形核白细胞、巨噬细胞和树突状细胞产生的。PTX3可以与多种配体如IL-1或肿瘤坏死因子(TNF)-α相互作用,在先天免疫中发挥较为重要的作用[4]。近期研究显示,PTX3作为炎性反应过程的调节剂参与许多疾病的发生发展,如感染性疾病、脓毒症、心血管疾病和自身免疫性疾病(如类风湿性关节炎、系统性血管炎)等[5-7]。但目前国内尚缺乏PTX3与SLE活动期的相关研究。因此,本研究探讨血清PTX3水平在SLE患者是否增高,以及血清PTX3水是否反映了患者的疾病活动性。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 本研究共纳入75例SLE患者和75例健康对照组(Healthy controls,HC),2组间的年龄和性别基本匹配。所有入选的SLE患者均符合美国风湿病学会(ACR)诊断标准[8]。HC纳入标准:无SLE或任何其他炎症性疾病或感染性疾病的健康体检者。SLE排除标准:妊娠或产后患者、恶性肿瘤、缺血性心脏病、并发感染和近期外伤等。
1.1.2 临床资料 收集所有研究对象的一般资料。SLE组和HC组的一般资料,见表1。2组间的性别、年龄差异无统计学意义(P>0.05)。在75例SLE患者中,男 8例(10.7%),女 67例(89.3%),平均年龄为(42.13±11.95)岁。采用SLE疾病活动指数(SLDAI)用于SLE疾病活动期的评估,0~4分为基本无活动;5~9分为轻度活动;10~14分为中度活动;≥15分为重度活动[9]。
1.2 血清标本收集与PTX3水平检测 采用无菌采血针收集所有受试者的清晨空腹外周血3 mL,3 000转/min,离心15 min,取上清分装于1.5 mL EP管中,-80℃冰箱保存备用。运用酶联免疫吸附法(ELISA)检测所有受试者血清PTX3水平,试剂盒购于武汉优尔生生物科技有限公司,操作严格按照试剂盒说明书进行。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料数据用均数±标准差(±s)表示,分类变量的比较采用χ2检验。数据符合正态分布,2组间比较采用t检验,多组间比较采用单因素方差分析。数据不符合正态分布,组间比较采用非参数检验。相关性分析采用Pearson或Spearman。评估SLE疾病活动的影响因素采用二元Logistic回归分析。ROC曲线分析PTX3诊断SLE以及评估疾病活动期的价值。P<0.05为差异有统计学意义。
2 结果
2.1 SLE组和HC组的一般资料 平均红细胞沉降率(ESR)为(19.47±8.98)mm/h,平均 CRP 为(7.80±4.16)mg/L,平均 SLDAI为 9.35±6.13。此外,SLE组中56例为疾病活动期患者(病情轻度活动21例,病情中度活动20例,病情重度活动15例)和19例为非疾病活动性患者,见表1。
2.2 血清PTX3水平的测定 采用ELISA法检测2组血清PTX3水平。结果显示,SLE组中血清PTX3水平显著高于HC组,差异有统计学意义(2.52±1.01 vs.1.78±0.65,P<0.001)。此外,采用SLDAI对SLE患者进行评估,分为活动期与非活动期;结果显示,疾病活动期SLE患者血清PTX3水平是显著高于非活动期,差异有统计学意义(2.70±1.05 vs.1.98±0.62,P=0.006),见图 1。进一步,把活动期患者分为轻、中、重3期,结果显示,随着活动期程度的增高,血清PTX3水平水也逐渐增高,见表2。
表1 2组的人口学特征及实验室参数 (±s)
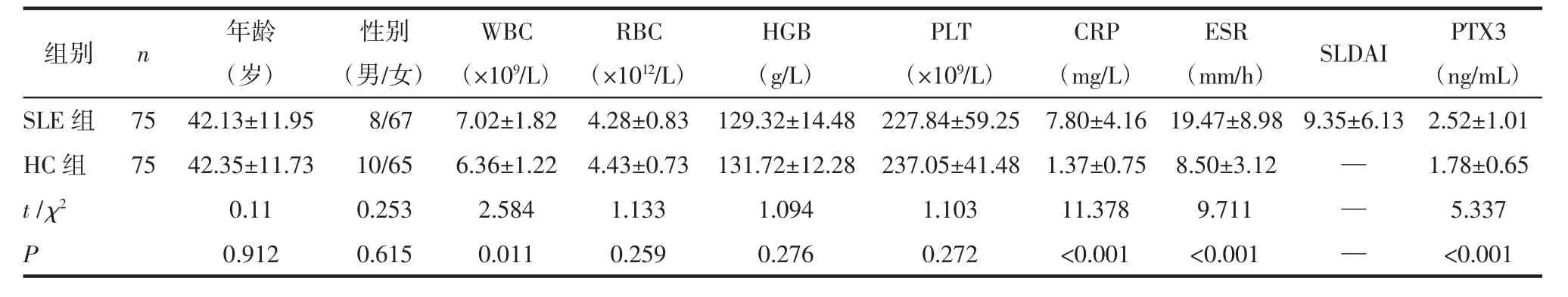
表1 2组的人口学特征及实验室参数 (±s)
(mm/h) SLDAI PTX3(ng/mL)SLE 组 75 42.13±11.95 8/67 7.02±1.82 4.28±0.83 129.32±14.48 227.84±59.25 7.80±4.16 19.47±8.98 9.35±6.13 2.52±1.01 HC 组 75 42.35±11.73 10/65 6.36±1.22 4.43±0.73 131.72±12.28 237.05±41.48 1.37±0.75 8.50±3.12 — 1.78±0.65 t/χ2 0.11 0.253 2.584 1.133 1.094 1.103 11.378 9.711 — 5.337 P 0.912 0.615 0.011 0.259 0.276 0.272 <0.001 <0.001 — <0.001组别 n 年龄(岁)性别(男/女)WBC(×109/L)RBC(×1012/L)HGB(g/L)PLT(×109/L)CRP(mg/L)ESR
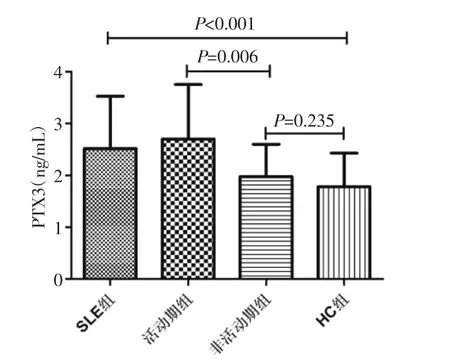
图1 血清PTX3在不同组中的表达水平

表2 血清PTX3水平在不同组间的比较 例
2.3 血清PTX3水平与其CRP、ESR和SLDAI的相关性分析 相关性分析结果显示,血清PTX3水平与CRP、ESR和SLDAI呈显著正相关(r=0.353,P=0.002;r=0.268,P=0.020;r=0.390,P=0.001),见图 2。
2.4 评估SLE疾病活动期影响因素的Logistic回归分析 以疾病活动为因变量,以年龄、性别、WBC、RBC、PLT、PTX3、CRP、ESR 为自变量,进行二元Logistic回归分析;结果显示在多因素Logistic回归分析中,PTX3是评估SLE疾病活动期的独立影响因素,见表3。
2.5 血清PTX3评估SLE的ROC曲线分析 ROC曲线分析结果显示,PTX3诊断SLE的最佳切点值为2.14 ng/mL,敏感性、特异性、曲线下面积(AUC)分别为 69.3%、82.7%、0.754(AUC的 95%CI为0.674~0.834)。PTX3区分SLE活动期与非活动期的最佳切点值为2.39 ng/mL,敏感性、特异性、AUC分别为 58.9%、89.5%、0.732(AUC 的95%CI为 0.615~0.849),见图 3。
3 讨论
PTX3是由8个质粒亚基组成的同源多聚糖蛋白,每个亚基含有381个氨基酸,包括一个17aa信号肽。PTX3基因定位于人第三号染色体q25区,包括3个外显子,分别编码该蛋白的前导肽、N端和C端结构域[10]。与其他长链PTX一样,PTX3蛋白包括独特的N端区(前蛋白中的残基18~178)和C端区(前蛋白的残基179~381),与短PTX有大约57%的同源相似性。目前发现许多转录因子结合序列(如Pu-1、AP1、NF-κB、SP1 和 NF-IL6)位于人PTX3 的启动区。NF-κB结合位点是PTX3基因转录活性所必需的。与IL-6介导生成的CRP相反,PTX3是针对于几种主要炎性反应信号而产生的,如TLR激动剂、IL-1和TNF-α等。PTX3可由多种天然免疫细胞和平滑肌细胞产生(如中性粒细胞、成纤维细胞、上皮细胞和血管内皮细胞等)[11]。此外,氧化和酶修饰的低密度脂蛋白和抗炎高密度脂蛋白均促进内皮细胞和人原代血管平滑肌细胞PTX3的产生。PTX3是先天免疫的重要组成部分,参与先天对病原体的抵抗、炎性反应调节和组织重塑[12]。PTX3产生的细胞的多样性确保PTX3是在发生原发性炎性反应的局部部位产生。独特的局部生产途径和即刻释放系统提示PTX3可能成为反映先天免疫应答和炎性反应的初级和局部信号的敏感生物标志物。近期研究显示,PTX3可能是自身免疫性疾病的候选预后标志物,并可能与疾病活动期密切相关[13]。本研究探讨PTX3在SLE患者血清中的水平的变化,评估血清PTX3水平与疾病活动期的关系,将有助于SLE的诊断、治疗方案的合理制定、治疗效果的有效评估、预测复发以及临床更好的管理SLE患者。
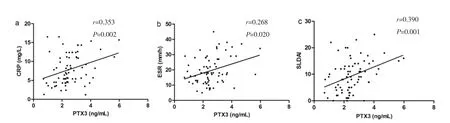
图2 血清PTX3水平与CRP、ESR和SLDAI的相关性分析
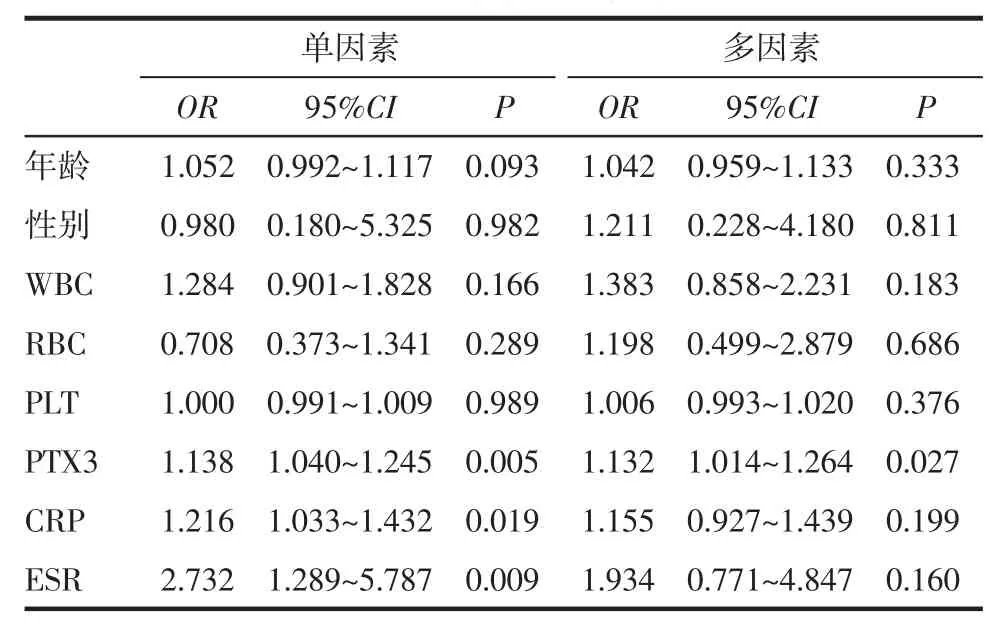
表3 SLE患者疾病活动期影响因素的Logistic回归分析
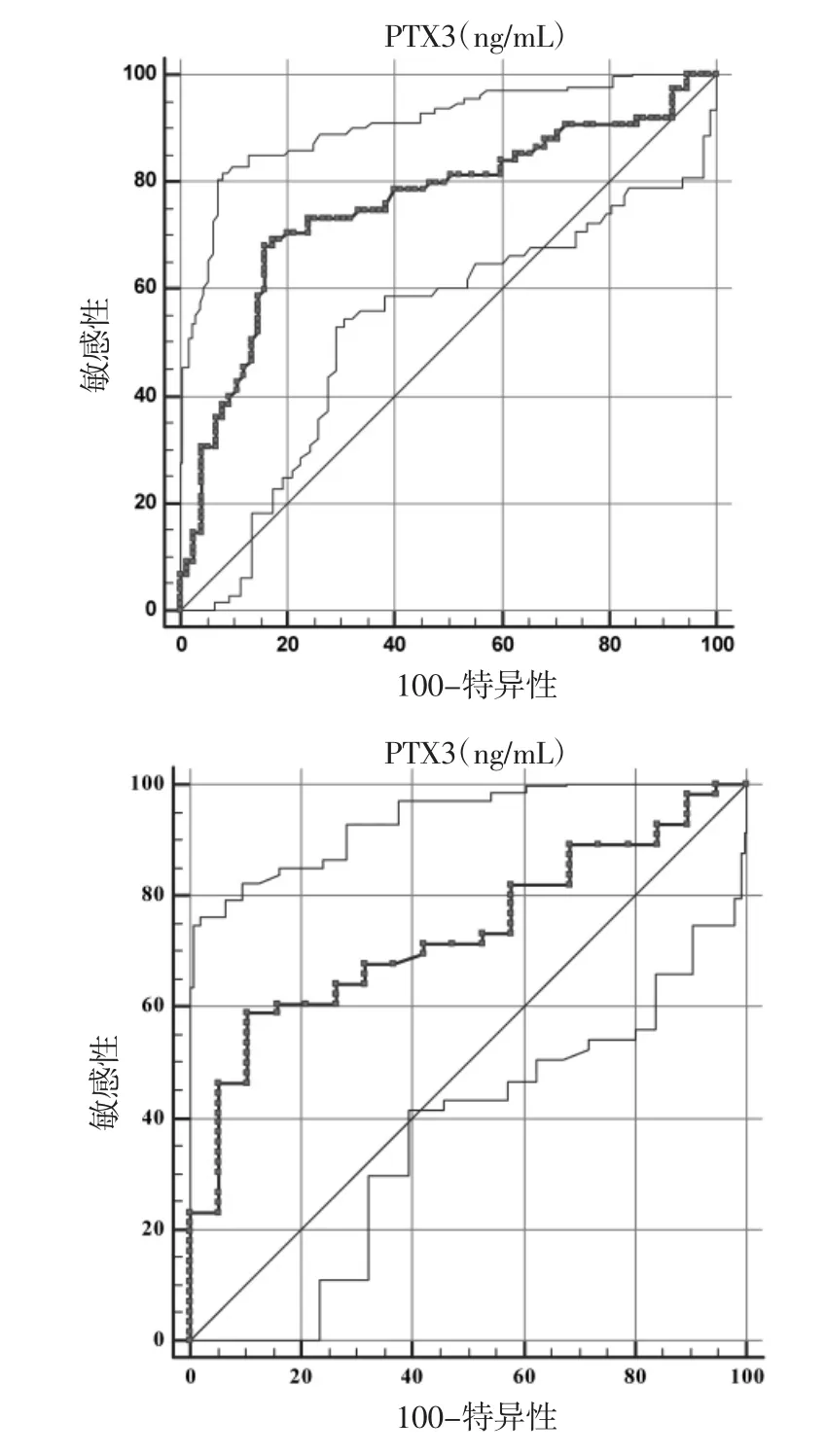
图3 血清PTX3水平的ROC曲线分析
此次研究笔者采用ELISA方法检测各组血清PTX3水平。结果显示,与HC组比较,血清PTX3水平在SLE患者中是显著增高的(P<0.05)。此外,采用SLDAI对SLE患者进行评估,分为活动期与非活动期,结果显示处于活动期SLE患者的血清PTX3水平显著高于非活动期SLE患者(P<0.05)。进一步,把活动期患者分为轻、中、重3期,结果显示,随着SLDAI评分的增高,血清PTX3水平水也逐渐增高(P<0.05)。相关性分析结果显示血清PTX3水平与 CRP、ESR 和 SLDAI呈显著正相关(P<0.05)。这些结果提示PTX3与疾病活动期有密切关系,可能参与了SLE炎性反应过程的发生发展。进一步行多因素Logistic回归分析,结果显示PTX3是评估SLE疾病活动期的独立影响因素。这提示PTX3可以作为一个独立的因素评估SLE疾病活动期。此外,以ROC分析为基础,评价PTX3作为生物标志物的质量。进一步进行ROC曲线分析,结果显示,PTX3诊断SLE的最佳切点值为2.14ng/mL,敏感性、特异性、AUC分别为69.3%、82.7%、0.754。PTX3区分SLE活动期与非活动期的最佳切点值为2.39 ng/mL,敏感性、特异性、AUC分别为58.9%、89.5%、0.732。Assandri等[14]研究显示,SLE患者血浆PTX3浓度显著高于健康对照组。此外,PTX3浓度与SLDAI相关,且可以反应了疾病的活动性。采用ROC曲线分析法确定最佳截断点(2.8 ng/mL),且有良好的灵敏度和特异性。Ismail等[15]的研究结果也提示PTX3水平与SLE患者的活动性相关。这与笔者的研究结果相类似。这说明PTX3可作为诊断SLE的潜在生物标志物,并有助于疾病活动性的评估。
然而,笔者的研究有一些局限性,需要加以考虑。首先,笔者进行了横断面研究,没有观察到血清PTX3水平的动态变化。第二,患者数量较少,需要进一步扩大样本量。然而,笔者的研究结果提示,PTX3是SLE一种合适的生物标志物。
综述所述,血清PTX3水平在SLE患者是显著增高的,且与疾病活动程度相关。PTX3可作为一个新型生物标记物用于SLE的诊断及疾病活动性的评估。此外,进一步的纵向研究观察血清PTX3水平的动态变化,可揭示PTX3是否是SLE疾病活性和预后的预测因子以及可能的药理调节靶点,这需要进行更加精确分析和更大样本量的研究。

