超高效液相色谱—串联质谱法测定果蔬汁中甲霜灵、戊唑醇及毒死蜱
李文
(安徽省化工产品质量监督检验站,安徽合肥230041)
目前,甲霜灵、戊唑醇和毒死蜱的单个农药测定方法有高效液相色谱法[1-2]、超临界流体萃取气相色谱法[3]、高效液相色谱-串联质谱法[4-5]、气相色谱-串联质谱法[6]。使用液相色谱、气相色谱或气相色谱质谱串联仪分析,样品处理过程繁琐耗时,且检测限度低。
本文采用QuEChERS 处理方法,经超高效液相色谱-串联质谱仪可同时检测果蔬汁中的甲霜灵、戊唑醇和毒死蜱。本方法快速定量,简便可靠,灵敏度高,检测限低。
1试验部分
1.1 仪器与试剂
WATERS TQ-s MICRO UPLC 超高效液相色谱-串联质谱仪(美国WATERS);梅特勒-托利多AL104 精密天平(上海梅特勒-托利多仪器有限公司);ZX-4涡旋仪(意大利VELP);移液枪(大龙兴创实验仪器有限公司);TDL-40B离心机(上海安亭科学仪器厂)。
戊唑醇,96.0%;甲霜灵,98.1%;毒死蜱,98.5%;乙腈,色谱纯、分析纯;醋酸,分析纯;甲酸:色谱纯;0.22 μm有机滤膜、一次性注射器(上海安谱科学仪器有限公司);MAS-Q 萃取剂:NaCl 1 g,MgSO44 g NaAC 1.5 g,50 mL 50/pk(天津艾杰尔公司);PSA:40-60 μm(天津艾杰尔公司);GCB:120-400 Mesh(天津艾杰尔公司)。
1.2 标准工作溶液的配制
标准储备液的配制:分别称取计量的甲霜灵、毒死蜱、戊唑醇于相应的容量瓶中,配制的浓度为1 000 mg/L,使用色谱纯乙腈定容至刻度,超声混匀,标准储备液-20℃保存备用。
10 mg/L甲霜灵、毒死蜱、戊唑醇三种物质的混合标准储备液的配制:使用移液枪分别准确吸取各自对应的标准储备液100 μL于同一个10 mL容量瓶中,使用色谱纯乙腈定容至刻度,超声混匀,标准储备液0℃~4℃保存备用。
取空白样品基质提取液逐级稀释标准储备液,配制成0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L 系列基质标准溶液;同时,使用色谱纯乙腈逐级稀释标准储备液,配制成0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L标准溶液,备用(标准溶液现用现配)。
0.1%甲酸水溶液:加500 mL 高纯水于1 000 mL 容量瓶中,使用移液枪吸取色谱甲酸1 mL 置于该容量瓶中,再用高纯水定容至刻度,摇匀,使用抽滤装置,过0.22 μm抽滤膜,备用。
0.1%乙酸乙腈溶液:在1 000 mL分析纯乙腈中,加入1 mL乙酸,超声混匀,备用。
1.3 样品处理
称取果蔬汁样品10.0(±0.1) g 于50 mL 塑料离心管中,加入10 mL 1%乙酸乙腈溶液,涡旋振荡3 min,加入MAS-Q 萃取剂,快速摇匀,涡旋振荡1 min,4 000 r/min离心5 min。取2 mL 上清液加入装有净化剂(50 mg PSA+150 mg MgSO4)的离心管中,迅速涡旋30 s,8 000 r/min离心2 min。取上清液,经0.22 μm滤膜过滤,待测。
1.4 色谱条件
1.4.1 液相条件
色谱柱:Acquity UPLC® BEH C18色谱柱(50.0 mm×2.1 mm,1.7 μm);柱温:40 ℃;流速:0.30 mL/min;进样量:1 μL;流动相A:0.1%甲酸水溶液;流动相B:乙腈;洗脱方式:梯度洗脱;洗脱程序见表1。
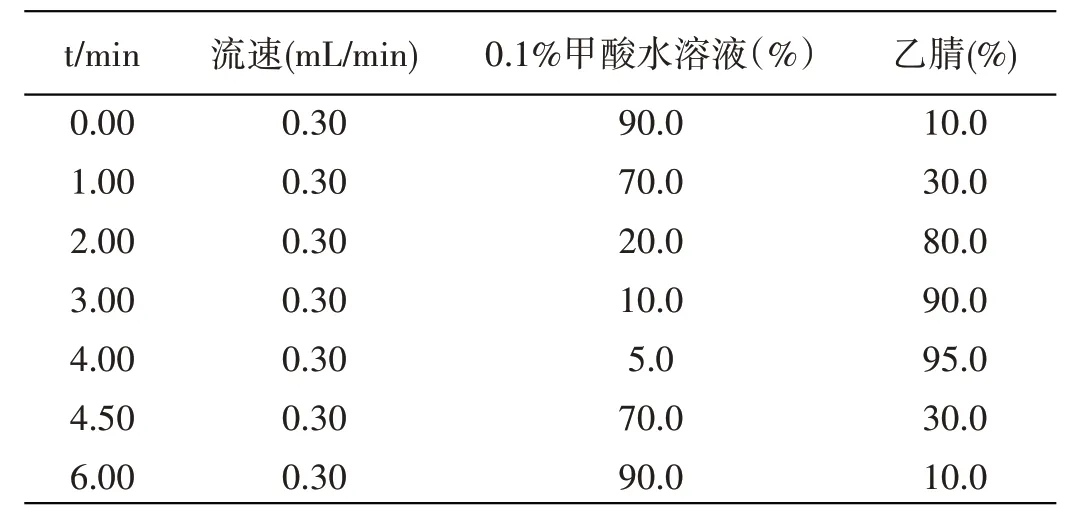
表1 液相洗脱梯度表
1.4.2 质谱条件
在15~2 408 m/z扫描范围内进样,使用电喷雾离子源,调谐各参数。优化的最终条件如下:离子源:电喷雾离子源ESI;扫描方式:正离子源(+);毛细管电压:3.4 kV;锥孔电压:50 V;离子源温度:150℃;脱溶剂温度:500℃;脱溶剂气流量:1 000 L/h;锥孔气流量:50 L/h;检测方式:多重反应监测(MRM),各物质扫描母离子与子离子及相关参数见表2。
2 结果与分析
2.1 色谱条件的优化与选择
本研究使用C18 色谱柱进行样品的分离,使用0.1%甲酸溶液-乙腈作为流动相,采用梯度洗脱的方式对样品进行分析,可降低杂质干扰,优化峰形。
配制甲霜灵、毒死蜱、戊唑醇的混合标样0.1 mg/L,在15~2 408 m/z 扫描范围内进样,使用电喷雾离子源,采用全扫描方式分析,调谐锥孔电压、毛细管电压、脱溶剂温度、脱溶剂流量等各参数,采用IntelliStar 进行子离子寻找。优化的最终条件见表2。对甲霜灵、戊唑醇、毒死蜱进行质谱扫描分析,谱图见图1,可以看出,甲霜灵、戊唑醇、毒死蜱在该条件下峰形尖锐、确证性强、灵敏度高。

表2 甲霜灵、毒死蜱、戊唑醇质谱采集参数
2.2 标准曲线及线性
取空白样品基质提取液逐级稀释标准储备液,配制成0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L 系列基质标准溶液,在上述液相色谱串联质谱条件下进行测定;同时,使用色谱纯乙腈逐级稀释标准储备液,配制成0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L 标准溶液,在上述液相色谱串联质谱条件下进行测定。
以甲霜灵标准溶液浓度与定量离子峰面积作标准曲线,标样线性方程为:y=18 054x-5 313,相关系数为:r2=0.996,其中y为甲霜灵监测峰面积,x为甲霜灵标准溶液浓度,具体结果见表3、图2。以毒死蜱标准溶液浓度与定量离子峰面积作标准曲线,标样线性方程为:y=23 238x-12 713,相关系数为:r2=0.996,其中y为毒死蜱监测峰面积,x为毒死蜱标准溶液浓度,具体结果见表3、图2。以戊唑醇标准溶液浓度与定量离子峰面积作标准曲线,标样线性方程为:y=3e6x-526 562,相关系数为:r2=0.998,其中y 为戊唑醇监测峰面积,x为戊唑醇标准溶液浓度,具体结果见表3、图2。图2 所示,甲霜灵、戊唑醇及毒死蜱的标准溶液的浓度与其对应的峰面积之间呈良好的线性关系。
2.3 定量限
以最小添加回收浓度作为方法的定量限,在上述色谱条件下,甲霜灵、戊唑醇和毒死蜱的最低添加浓度均为0.2 mg/kg。
2.4 准确度和精确度
以添加回收率评价正确度,在空白果蔬汁中分别添加3 档浓度的甲霜灵、戊唑醇及毒死蜱标准溶液,每档重复5次,具体结果见表4。

图1 a.甲霜灵、毒死蜱、戊唑醇质谱扫描图;b.甲霜灵离子对图谱;c.戊唑醇离子对图谱;d.毒死蜱离子对图谱
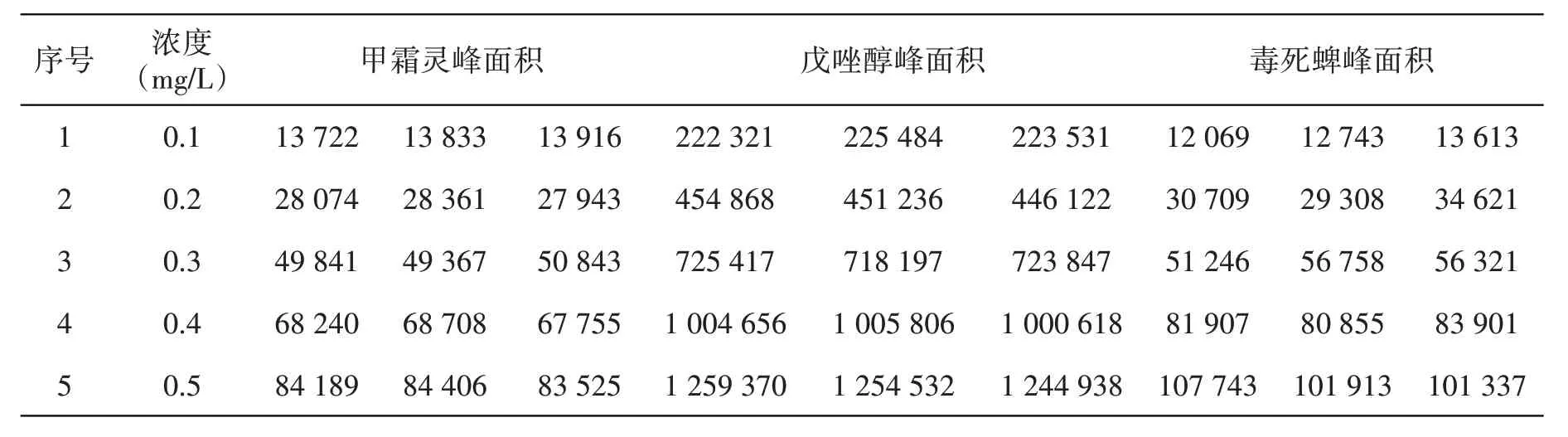
表3 甲霜灵、戊唑醇及毒死蜱标准溶液的峰面积响应值

图2 甲霜灵、戊唑醇及毒死蜱峰面积响应值与标准浓度对应的标准曲线
甲霜灵、戊唑醇及毒死蜱在果蔬汁中的添加浓度为0.2 mg/kg、0.3 mg/kg、0.4 mg/kg,平均回收率分别为91.5%~10.6%,87.5%~89.8%和84.2%~91.7%。
以相对标准偏差(RSD)评价精密度,在空白果蔬汁中分别添加3 档浓度的甲霜灵、戊唑醇及毒死蜱标准溶液,每档重复5次,具体结果见表4。
甲霜灵、戊唑醇及毒死蜱在果蔬汁中添加浓度为0.2 mg/kg、0.3 mg/kg、0.4 mg/kg,相对标准偏差(RSD)分别为1.7%~2.2%,0.7%~2.2%和0.9%~5.0%。
由表4 可知,在此方法下同时检测果蔬汁中甲霜灵、戊唑醇及毒死蜱残留量可满足农药残留分析的要求[7],且方法的重复性良好。
2.5 基质效应
在相同检测条件下,对基质标准工作液和试剂标准工作液进行分析,制作拟合曲线,根据公式(1)和斜率比(ME)来评价基质效应[8]。若ME值大于30%,说明基质增强了待测物的响应值。
式中:A为试剂标准工作液曲线斜率,B为基质标准工作液曲线斜率。
基质影响(Matrix Effect)评价标准:对纯溶剂与基质配制标准曲线的斜率进行比较,若基质影响ME%≥30%,则采用基质配制标准溶液制作标准曲线;若ME%<30%,可采用纯溶剂配制工作溶液,具体结果见表5,基质影响ME<30%,故采用溶剂配制的标准溶液制作标准曲线。
2.6 果蔬汁样品的检测
采用本研究建立的检测方法对果蔬汁样品进行测定,结果见图3~图5。从图3~图5 可知,果蔬汁样品中甲霜灵、戊唑醇、毒死蜱残留量的检测在该方法下所得谱图与标准品谱图一致,峰形尖锐,特征性强,且出峰时间短。

表4 甲霜灵、戊唑醇及毒死蜱在果蔬汁中的添加回收率
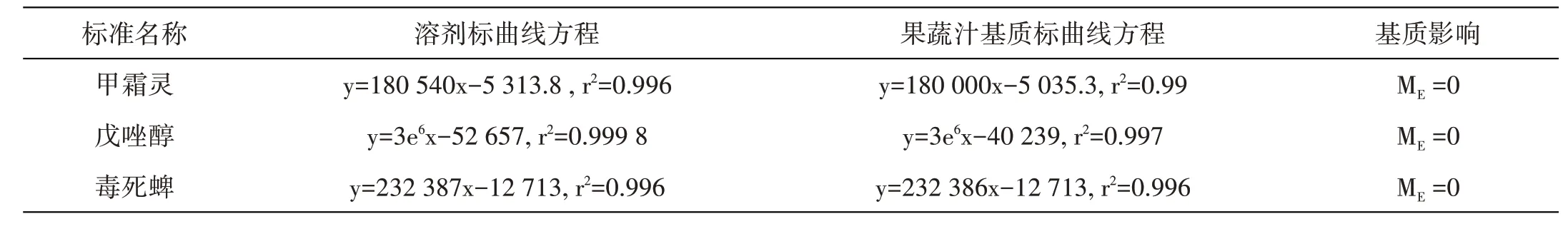
表5 甲霜灵、戊唑醇及毒死蜱溶剂标与其对应的在果蔬汁基质标影响评价

图3 甲霜灵样品典型色谱图

图4 戊唑醇样品典型色谱图

图5 毒死蜱样品典型色谱图
3 结论
本研究确定了果蔬汁样品中甲霜灵、戊唑醇、毒死蜱残留的高效液相串联质谱的快速检测方法。样品经QuEChERS 净化方法,提取后可直接进样检测,同时监测三种农药的残留量。该方法快速简便,大大缩短了试验时间,节约成本,且灵敏度高,准确性强,在实际检测中应用性较强。

