miR-497-5p靶向WWP1调控人瘢痕疙瘩成纤维细胞的增殖和凋亡
高栋梁,高东东,池 凯,杨喜明
(1.延安大学附属医院 烧伤整形手外科,陕西 延安716000;2.郑州郑东诺亚一家医疗美容门诊部 整形外科,河南 郑州450000)
瘢痕疙瘩是一种良性的真皮纤维增生性肿瘤,是皮肤科和外科手术中最常见、最棘手的问题之一。瘢痕疙瘩在正常的皮肤上扩张超过原始伤口的边缘,常伴有疼痛、瘙痒、畸形甚至严重的功能损害,严重影响患者的生活质量[1]。由于对瘢痕疙瘩的发病机制认识不足,瘢痕疙瘩的治疗仍有许多问题需要解决,并且瘢痕疙瘩的复发率高,术后畸形多,单纯手术切除难以治愈[2,3],因此需要开发新的治疗策略。微小RNA(microRNA,miRNA/miR)是一种短链的非编码RNA,大约包含22个核苷酸,能够通过与靶mRNA的互补作用在转录后调节基因表达[4]。miRNA被认为在许多皮肤疾病中失调,包括瘢痕疙瘩[5]。研究表明,miR-497-5p在胃癌组织中下调表达,抑制其表达促进胃癌细胞的增殖和生长,过表达miR-497-5p抑制胃癌细胞的增殖和生长[6]。miR-497-5p在结直肠癌组织和细胞中低表达,上调其表达抑制结直肠癌细胞的增殖、迁移和侵袭[7]。与正常皮肤相比,瘢痕疙瘩组织中含有WW结构域的E3泛素蛋白连接酶1(WW domain containing E3 ubiquitin protein ligase 1,WWP1) mRNA水平显著升高,可能参与成纤维细胞过度增生及细胞外基质沉积而导致瘢痕疙瘩的发生发展[8]。但miR-497-5p在瘢痕疙瘩成纤维细胞中的表达及其对瘢痕疙瘩成纤维细胞增殖和凋亡的影响,且miR-497-5p对WWP1是否存在靶向调控关系目前还尚未可知。因此,本研究以人瘢痕疙瘩成纤维细胞(Keloid Fibroblast,KFB)为对象,考察miR-497-5p的表达,并评价miR-497-5p是否通过靶向调控WWP1影响KFB的细胞增殖和凋亡,旨在揭示其可能的分子机制。
1 材料与方法
1.1 主要试剂
DMEM培养基(Dulbecco,s Modified Eagle Medium)购自购自Gibco公司,胎牛血清、TRIzol、Lipofectamine 2000、实时荧光定量PCR(Quantitative real-time polymerase chain reaction,qPCR)检测试剂盒购自Invitrogen公司,WWP1、细胞周期蛋白D1(CyclinD1)、p21、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自北京中杉金桥生物公司,miR-497-5p、anti-miR-497-5p、si-WWP1、pcDNA-WWP1、荧光素酶报告载体购自上海GenePhama公司,噻唑蓝(Methyl thiazolyl tetrazolium,MTT)购自美国Sigma公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物公司。
1.2 细胞分离培养
收集延安大学附属医院患者术后瘢痕疙瘩和正常皮肤标本,参照杨力等[9]的方法,进行KFB和正常皮肤成纤维细胞(Normal Skin Fibroblast,NFB)的分离培养,即新鲜标本经0.5%洗必泰浸泡、生理盐水洗涤后剪碎成0.5-1 mm3大小的样本,在含20%胎牛血清的DMEM培养基中培养,细胞生长至70%汇合时进行传代。
1.3 qPCR检测miR-497-5p、WWP1 mRNA表达
使用TRIzol试剂提取KFB和NFB总RNA,逆转录后,以制成的cDNA为模板,依据qPCR试剂盒说明书的指示,以2-ΔΔCt法测定miR-497-5p、WWP1 mRNA表达。引物序列:miR-497-5p正向5’-CCTTCAGCAGCACACTGTGG-3’,反向5’-CAGTGCAGGGTCCGAGGTAT-3’;内参U6正向5’-CTCGCTTCGGCAGCACA-3’,反向5’-AACGCTTCACGAATTTGCGT-3’;WWP1正向5’-GTATGGATCCTGTACGGCAGCA-3’,反向5’-GTTGTGGTCTCTCCCATGTGGT-3’;内参GAPDH正向5’-TGAAGGTCGGAGTCAACGGA- 3’,反向5’-CCTGGAAGATGGTGATGGGAT- 3’。
1.4 Western blot检测WWP1蛋白表达
RIPA裂解液提取KFB和NFB总蛋白,将20 μg蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)以分离蛋白,转至聚偏氟乙烯膜,经5%脱脂奶粉封闭,将膜与1:1000稀释的WWP1蛋白一抗4℃共同孵育过夜,Tris-HCl-Tween缓冲盐溶液(Tris buffered saline with Tween,TBST)充分洗涤,之后加入1∶5000稀释的二抗,室温孵育1 h,TBST充分洗涤后进行曝光显影,GAPDH作为内参,分析WWP1蛋白表达。
1.5 双荧光素酶报告实验
利用TargetScan(http://www.targetscan.org/)预测工具发现miR-497-5p与WWP1的3’非编码区(3’untranslated region,3’UTR)中存在部分互补配对的碱基,猜想WWP1可能是miR-497-5p的靶基因。分别构建包含miR-497-5p结合位点的WWP1野生型(WT)和突变型(MUT)3’UTR荧光素酶载体,分别记为WT-WWP1和MUT-WWP1,将其与miR-497-5p共转染入KFB内,48h进行双荧光素酶活性检测。
1.6 细胞转染
将KFB接种于6孔板,密度为1×105个/mL细胞。miR-497-5p过表达及其阴性对照miR-NC使用miR-497-5p模拟物、miR-NC转染细胞,抑制WWP1表达与其阴性对照用si-WWP1、si-NC转染细胞,WWP1过表达和其阴性对照用pcDNA-WWP1、pcDNA进行转染。所有转染均按照制造商的说明,使用Lipofectamine 2000 进行操作。转染48 h后,根据1.3或1.4所述方法检测miR-497-5p或WWP1、CyclinD1、p21、Bcl-2、Bax蛋白表达,并测定细胞增殖、凋亡。
1.7 MTT法检测细胞增殖
在96孔板中接种KFB,密度为5×104个/mL,连续培养24 h、48 h、72 h,加入MTT溶液20 μl,孵育4 h,加入二甲基亚砜150 μl,摇床震荡反应10 min,通过酶标仪获得波长490 nm处的KFB吸光值(OD490 nm)。
1.8 流式细胞术检测细胞凋亡
Annexin V-FITC/PI 细胞凋亡检测试剂盒用于细胞凋亡测定。收集1×105个KFB,加入缓冲液500 μl制成细胞悬液,加入Annexin V-FITC 5 μl充分混合,加入PI 5 μl充分混合,遮光孵育15 min,通过流式细胞仪分析细胞凋亡情况。
1.9 统计学分析
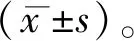
2 结果
2.1 miR-497-5p和WWP1在瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞中的表达
qPCR检测数据显示(表1),KFB中miR-497-5p表达量明显低于NFB组,WWP1 mRNA表达量显著高于NFB组(P<0.05)。Western blot检测结果表明(表1、图1),KFB中WWP1蛋白表达量明显高于NFB组(P<0.05)。
2.2 miR-497-5p靶向调控WWP1的表达
TargetScan(http://www.targetscan.org/)工具预测发现(图2A),WWP1的3’UTR中含有与miR-497-5p互补的核苷酸序列。双荧光素酶报告实验数据表明(表2),miR-497-5p明显抑制WT-WWP1荧光素酶活性(P<0.05),对MUT-WWP1荧光素酶活性无显著影响。Western blot检测结果显示(表3、图2B),miR-497-5p较miR-NC组显著抑制WWP1蛋白表达量,anti-miR-497-5p较anti-miR-NC明显提高WWP1蛋白表达量(P<0.05)。
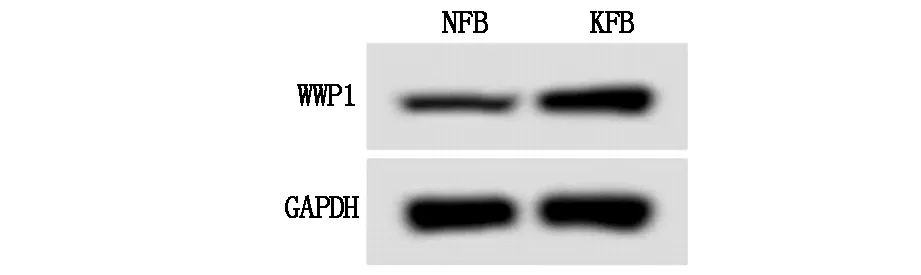
图1 WWP1蛋白表达

表1 miR-497-5p和WWP1在瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞中的表达
注:与NFB组比较,*P<0.05
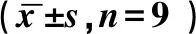
表2 双荧光素酶报告实验
注:与miR-NC组比较,*P<0.05
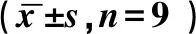
表3 miR-497-5p调控WWP1蛋白的表达
注:与miR-NC组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05
2.3 miR-497-5p过表达对瘢痕疙瘩成纤维细胞增殖和凋亡的影响
在KFB中转染miR-497-5p,发现与miR-NC组比较,miR-497-5p表达量大幅增加(P<0.05,表4)。与miR-NC组比较,miR-497-5p过表达明显降低KFB 48 h、72 h的细胞活性(表4),提高细胞凋亡率(表4、图3B),减少CyclinD1、Bcl-2蛋白表达量,提高p21、Bax蛋白水平(表4、图3A),均具有显著差异(P<0.05)。
2.4 抑制WWP1表达对瘢痕疙瘩成纤维细胞增殖和凋亡的影响
在KFB中转染si-WWP1,发现WWP1蛋白表达量显著低于si-NC组(P<0.05,表5、图4)。同si-NC组相比,抑制WWP1表达明显降低KFB 48 h、72 h的细胞活性,提高细胞凋亡率(表5),降低CyclinD1、Bcl-2蛋白水平,增加p21、Bax蛋白表达量(表5、图4),差异均具有显著性(P<0.05)。

图2 miR-497-5p靶向调控WWP1的表达
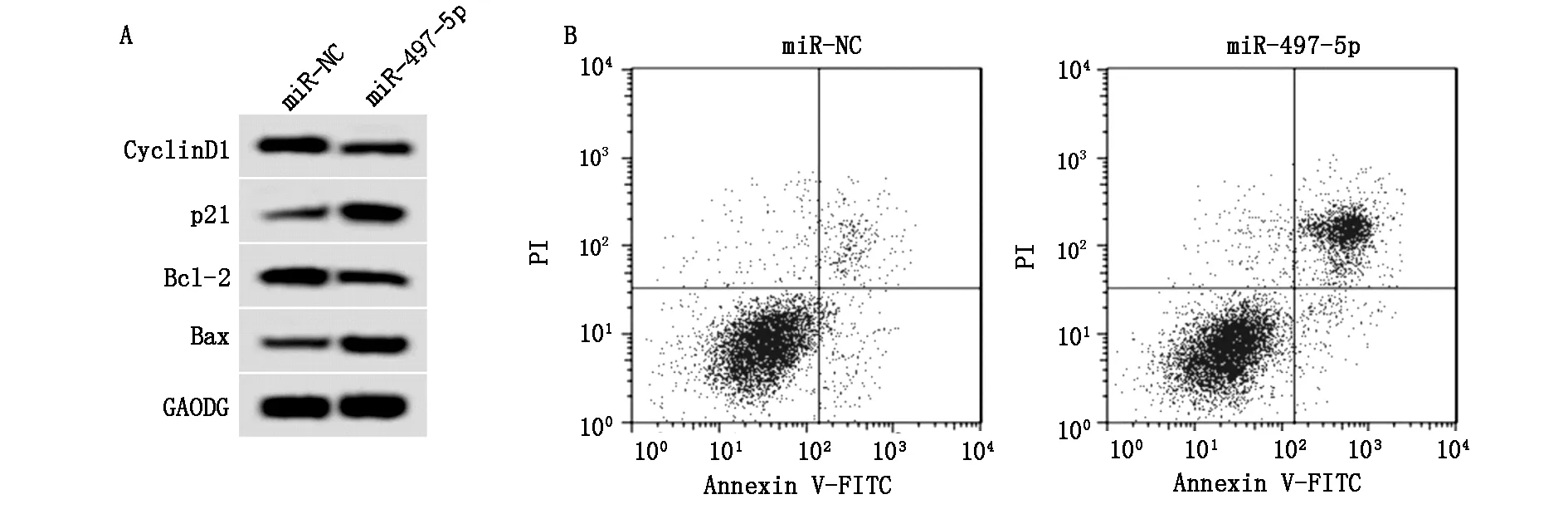
图3 miR-497-5p过表达对瘢痕疙瘩成纤维细胞增殖和凋亡的影响
表4 miR-497-5p过表达对瘢痕疙瘩成纤维细胞增殖和凋亡的影响
注:与miR-NC组比较,*P<0.05
2.5 WWP1过表达逆转了miR-497-5p过表达对瘢痕疙瘩成纤维细胞增殖和凋亡的作用
相较于miR-NC组,miR-497-5p过表达明显减少KFB中WWP1、CyclinD1、Bcl-2蛋白表达量,提高p21、Bax蛋白水平(表6、图5),降低48 h、72 h的细胞活性,并增加细胞凋亡率(表6),均具有显著差异(P<0.05)。与miR-497-5p+pcDNA组比较,共转染miR-497-5p和pcDNA-WWP1明显提高KFB中WWP1、CyclinD1、Bcl-2蛋白水平,降低p21、Bax蛋白表达量(表6、图5),提高48 h、72 h的细胞活性,及减少细胞凋亡率(表6),差异均具有显著性(P<0.05)。
表5 抑制WWP1表达对瘢痕疙瘩成纤维细胞增殖和凋亡的影响
注:与si-NC组比较,*P<0.05
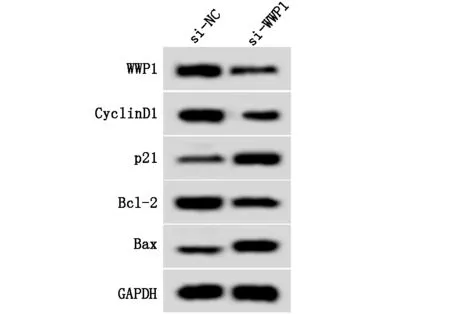
图4 WWP1和增殖、凋亡相关蛋白表达
3 讨论
瘢痕疙瘩是一种良性,局部侵袭性和复发性皮肤纤维增生性疾病,它是人类独有的,代表了一系列异常伤口愈合的终点,具有美学上的毁容性,并可导致重大功能损害[10]。瘢痕疙瘩是由于皮肤损伤后创面愈合反应异常引起的,其特征是成纤维细胞增殖增加,过度合成和沉积细胞外基质,尤其是胶原蛋白,长期持续纤维化和炎症[11],在真皮中呈舌状前进边缘,类似于浸润性肿瘤生长[10]。现阶段,瘢痕疙瘩对所有临床治疗都有抵抗作用,术后复发率高,危及许多患者的生活质量。然而瘢痕疙瘩形成的关键机制尚不清楚。因此,进一步研究瘢痕疙瘩的细胞和分子机制可能是改善瘢痕疙瘩临床管理策略的关键。

图5 WWP1和增殖、凋亡相关蛋白表达

表6 WWP1过表达逆转了miR-497-5p过表达对瘢痕疙瘩成纤维细胞增殖和凋亡的作用
注:与miR-NC组比较,*P<0.05;与miR-497-5p+pcDNA组比较,#P<0.05
miRNA是一类高度保守的内源性非编码RNA,它们通过与靶mRNA 3’UTR结合,负调控mRNA的表达,导致降解或翻译抑制,影响细胞增殖、分化、发育、代谢和凋亡等许多生物学过程中[12]。作为许多疾病过程中必不可少的表观遗传调控因子,miRNA在瘢痕疙瘩中表达异常,参与瘢痕疙瘩的发生发展,可以作为瘢痕疙瘩有希望的新型预防和治疗靶标[13,14]。例如,瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中miR-141-3p的水平显著低于正常组织和正常皮肤成纤维细胞,miR-141-3p过表达可显著降低瘢痕疙瘩成纤维细胞的增殖、迁移和促进细胞凋亡,而miR-141-3p敲低时,对瘢痕疙瘩成纤维细胞作用相反[15]。miR-205-5p在瘢痕组织标本和细胞中均有明显的低表达,miR-205-5p过表达显著损害细胞活力,诱导细胞凋亡,抑制细胞的侵袭和迁移能力,可以拮抗瘢痕疙瘩[16]。miR-497-5p已被提出作为人类癌症的抑癌miRNA,资料显示,miR-497-5p在非小细胞肺癌中表达下调,过表达miR-497-5p抑制非小细胞肺癌细胞的增殖和侵袭[17]。miR-497-5p在骨肉瘤组织和细胞中表达水平降低,上调其表达抑制骨肉瘤细胞的增殖,并诱导细胞凋亡[18]。但是miR-497-5p在瘢痕疙瘩成纤维细胞中的作用鲜见报道。本研究中,与正常皮肤成纤维细胞相比,miR-497-5p在瘢痕疙瘩成纤维细胞中的表达明显下调(P<0.05)。miR-497-5p过表达明显降低瘢痕疙瘩成纤维细胞48 h、72 h的细胞活性、CyclinD1、Bcl-2蛋白表达,以及提高细胞凋亡率、p21、Bax蛋白水平(P<0.05),显示出一定的抑制瘢痕疙瘩的活性。
WWP1在多种人类恶性肿瘤中表达上调,是一种潜在的致癌基因,在细胞增殖、凋亡和侵袭中发挥重要作用[19-21]。研究发现,与正常对照组相比,结直肠癌组织中WWP1 mRNA和蛋白普遍上调,WWP1表达高的结直肠癌患者总体生存期较低(P<0.001),无病生存期较低(P=0.001),是影响结直肠癌患者总体生存率的独立预后因素。另外,WWP1的缺失显著抑制结直肠癌细胞的肿瘤增殖和侵袭性,且过表达WWP1的细胞明显具有更高的增殖和侵袭能力[22]。WWP1在骨肉瘤和胃癌组织中高表达,敲低其表达抑制骨肉瘤和胃癌细胞的增殖,促进细胞凋亡[23,24]。本实验中,瘢痕疙瘩成纤维细胞中WWP1 mRNA和蛋白表达明显上调,抑制WWP1表达明显降低瘢痕疙瘩成纤维细胞48 h、72 h的细胞活性、CyclinD1、Bcl-2蛋白表达,提高细胞凋亡率、p21、Bax蛋白表达(P<0.05),提示抑制WWP1表达可能有助于抑制瘢痕疙瘩生长。另外,生物信息学预测结合双荧光素报告实验证实miR-497-5p靶向调控WWP1表达。WWP1过表达逆转了miR-497-5p过表达抑制瘢痕疙瘩成纤维细胞增殖、WWP1、CyclinD1、Bcl-2蛋白表达的作用,和促进细胞凋亡、p21、Bax蛋白表达的作用。这些结果说明,靶向调控WWP1表达可能是miR-497-5p抑制瘢痕疙瘩的重要途径之一。
综上所述,miR-497-5p在瘢痕疙瘩成纤维细胞中表达下调,过表达miR-497-5p可以明显抑制瘢痕疙瘩成纤维细胞增殖,并促进细胞凋亡。另外,WWP1在瘢痕疙瘩成纤维细胞中表达上调,miR-497-5p对瘢痕疙瘩成纤维细胞的抑制作用可能是通过直接靶向调控WWP1表达来实现的,为瘢痕疙瘩的管理提供了新的线索。

