非酒精性脂肪性肝病患者葡萄糖代谢率与血清炎症指标变化的关系
余启馨,叶建红,林 旋,王家乐,何东盈,劳美铃
(1.广州中医药大学,广东 广州510405;2.佛山市中医院 内分泌科,广东 佛山528000)
目前非酒精性脂肪性肝病(NAFLD)的发病机制仍未完全明确,胰岛素抵抗是NAFLD发病的重要环节之一。而炎症因子又与胰岛素抵抗关系密切,近年来研究显示,炎症因子如超敏-C反应蛋白(hs-CRP)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等可以通过影响信号传导通路引起胰岛素抵抗[1],可能是胰岛素抵抗的主要分子机制。本研究采用评估胰岛素抵抗的金标准—高胰岛素正常血糖钳夹实验,定量检测葡萄糖代谢率(M),精确评估胰岛素抵抗程度,探讨NAFLD患者胰岛素抵抗与血清炎症因子hs-CRP、IL-6、TNF-α水平变化的关系。
1 资料与方法
1.1 研究对象
所有研究对象均来自佛山市中医院内分泌科,根据2018年中华医学会肝脏病学分会脂肪肝和酒精性肝病学分会提出的NAFLD诊断标准[2]筛选NAFLD患者30例,其中男18例,女12例,年龄32-60岁。排除已明确诊断为糖尿病、合并严重肝、肾功能损害、心脑血管病、甲状腺疾病等患者。另选择同期年龄、性别相匹配的健康体检者30例为对照组,男19例,女11例,经检测血糖、血脂、肝功能、血压均正常。
1.2 方法
1.2.1生化指标与血清炎症指标测定 采用酶化学发光法测定胰岛素, C 肽及皮质醇;采用酶联免疫吸附法检测 hs-CRP,IL-6,TNF-α,试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书操作。
1.2.2高胰岛素-正常血糖钳夹试验 所有受试者均进行高胰岛素-正常血糖钳夹试验,具体操作方法参考贾伟平[3]的报道以及我们改进的方法[4]。 操作方法:试验前一晚8点后禁食,试验当天上午8点排空小便后平静卧床。分别于两侧上肢建立静脉通道,一侧上肢置于温度为45±3℃的恒温套中以获得动脉化的静脉血样,输注生理盐水以维持取血,另一侧用于输注20%葡萄糖液和胰岛素溶液。在钳夹试验开始10 min内输注负荷量胰岛素溶液(Novolin R,40 U/mL,丹麦Novo公司),使血浆胰岛素水平迅速升高,随后140 min内以40 mU·m-2·min-1速率持续输注,在此期间,每5 min测定1次动脉化的静脉血葡萄糖。钳夹期间每10 min取血测定胰岛素,每30 min取血标本测 C肽和皮质醇。计算钳夹过程中120-150 min(稳态期)的M,作为评价IR程度的指标。所有血样均离心分离血清,-20℃保存待测胰岛素,C肽及皮质醇。实验结束后留取小便测定尿糖浓度。
1.2.3统计学方法 统计分析在SPSS 20.0统计软件包上完成,采用两独立独立样本t检验、秩和检验,相关分析采用Pearson法。显著性水准为P<0.05。
2 结果
2.1 NAFLD组与对照组基线资料、生化指标与炎症指标比较
见表1。两组在性别、年龄等方面无显著差异(P>0.05),资料具有可比性;两组在TC、LDL-C等方面无显著性差异(P>0.05),NAFLD组的WC,BMI,2hPG,FINS,TG,ALT、AST等均显著高于对照组(P<0.01),HDL-C显著低于对照组(P<0.01); NAFLD 组hs-CRP、IL-6 和 TNF-α 水平均高于对照组,差异有统计学意义(P<0.01)。
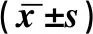
表1 对照组与NAFLD组临床资料、生化指标IL-6、hs-CRP、TNF-α比较
注:△P>0.05 vs对照组,*P<0.01 vs对照组,IL-6、hs-CRP、TNF-α用中位数(上-下1/4)表示。
2.2 高胰岛素-正常血糖钳夹技术的建立与评估
2.2.1钳夹过程中血糖、血清胰岛素水平 基础状态对照组和NAFLD组血糖水平分别为(5.07±0.60) mmol/L和(5.58±0.63) mmol/L,在钳夹试验开始30 min后直至试验结束,血糖稳定在目标值5.0 mmol/L,血糖变异度<5%。基础状态对照组和NAFLD组胰岛素水平分别为(9.03±3.30) mIU/L和(12.96±5.06)mIU/L,正常血糖钳夹开始后,血清胰岛素水平迅速升高,在10 min达到高峰,对照组和NAFLD组分别为(97.28±8.61) mIU/L和(125.51±11.78) mIU/L,随后维持在一个高水平直至钳夹结束,对照组和NAFLD组分别为(66.75±5.67) mIU/L和(73.64±6.59) mIU/L。
2.2.2钳夹过程中内源性胰岛素分泌与皮质醇变化 如表2所示,基础状态对照组和NAFLD组C肽水平分别为(415.35±189.66) pmol/L和(601.54±201.23) pmol/L,与基础状态相比,两组C肽水平在整个钳夹过程各个时点中均呈下降趋势。基础状态对照组和NAFLD组皮质醇水平分别为(211.84±121.37)nmol/L 和(224.74±105.38)nmol/L ,与基础状态相比较,两组皮质醇水平在整个钳夹过程各个时点中均无异常升高。
2.2.3高胰岛素正常钳夹实验中葡萄糖代谢 葡萄糖输注率在钳夹试验的前60 min内上升较快,NAFLD组的葡萄糖输注率在60 min时为(3.48±0.29) mg·kg-1·min-1,对照组为(6.75±0.43)mg·kg-1·min-1,此后两组趋于缓慢上升,在120 min时达到稳态。稳态时(120-150 min)对照组和NAFLD组的M分别为(8.65±1.63 )mg·kg-1·min-1和(4.72±1.37)mg·kg-1·min-1,NAFLD组的M显著低于对照组,差异有统计学意义(P<0.01)。
2.3 M值与各指标的相关分析
在NAFLD组,与M相关的临床指标有WC、BMI、TG、HDL-C、FINS,r值分别为-0.483、-0.449、-0.565、0.433、-0.578,P分别为0.005、0.012、0.001、0.015、0.001,IL-6、hs-CRP及TNF-α均与M呈负相关(r=-0.563、-0.580、-0.598,P=0.001、0.001 、0.001),见表3。
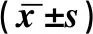
表2 钳夹试验中对照组与NAFLD组C肽与皮质醇变化

表3 NAFLD组M值与各指标的相关分析
3 讨论
NAFLD的发病机制尚未全明了,也缺乏特异的针对性治疗药物。已有相关细胞实验,动物实验以及临床研究等表明,胰岛素抵抗可能是NAFLD的重要发病机制之一[5,6]。然而在既往的研究中,评估胰岛素胰岛素抵抗的方法大多采用HOMA-IR,这一方法虽简单易行,而最大局限是干扰因素太多,也不能精确、定量评估胰岛素抵抗程度。为此,我们采用评估胰岛素抵抗的“金标准”—高胰岛素正常血糖钳夹技术,检测NAFLD患者的M,评估其胰岛素抵抗程度。本研究结果显示,NAFLD患者的M显著低于正常人群,表明其有明显的胰岛素抵抗。同时,本研究中也发现,NAFLD患者具有明显的超重,高血脂,糖耐量异常等临床特征,提示NAFLD与代谢综合征(MS)具有密切的联系,其胰岛素抵抗的发生可能是诸多代谢紊乱共同导致的结果,也提示我们在NAFLD的防治中更应注重整体的综合治疗。
近年来,炎症机制与胰岛素抵抗的关系已成为当今研究的热点。研究表明,2型糖尿病及肥胖状态下白色脂肪组织中积聚的巨噬细胞和前脂肪细胞可分泌大量炎症因子,各种炎症因子主要通过 IKK/NF-κB通路导致胰岛素抵抗。在既往的研究发现,MS人群的M明显降低,血浆炎症抑制白介素10明显降低[7],炎症因子白介素18明显升高,提示MS人群的胰岛素抵抗与炎症变化有关。此外,我们进行了MS人群M与血清脂肪因子关系进行研究,结果表明[8], MS人群的葡萄糖代谢率明显降低,血清脂联素明显降低,瘦素与抵抗素水平明显升高,其胰岛素抵抗与血清脂联素降低,瘦素与抵抗素升高有关。为了进一步探讨与MS关系密切的NAFLD患者的胰岛素抵抗与炎症因子的关系,本研究检测了评估慢性炎症状态的代表性指标TNF-α,IL-6与hs-CRP水平。结果显示,NAFLD 患者血清的TNF-α,IL-6与hs-CRP水平均显著升高,提示本组NAFLD患者体内存在明显的慢性炎症状态。
CRP主要在肝脏合成,为维持其作为急性期反应物的作用,肝脏中CRP的产生在很大程度上受促炎细胞因子IL-6和白细胞介素1β(IL-1β)的影响, IL-6似乎在调节CRP表达中起着更重要的作用,TNF-α可通过刺激IL-6的表达从而增强肝脏CRP的合成,反过来CRP也可以刺激单核细胞释放IL-6,IL-1和TNF-α,发挥致炎作用。Lee[9]等研究证实,健康人hs-CRP水平的升高可增加NAFLD的危险性,升高的hs-CRP水平与肝脏的脂肪含量正相关。Yeniova等[10]的研究证实,hs-CRP与肥胖的NAFLD患者脂肪组织和肝脏的脂肪变性密切相关,并可作为预测NAFLD肝脂肪变性的指标。
目前研究显示IL-6 可导致肝细胞胰岛素抵抗[11], IL-6是否可导致脂肪细胞和骨骼肌细胞胰岛素抵抗?尚存在争议。多数学者认为IL-6 在脂肪细胞和骨骼肌细胞通过SOCS-3 导致胰岛素抵抗。Klover等[12]发现持续 5 天输注hIL-6 并没有改变小鼠骨骼肌胰岛素敏感性。
TNF-α主要由活化的单核巨噬细胞分泌,研究发现肥胖的啮齿类动物脂肪组织中TNF-α过度表达,TNF-α水平升高与脂肪组织,肝脏与骨骼肌等的胰岛素抵抗均有密切关系[13]。很早以前就有研究发现,TNF-α至少是鼠类胰岛素敏感性的重要调节因子。TNF-α在体外可引起胰岛素受体底物-1(IRS-1)的丝氨酸磷酸化,而丝氨酸磷酸化的IRS-1会抑制胰岛素受体激酶活性及下游包括磷脂酰肌醇-3激酶(PI-3K)在内的信号通路的激活。
有动物的体内和体外实验研究证实,TNF-α,IL-6与hs-CRP水平升高与NF-κB,MAPK及AMPK等信号转导通路有关[14]。而NF-κB,MAPK及AMPK均与胰岛素抵抗发生有着密切关系,这提示炎症因子TNF-α,IL-6与hs-CRP可能通过NF-κB,MAPK及AMPK通路导致NAFLD胰岛素抵抗。而临床NAFLD患者的胰岛素抵抗是否与炎症因子有关呢?本研究相关分析结果证实,本组NAFLD患者的葡萄糖代谢率均与TNF-α,IL-6及hs-CRP水平呈负相关关系,提示NAFLD患者的胰岛素抵抗与TNF-α,IL-6及hs-CRP水平升高有关。而具体机制是否涉及NF-κB,MAPK及AMPK通路,有待进一步研究证实。

