鸡蛔虫黄山市分离株的形态学和分子特征分析
饶天宇,申夕,朱志伟,许薇,赵金红*
鸡蛔虫(Ascaridiagalli)隶属于线虫纲(Nematoda)、尾感器亚纲(Chromadorea)、蛔目(Ascaridida)、蛔科(Ascarididae)、禽蛔属(Ascaridia),主要寄生在家鸡等禽类的小肠,也可寄生于胃和食道等其他消化器官中引起鸡蛔虫病[1]。鸡蛔虫主要感染雏鸡,患病雏鸡出现食欲减退、消瘦虚弱、生长迟缓、下痢和便秘交替等表现,有时出现带脓血便,逐渐消瘦而死亡[2]。鸡蛔虫病可导致畜禽产业经济效益大幅度下降,严重时甚至会影响我国农业经济的正常发展,对生态和环境造成负面影响[3]。预防和控制鸡蛔虫病传播的前提是对鸡蛔虫物种的准确鉴定,传统的形态学方法有时不能有效地对某些寄生虫种类进行准确鉴定,尤其是对那些形态上相似的虫种。分子生物学技术的迅速发展, 为寄生虫分类学研究提供了新思路和新方法[4]。目前关于鸡蛔虫的形态学特征鲜有报道,本研究详细描述了鸡蛔虫的光镜和电镜下形态学特征,并扩增了鸡蛔虫细胞色素c氧化酶第Ⅰ亚基(cytochrome c oxidase subunit Ⅰ,COⅠ)和核基因内转录间隔区(internal transcribed spacer,ITS)基因,为鸡蛔虫种类的鉴定、预防和控制鸡蛔虫病奠定理论基础。
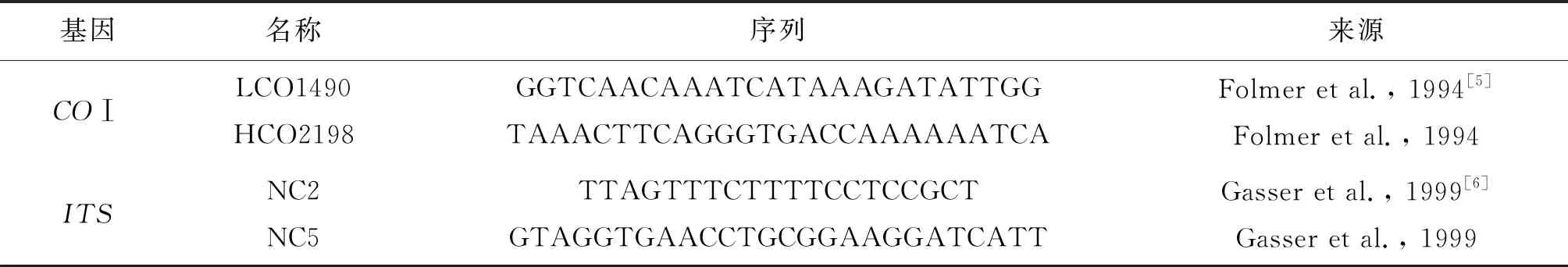
表1 COⅠ和ITS扩增所用 PCR 引物
材料与方法
1 材料
1.1 仪器和试剂 BX51光学显微镜(Olympus)、S-4800发射扫描电子显微镜(Hitachi)、梯度PCR 仪(Bio-Rad)、Microfuge 22R 高速冷冻台式离心机(BECKMAN)和G:BOX荧光凝胶图像分析仪(Syngene)等。克隆载体pMD18-T(Takara, Dalian, China)、DH5α感受态细胞、DNA提取试剂盒(TIANGEN, Beijing, China)、DNA胶回收试剂盒(TIANGEN, Beijing, China)等。
1.2 虫体采集 虫体采集于安徽省黄山市歙县某只家鸡的小肠,收集后用0.9%生理盐水反复冲洗,保存于70%酒精溶液内备用。
2 形态学观察
光学显微镜下逐条观察鸡蛔虫虫体标本。用游标卡尺测量标本体长,显微测微尺测量体宽、食管长宽、尾长以及神经环距头端距离;雄虫需测量交合刺长度、肛前吸盘大小及肛前吸盘到泄殖腔的距离;雌虫需测量阴门距头端距离,以确定阴门的位置。卵测量长宽。测量单位均为mm。
将鸡蛔虫标本用0.1 mol/L的磷酸盐溶液(PBS)清洗、2.5% 戊二醛固定、乙醇梯度脱水和乙酸乙戊酯置换,真空干燥后电镜板粘样镀膜后扫描电镜观察。
3 分子生物学分析
3.1 基因组DNA提取、PCR扩增 将虫体剪碎并研磨,用DNA提取试剂盒提取DNA,保存于-20 ℃备用。PCR扩增体系(25.0 μL):12.5 μL Premix Taq(LA Taq Version 2.0);上下游引物(10 μmol/L)各1.0 μL;模板DNA 2.0 μL;dd H2O 8.5 μL。PCR扩增条件:94℃预变性1 min;94℃变性30 s;56℃退火延伸5 min,35个循环;72℃终延伸10 min。对PCR产物进行2.0%琼脂糖凝胶电泳,DNA胶回收试剂盒纯化后,将纯化产物连接载体,并将重组质粒转化入大肠杆菌(DH5α 感受态细胞)内,利用蓝白斑筛选出阳性菌落,并对其进行菌液PCR鉴定。最后将阳性克隆送往生物有限公司进行双向测序。COⅠ、ITS引物序列由安徽通用生物技术有限公司合成(表1)。
3.2 序列比对和系统进化分析 对测序结果进行人工校正,将获得的核苷酸序列在GenBank数据库中进行BLAST比对分析,以确定是否为目标片段。为避免PCR扩增可能导致的错配而造成的多态性,本研究中用于数据分析的每条序列在同一个体中至少来自3个阳性克隆。检索Genbank已收录的相关线虫的COⅠ和ITS基因并下载其核苷酸序列,然后用Mega 5.10软件进行序列比对,构建邻接法(Neighbor-joining method, NJ)系统发育树,进行1 000次重复的自举检验。
结 果
1 形态学观察
鸡蛔虫呈乳白色。雌雄异体,雌虫个体大于雄虫个体,雌虫的尾部尖直,雄虫的尾部卷曲。光镜下观察成虫唇共3片,大小几乎相等;表皮至食管区增厚,食管上部靠近头端可见增粗的膨大部,即神经环;雄虫尾细长、尖,轻微向腹部弯曲,从泄殖腔延伸出一对等长交合刺,泄殖腔前有一肛前吸盘,为雄虫特有结构(图1);雌虫体中部见阴门,光滑无乳突,阴道相对较长,向前延伸,连接子宫不分裂部分,尾部可见肛门。虫卵为卵圆形,卵壳光滑且薄,卵内容物是未分裂或已分裂的卵细胞(图2)。电镜下可清楚观察到虫体头部唇瓣3个,每个唇有明显成对的肉质突出,唇长大于唇宽;雄虫尾部肛前吸盘为椭圆形,纵径大于横径,泄殖腔位于肛前吸盘下端;雄虫尾部每侧各有10个乳突,3个在肛前位置(肛前吸盘周围),1个在肛侧位置(泄殖腔周围),6个在肛后位置(泄殖腔下端)(图3、图4)。形态学测量指标详见表2(单位均为mm)。虫卵大小(0.21~0.30)mm×(0.12~0.19)mm。
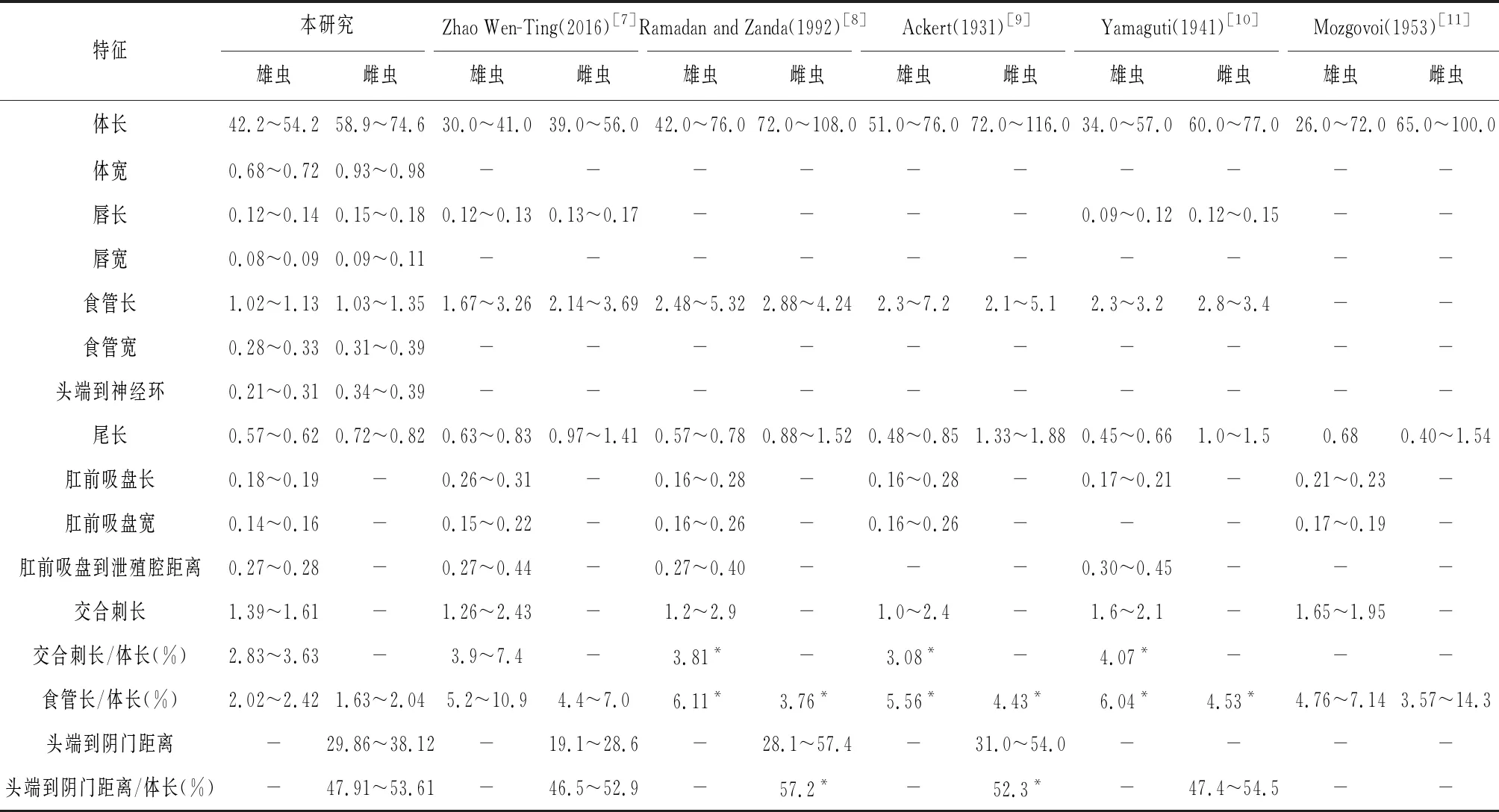
表2 鸡蛔虫雌雄虫形态学测量指标(mm)
注:*形态学数值为平均值;“-”未进行测量
2 COⅠ和ITS基因的PCR扩增
对PCR产物进行2%琼脂糖凝胶电泳,可清晰见到COⅠ条带和ITS条带,大小分别为600 bp和1 000 bp左右,且都无非特异性条带(图5)。经克隆、扩增测序后,获得本研究黄山市分离株鸡蛔虫的COⅠ基因序列长度为655 bp(MN178641),ITS基因片段长度为1 034 bp(MN158368)。
3 同源性比对
黄山分离株鸡蛔虫COⅠ基因序列与已知鸡蛔虫中国西昌分离株的COⅠ基因序列(Genbank登录号为KT613901)核苷酸同源性为100.0%,并且与其序列完全一致;与鸡蛔虫中国湖南分离株的COⅠ基因序列(Genbank登录号为JX624728)核苷酸同源性为99.1%;与鸡蛔虫南非、丹麦、巴西和意大利分离株COⅠ基因序列(Genbank登录号分别为KT388437、GU138670、KP982856和FM178545)核苷酸同源性在97.2%~99.0%。
本研究黄山分离株鸡蛔虫的ITS基因序列与已知鸡蛔虫波兰分离株ITS基因序列(Genbank登录号为KY789470-KY789473和KX683286)核苷酸同源性在99.5%~99.9%;与已知鸽蛔虫ITS基因序列(Genbank登录号为JQ995321和KC905082)核苷酸同源性分别为99.7%和99.3%。
4 系统发育分析
以旋毛虫作为外系,基于COⅠ序列构建的NJ系统发育树,结果发现所分离的鸡蛔虫黄山分离株与西昌分离株(Genbank登录号为KT613901)先聚类形成一个支系,而后与鸡蛔虫其他国家/地区分离株(意大利、巴西、丹麦、南非与湖南)形成一个并系群(图6)。基于ITS序列构建的NJ系统发育树发现,所分离的鸡蛔虫黄山分离株与鸡蛔虫波兰分离株(Genbank登录号为KY789470-KY789473和KX683286)和鸽蛔虫(Genbank登录号为JQ995321和KC905082)形成并系群。在所有蛔目蛔虫所属支系中,鸡蛔虫与鸽蛔虫亲缘关系最近,与其他属类相隔较远(图7)。
讨 论
鸡蛔虫分布广泛,目前中国已经报道鸡蛔虫的有广东、云南、湖南、四川凉山和西昌等地[3],而安徽目前尚无鸡蛔虫的相关报道。本研究系统观察并测量了鸡蛔虫相关形态学指标,并与Zhao[7]、Ramadan和Znada[8]、Ackert[9]、Yamaguti[10]、Mozgovoi[11]等学者描述的鸡蛔虫形态学指标进行了比较分析。对于虫体尾部,本实验雄虫尾长(0.57~0.62 mm)和交合刺长测量值(1.39~1.61 mm)与以上其他研究差异较小,而雌虫尾长值(0.72~0.82 mm)相对偏小,但雄虫尾长皆小于雌虫尾长;其中头端到阴门距离/体长范围在47.91%~53.61%,即阴门位于雌虫体中部,与以上学者测量结果皆相符;但雌雄虫食管长(1.03~1.35和1.02~1.13)、食管长/体长(1.63%~2.04%和2.02%~2.42%)及雄虫交合刺长/体长(2.83%~3.63%)与以上学者测量数值相比均偏小(表2)。由此可见,即使测量标本为同一物种,其形态指标数值在不同性别、不同区域、不同宿主及不同进化阶段仍存在一定差异,也体现出了物种的种内多样性。
近年来,分子生物技术迅速发展,一些线粒体基因和核基因可作为寄生虫分类的重要分子标记,如COⅠ和ITS等[4]。郝桂英等[1]报道的15个西昌鸡蛔虫分离株COⅠ基因序列(1 152bp)碱基变异率为0~2.1%;李佳缘等[12]报道了8个分离自不同省份的鸡蛔虫分离株的COⅠ基因(250 bp)碱基变异率为0~2.5%;伍慧兰等[13]学者研究的20个湖南鸡蛔虫分离株COⅠ基因(394 bp)的碱基变异率在0~2.7%,并且以上学者研究结果均显示COⅠ基因种间变异度远远高于种内变异度,充分证明COⅠ能够作为种间遗传变异研究的分子标记,可用于鸡蛔虫的鉴定。但由于一些影响因素,如近缘种的进化率、遗传差异、线粒体 DNA基因渗入现象以及COⅠ序列比对时内含子的突变等,使得运用单个COⅠ基因比对时缺少准确性。林瑞庆等[14]对鸡蛔虫广州分离株的ITS基因序列进行了PCR扩增,并表明来自中国广州的两个鸡蛔虫样品之间没有差异,这是在国内首次对鸡蛔虫的ITS基因进行了PCR扩增及序列分析比对;此后郝桂英等[15]学者扩增了7个鸡蛔虫凉山州分离株的ITS基因,7个序列的同源性在98.9%~100.0%。以上研究结果证实了鸡蛔虫ITS基因种内差异较小,种间差异较明显的特点。COⅠ、ITS基因可用以探讨属级以下如亲缘关系较近的种、亚种或种群之间等低级分类阶元的系统发育关系[16]。综上,在寄生虫物种鉴定上,可基于形态学特征为依据,结合COⅠ和ITS这两段基因序列,从形态学和分子生物学两方面双向验证,既能快速鉴定物种,又能增加物种鉴定的精确性与可靠性。
本研究测序了鸡蛔虫黄山市分离株的COⅠ和ITS基因,长度分别为655 bp和1 034 bp。COⅠ测序序列与鸡蛔虫参考株的同源性为97.2%~100.0%;ITS测序序列与鸡蛔虫参考株同源性为99.5%~99.9%,同时基于COⅠ和ITS基因分别构建的系统发育树表明鸡蛔虫黄山分离株与其他国家/地区的鸡蛔虫参考株位于同一支系,与以上学者的研究结果相符合。本研究结果对黄山市鸡蛔虫的形态特征进行了观察,并结合COⅠ和ITS基因分子标记对鸡蛔虫进行了物种鉴定,并通过系统发育树了解了鸡蛔虫的种属关系及遗传变异情况,为鸡蛔虫病的控制及预防提供了基础研究资料。
热带病与寄生虫学2020年2期
